查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导读
乳腺癌是全球女性发病率最高的恶性肿瘤,而激素受体阳性的患者占比60%-70%。内分泌治疗是激素受体阳性、HER-2阴性早期乳腺辅助治疗的基石,仅有一小部分患者可以从辅助化疗中获益。临床上主要根据患者的复发风险来推荐是否化疗,21基因检测作为目前最权威的基因检测之一,可以提供独立于临床病理特征的预测指标,大量真实世界研究也证实了其指导临床决策的意义。

◆ 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)
◆ 乳腺肿瘤内科主任医师
◆ 中国抗癌协会乳腺癌专业委员会青年委员会委员
◆ 中国临床肿瘤学会(CSCO)乳腺癌专家委员会委员
◆ 中国抗癌协会第一届整合肿瘤心脏病学分会委员
◆ 中国宋庆龄基金会肿瘤医疗及产学研联盟理事
◆ 浙江省抗癌协会乳腺癌专业委员会委员
◆ 浙江省抗癌协会肿瘤内科专业委员会委员
◆ 浙江省免疫学会第六届理事会理事兼肿瘤免疫与生物治疗专业委员会副主任委员
◆ 浙江省细胞生物学学会理事兼医学细胞生物学专业委员会副主任委员
◆ 浙江省康复医学会肿瘤专业委员会委员
然而随着研究的不断深入,21基因检测也逐渐在其他领域开启探索之路,2020年1月,《JAMA Oncology》上发表了一篇回顾性队列研究,评估淋巴结阳性乳腺癌患者21基因检测复发评分和局部复发之间的关系,为辅助放疗决策提供新的治疗思路[1]。
乳腺癌21基因检测是对21个与乳腺癌相关的基因的mRNA表达量进行定量检测,通过特定的算法将基因表达量转化为数值介于0-100之间的复发评分(Recurrence Score,RS)。21基因检测由16个癌症相关基因和5个内参基因组成。16个癌症相关基因分成五组:
1. 增殖组:Ki67、STK15、Survivin、CCNB1 (cyclin B1)、MYBL2;
2. 侵袭组:MMP11 (stromolysin 3)、CTSL2 (cathepsin L2);
3. 雌激素组:ER、PGR、BCL2、SCUBE2;
4. HER2组:GRB7和HER2(ERBB2);
5. 其他组:GSTM1、CD68、BAG1。
5个内参基因包括:ACTB (b-actin)、GAPDH、RPLPO、GUS、TFRC[2]。通过检测21个基因,得到量化的RS数值,可以预测乳腺癌复发风险以及化疗获益,帮助患者调整个体化治疗方案。
乳腺癌21基因检测最早诞生于2004年,通过对NSABP B-14研究中淋巴结阴性、激素受体阳性浸润型乳腺癌、经他莫昔芬治疗的患者的组织蜡块标本应用RT-PCR技术进行基因筛选,选出了21个与远处复发相关的基因并计算出RS,并根据RS数值对复发风险高中低危分界进行划分:<18为低危,18-30为中危,≥31为高危,结果表明:RS越大,10年远期复发风险越高[2]。2006年,再次对NSABP B-20研究人群用21基因检测进行验证显示:RS越大,越能从化疗获益[3]。上述两项研究都聚焦于淋巴结阴性的患者,而淋巴结阳性的患者能否应用21基因检测进行预测,一直悬而未决,直到2010年SWOG S8814研究的出现。SWOG S8814研究证实绝经后、淋巴结阳性、激素受体阳性的浸润性乳腺癌患者,也可以通过21基因检测预测化疗获益,RS<18的患者预后较好,化疗未增加获益[4]。2015年发表的一项大规模前瞻性临床研究TAILORx,纳入10273例淋巴结阴性、激素受体阳性乳腺癌患者,采用了比传统复发评分界限更低的临界值:11-25之间为中危,结果表明:RS 11-25的乳腺癌患者中,单独内分泌治疗的疗效并不差于化疗联合内分泌治疗,可以豁免化疗[5]。
因为TAILORx研究高级别证据的发表,NCCN指南参考其研究结果对21基因检测的推荐意见做出了相应的修改:对于肿瘤组织大小>0.5cm时,强烈推荐21基因检测:当RS<26时,推荐辅助内分泌治疗;当26≤RS≤30时,辅助内分泌治疗或辅助化疗后序贯内分泌治疗;当RS≥31时,推荐辅助化疗序贯内分泌治疗。目前21基因复发风险评分已成为欧美国家Luminal型乳腺癌辅助治疗决策过程中不可或缺的一项检测项目,但是因为研究都是以欧美人群为主,缺乏在中国人群中的验证,所以在国内的应用价值需要更多的研究数据和临床实践去证实。
《Association Between 21-Gene Assay Recurrence Score and Locoregional Recurrence Rates in Patients With Node-Positive Breast Cancer》这篇文章开启了21基因检测应用于放疗决策的探索之门——对放疗决策的指导意义。
文章的研究对象是SWOG S8814研究中的316例绝经后激素受体阳性、淋巴结阳性、既往接受辅助化疗序贯他莫昔芬治疗或他莫昔芬单药治疗的乳腺癌女性患者。研究方法是回顾性分析,将入组人群分成低RS组和中高RS组(沿用传统的高中低危分界),评估RS和局部复发之间的关系。中位随访8.7年后,研究结果表明:低RS组和中高RS组中分别有5.8%和13.8%发生局部复发。总体人群和未经放射治疗的乳房切除术患者人群,低复发评分组预计的10年累积局部复发率估计均显著低于中高复发评分组(图1、2)。
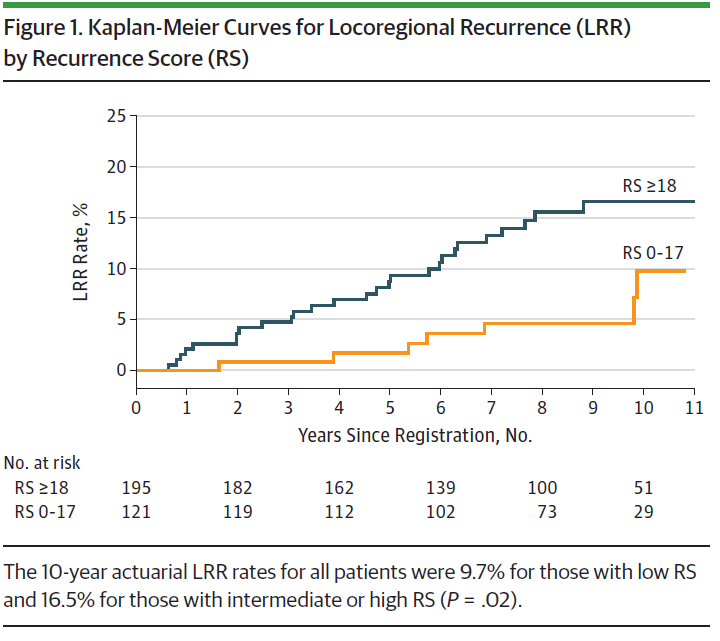
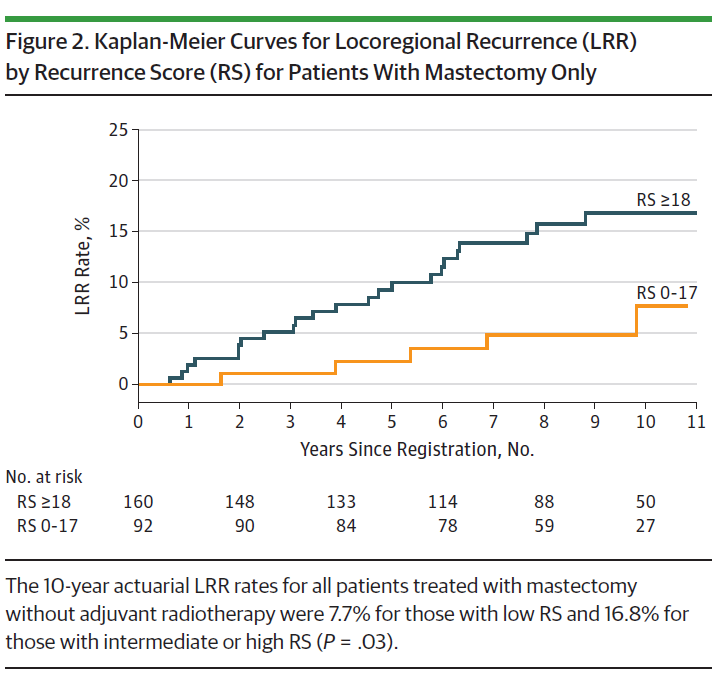
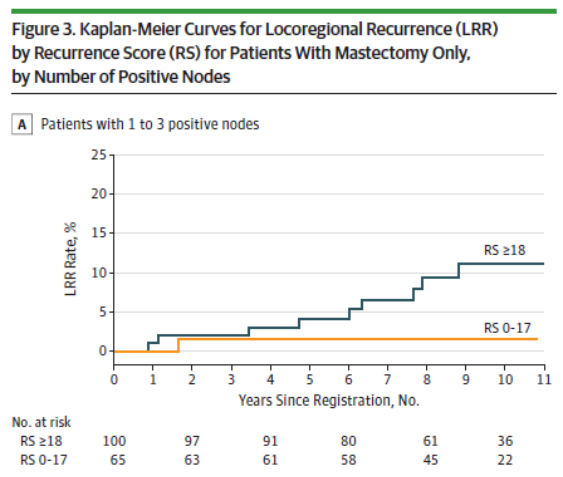
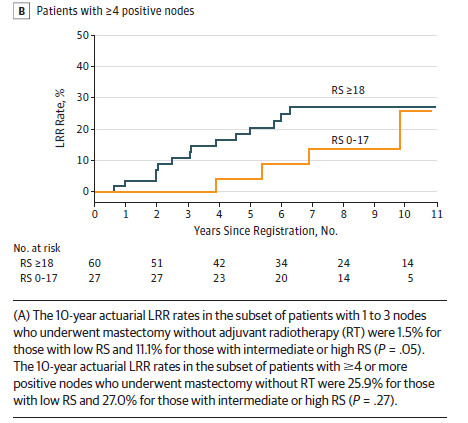
在对淋巴结分层的亚组分析中,乳房切除术后1-3个淋巴结阳性且未接受放射治疗的患者,低RS组预计的10年累积局部复发率为1.5%,而中高RS组为11.1%,而在淋巴结阳性≥4个亚组,两组的局部复发率没有太大的差异(图3A、3B)。
临床上乳腺癌放疗的指征是:
1、几乎所有接受保乳术的患者(除了满足符合CALGB 9343和PRIMEⅡ入组条件并充分权衡利弊后的患者可以豁免放疗)[6-7],
2、乳腺癌改良根治术后:
(1) 原发肿瘤最大直径≥5cm,或肿瘤侵及乳腺皮肤、胸壁;
(2) 腋窝淋巴结转移≥4个;
(3) 1-3个腋窝淋巴结阳性者,根据复发转移高危因素(年龄≤40岁、激素受体阴性、淋巴结清扫数目不完整或比例大于20%、HER-2/neu过表达等)而定[8]。
改良根治术后1-3个淋巴结阳性的患者,是否需要放疗,困扰着很多临床医生。本文结果提示:21基因检测的复发评分是局部复发的一个独立的预后因素,能够对局部复发进行预测并为辅助放疗决策提供新的思路。对于≥4个淋巴结阳性的乳腺癌患者,无论复发评分高低,放疗都应该继续作为标准治疗方案。对于1-3个淋巴结阳性且低复发风险评分的患者,有豁免放疗的可能性,可以免受放疗带来的各种副作用,但多个研究结果表明局部放疗可以降低乳腺癌复发风险,提高无病生存间期[9-10],那么对于淋巴结1-3枚的低复发评分的激素受体阳性乳腺癌患者,放疗“减法”是否真的安全可行?正在进行中的前瞻性的随机对照Ⅲ期临床研究CCTG MA.39(TAILOR RT)研究或许将来可以回答这个问题[11]。如果这部分低复发评分的患者豁免放疗,是否需要强化内分泌治疗?这又是一个需要研究进一步验证的猜测,有待探索。
随着以21基因检测为代表的多基因检测技术的发展和研究的深入,乳腺癌治疗正在经历从个体化治疗向精准医疗的转变过程。与传统的临床病理因素相比,多基因检测能提供更准确地预后预测信息, 为患者选择包括手术、化疗、内分泌治疗、放疗、靶向治疗等综合治疗方案提供参考,是未来乳腺癌精准治疗的重要突破方向之一。
审批号:CN-45961 有效期:2022-2-26
查看更多