查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:安徽省中西医结合医院 王共强
多系统萎缩(multiple system atrophy,MSA)是由Graham和Oppenheimer于1969年首次命名的一组病因不明的孤儿、致命、成人发病的神经退行性疾病,其临床特征是帕金森症、小脑、自主神经和运动功能障碍的各种组合。MSA是一种 α-突触核蛋白病,伴有特定的胶质神经元变性,涉及纹状体黑质、橄榄脑桥小脑和自主神经系统,以及中枢和周围神经系统的其他部分。主要的临床变异与纹状体黑质变性 (MSA-P) 和橄榄脑桥小脑萎缩 (MSA-C) 的形态学表型相关。目前人们越来越认识到 MSA 的临床和病理特征比以前认为的要广泛。
突触核蛋白病是与α-突触核蛋白的错误折叠和聚集相关的神经退行性疾病,包括帕金森病、路易体痴呆和多系统萎缩。多系统萎缩 (MSA) 是突触核蛋白病中进展最快的疾病,这是一组以蛋白质 α-突触核蛋白 (α-Syn) 在中枢和外周自主神经系统中异常沉积为特征的疾病 。在帕金森病 (PD) 患者中,α-Syn 主要积聚在形成路易体和路易神经突的神经元中,而在 MSA 患者中,它主要积聚在形成胶质细胞质包涵体 (GCI) 的少突胶质细胞中。由于自主神经系统功能障碍,很大比例的 MSA 患者出现泌尿生殖系统功能障碍和直立性低血压 (OH),并经常伴有提示快速眼动 (REM) 睡眠行为障碍 (RBD) 的病史。几年之内患者继续发展相当迅速的平衡、言语和协调异常。
虽然我们对这种破坏性疾病的分子发病机制的了解仍然不完整,但更新的共识标准以及联合的流体和成像生物标志物提高了其诊断准确性。这种独特蛋白质病的神经病理学特征是异常α-突触核蛋白在神经胶质(主要是少突胶质细胞)和神经元中的沉积,形成神经胶质和神经元细胞质包涵体,导致细胞功能障碍和死亡。此外,还有广泛的脱髓鞘,其发病机制尚不完全清楚。
目前认为MSA 的发病机制的特点是错误折叠的 α-突触核蛋白从神经元传播到少突胶质细胞,并以“朊病毒样”方式在细胞间扩散、氧化应激、蛋白酶体和线粒体功能障碍、髓磷脂脂质失调、神经营养因子减少、神经炎症和能量衰竭。这些机制的结合最终导致特定于系统的神经变性模式和 MSA 特有的多系统参与。
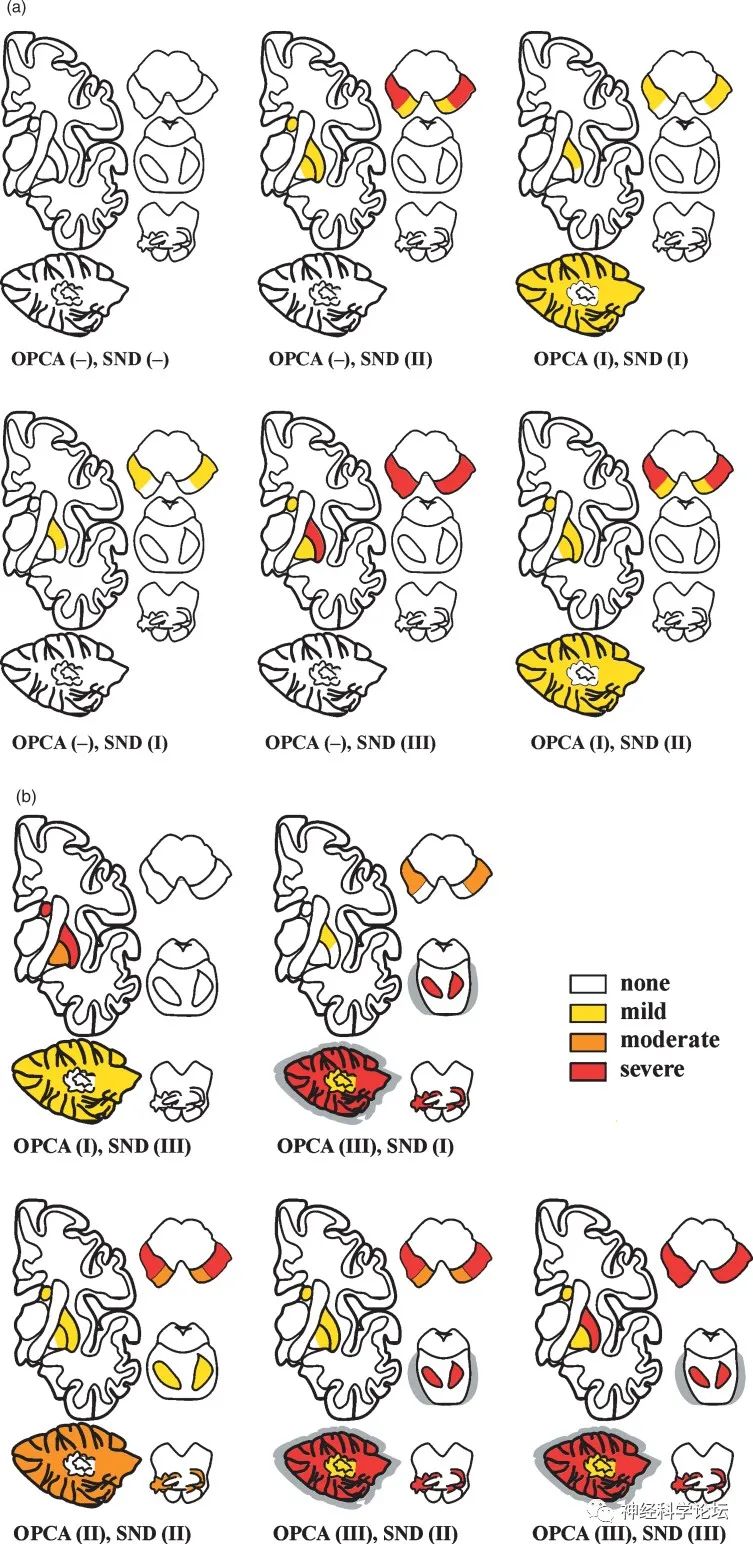
42例尸检证实的MSA(22 MS-P,20 MS-C)不同组合类型SND和OPCA的示意图分布,显示不同严重程度的形态学病变(J Alzheimers Dis. 2018;62(3):1141-1179. )
MSA根据其最初的主要运动障碍表现分为帕金森病 (MSA-P) 和小脑表型 (MSA-C) 。两种表型的发病年龄、心血管自主神经功能障碍、睡眠障碍和视网膜异常的患病率相似。小脑和帕金森表型之间的特定神经影像标志物不同,以及 MSA-P患者可能更严重的出汗功能障碍程度和 MSA-C 患者可能较早出现的泌尿生殖功能障碍。

A. MSA-C 患者的足部呈蓝色变色。B. “纹状体脚趾”,MSA-C 患者的自发伸趾反应。C. MSA-P 患者的前颈。( Auton Neurosci. 2018 ;211:15-25.)
MSA在临床上可能难以与其他疾病区分开来,尤其是在疾病的早期阶段。仅自主神经表现与纯自主神经衰竭无法区分。仔细的病史和细致的神经系统检查仍然是准确诊断 MSA 的基石。辅助检查有助于支持诊断、排除潜在的模仿和确定治疗策略。大约 20% 临床诊断为 MSA 的患者在尸检时会出现 PD 或 DLB。具有小脑表型的患者可以模仿其他由于酒精、化学治疗剂、铅、锂和甲苯或维生素 E 缺乏引起的成人发作性共济失调,以及副肿瘤性、自身免疫性或遗传性共济失调(例如脊髓小脑性共济失调、脆性 X –相关的震颤共济失调综合征,或迟发性弗里德赖希共济失调)。误诊可能导致不适当的治疗、患者和家庭的痛苦以及临床试验的错误资格。

MSA和PD在致病、神经病理学和临床水平上的重叠和区别(J Alzheimers Dis. 2018;62(3):1141-1179. )
在临床上,区分帕金森病和多系统萎缩具有挑战性,尤其是在疾病的早期阶段。2020年一项研究α-突触核蛋白-PMCA 测定可以区分来自诊断为帕金森病患者的脑脊液样本和来自多系统萎缩患者的样本,总体灵敏度为 95.4%。这或许有助于提高我们对 α-突触核蛋白错误折叠的机制以及与不同突触核蛋白病有关的聚集体结构的理解,并且还可能有助于开发一种生化检测方法来区分帕金森病和多系统萎缩。
喉喘鸣是 MSA 诊断的附加特征,显示出较高的诊断阳性预测价值,其早期发生可能加速缩短生存期。喘鸣被定义为一种紧张、高音、刺耳的呼吸音,主要是吸气,仅在睡眠期间或睡眠和清醒期间出现,由喉部功能障碍导致声门部变窄引起。根据共识,如果医生在检查时在场、在证人的帮助下或通过听录音,临床上可以识别喘鸣。
目前MSA的诊断仍以病理诊断为"金标准",临床尚缺乏客观的生物学标志。2017年提出并建立我国的MSA诊断标准专家共识,以期提高MSA的临床诊断正确率,减少漏诊与误诊。根据当前共识诊断标准的 MSA 诊断方案:

对疑似 MSA 患者的鉴别诊断有用的诊断调查。目前使用的技术包括结构和功能脑成像、心脏交感神经成像、心血管自主神经测试、嗅觉测试、睡眠研究、泌尿系统评估以及吞咽困难和认知评估。尽管近年来 MSA 的诊断工具取得了进展,并且临床诊断共识标准的可用性,但 MSA 的诊断准确性仍然不理想。随着其他诊断工具的出现,包括皮肤活检、视网膜生物标志物、血液和脑脊液生物标志物以及先进的基因检测,即使在前驱阶段,也应该可以更准确、更早地识别 MSA。这具有重要意义,因为误诊可能导致不适当的治疗、患者和家庭的痛苦,以及疾病改善药物临床试验的错误资格。
过去的二十年研究工作为积极寻找 MSA 疾病缓解疗法奠定了基础。尽管目前尚无治愈 MSA 的方法,治疗的重点是改善患者经历的最有问题的症状。自主神经症状可能包括严重的直立性低血压伴晕厥、最终导致失禁的泌尿系统症状、便秘、无汗和勃起功能障碍。运动症状包括帕金森综合征、小脑共济失调和跌倒。尽管某些运动症状可能对药物有部分反应,但其中一些药物可能会加剧自主神经问题。
MSA 被认为是一种多因素疾病,具有多种致病事件共同作用,包括神经炎症、氧化应激和神经营养支持中断等。针对GCI 中 α-突触核蛋白的细胞起源和“朊病毒假说”,正在进行的临床前及临床试验,包括靶向 α-Syn 病理学、调节神经炎症免疫疗法和增强神经保护以及中西医结合方法等。
尽管 MSA 模型中有几种药理学方法,解决了这些致病机制,但目前还没有有效的神经保护或疾病缓解治疗策略。迫切需要多学科研究来阐明有害过程的有害循环的遗传和分子背景,开发可靠的生物标志物和靶标以有效治疗这种迄今为止无法治愈的疾病。新的 MSA 临床前模型可能是朝着完善药物筛选和改进临床前和临床研究之间的转化迈出的重要一步。由于 MSA 是一种多因素疾病,联合多靶点个体化疗法的使用可能构成未来疾病改变临床试验设计的重要优势。
MSA 患者的平均发病年龄为55~60岁,运动症状发作后的平均生存期为 8~9 年,一些经病理学证实的病例可存活超过 15 年。
来源:神经科学论坛
发病前口服抗栓药物对急性缺血性卒中患者静脉溶栓安全性的影响研究
程忻教授:穿支病变进展性脑梗死泵入替罗非班有时间窗吗?病后3天病情加重还能用吗?
查看更多