查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在本期“2018医学十大学科(疾病)即将回答的临床问题》”,我们关注的临床问题是慢性丙型病毒性肝炎。
本期点评专家

北京大学肝病研究所所长助理饶慧瑛副教授
2018年肝脏病学领域治疗研发热点概览
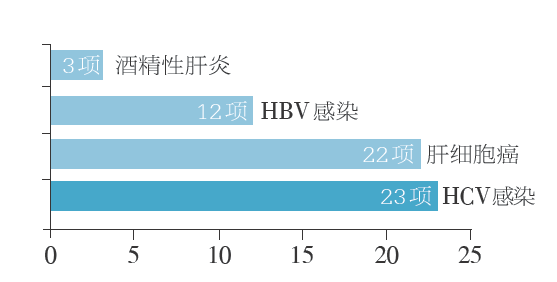
图 肝脏病学领域2018年即将完成的Ⅲ期临床研究主要分布
经检索科睿唯安Cortellis临床试验数据库,肝脏病领域2018年即将完成的Ⅲ期临床研究集中在丙肝病毒(HCV)感染、肝细胞癌、乙肝病毒(HBV)感染、酒精性肝炎等疾病(图)。
我们综合考虑各疾病患病率和研发投入力量,选择研究数量排在第一位的疾病——慢性丙肝,对其中研究规模(纳入研究人数、研究中心数量)位居前两位的研究进行分析,并特邀中华医学会肝病学分会青年委员会副主任委员、北京大学肝病研究所所长助理饶慧瑛副教授进行点评。
丙型肝炎的治疗现状
HCV在全球广泛流行,全球平均流行率大约为3%。根据世界卫生组织最新的估计,全球有1.85亿人感染了HCV,每年大约有35万人死于丙型肝炎及其并发症。2011年以来,直接抗病毒药物(DAA)发展迅猛,已有多种DAA通过美国食品与药物管理局(FDA)批准上市,并被FDA指定为突破性疗法。该药物具有免于注射可以口服、持续病毒学应答(SVR)率高、疗程较短等优势,给丙型肝炎(丙肝)患者,特别是不能耐受干扰素(IFN)治疗的患者带来了希望。但目前DAA的成本居高不下,患者经济能力有限,限制了DAA的推广使用。
问题 DAA治疗可以取代现有PR方案吗?
研究1
在2018年即将完成的肝脏病学相关Ⅲ期临床研究中,由马来西亚卫生部主导的一项关于慢性丙型肝炎的临床试验规模最大,共计招募患者750人,由10家中心参与。该研究目的是评估索磷布韦(SOF)联合ravidasvir(RDV)治疗泰国和马来西亚的HCV[+/- 人类免疫缺陷病毒(HIV)]慢性感染无肝硬化或代偿性肝硬化(CTP A级)患者的疗效、安全性、耐受性和药代动力学。
研究2
在2018年即将完成的肝脏病学相关Ⅲ期临床研究中,在中国进行的一项评价“ravidasvir联合丹诺瑞韦治疗非肝硬化的基因1型慢性丙型肝炎患者的有效性和安全性”研究规模位列第二,共计招募患者425人。
《论坛报》:目前慢性丙肝一线治疗策略是什么?DAA药物在国内医院可及性如何?
饶慧瑛副教授:聚乙二醇干扰素联合利巴韦林(PR方案)曾是我国丙型肝炎抗病毒治疗的标准方案,也是国家医疗保险可以报销的方案。目前,针对HCV生活周期中病毒蛋白靶向特异性治疗的小分子化合物已经取代PR成为标准治疗方案。这些小分子DAA,包括非结构蛋白(NS)3/4A蛋白酶抑制剂、NS5A抑制剂和NS5B聚合酶抑制剂等。以DAA为基础的方案包括DAA联合PR、DAA联合利巴韦林以及不同DAA联合或复合制剂。
但是,考虑到PR的不良反应、使用方便等问题,只有不含PR的完全DAA联合或复合制剂,才能真正成为丙型肝炎抗病毒治疗的一线选择。在2018年即将完成的丙肝相关Ⅲ期临床试验中,规模最大的两项均为完全DAA制剂治疗。
截至2017年底,我国已批准上市的DAA治疗药物和方案有:①施贵宝公司的达拉他韦和阿舒瑞韦;②吉利德公司的索磷布韦片联合PR,或者索磷布韦片联合利巴韦林;③艾伯维公司的奥比帕利片、达塞布韦片(3D方案);④施贵宝公司的达拉他韦联合吉利德公司的索磷布韦片;⑤西安杨森公司的西美瑞韦联合PR。以上DAA尚未纳入国家基本医疗保险目录中,在很多医院也还未进入药房,但在药店中凭医生处方可以购买到,1个疗程的DAA治疗费用在60000元人民币左右。
以上已获批的DAA药物和方案中,不含PR的有以下3种。
1.达拉他韦联合阿舒瑞韦,治疗基因1b型使用24周。我国Ⅲ期临床试验数据显示持续病毒学应答(SVR)为91%~92%,但基线存在NS5A耐药相关置换(RAS)患者的SVR率仅有50%左右,基线不存在NS5A RAS患者SVR率为96%~99%。该方案安全性和耐受性较好。但只能治疗基因1b型,疗程需要24周,不能用于失代偿期患者,并且治疗前建议检测NS5A RAS,如果存在预存NS5A RAS(我国丙肝患者中流行率约为12%~18%),不推荐使用该方案。
2.奥比帕利片联合达塞布韦,治疗基因1b型使用12周。我国Ⅲ期临床试验数据显示SVR率为99.5%~100%。该方案安全性和耐受性较好,基线RAS的存在不影响疗效。但只能治疗基因1b型,不能用于失代偿期患者,使用时需要更加关注药物相互作用。
3.达拉他韦联合索磷布韦片,治疗各种基因型,疗程12周或者24周。该组合在我国未开展过临床试验,没有关于SVR率的数据。该方案可以用于失代偿期患者,但是因为要使用来自两个厂家的药物,因此12周疗程的药费更高,约85000元人民币。
除上述已获批药物外,我国歌礼公司的丹诺瑞韦预计不日也将获得批准上市(注:研究2)。还有多种DAA在我国开展临床试验,如默沙东公司的依巴司韦/格佐普韦片、吉利德公司的索磷布韦/来迪派韦和索磷布韦/维帕他韦、艾伯维公司的glecaprevir/pibrentasvir、歌礼公司的ASC16、凯因科技公司的索磷布韦等,其中部分药物的临床试验已经完成,提交了上市申请。
《论坛报》:我国现有DAA治疗方案,其作用机理和靶点种类不同,临床上应如何精准用药?
饶慧瑛副教授:我国现有的DAA治疗方案在进行选择时,还需要对患者进行检测,根据检测结果精准用药。
例如,根据基因型选择治疗方案和疗程;如果存在基线NS5A RAS,不推荐使用达拉他韦联合阿舒瑞韦;如果存在失代偿期肝硬化,不能选择含NS3/4A蛋白酶抑制剂的方案;如果存在慢性肾脏病,需要根据肌酐清除率选择方案及调整药物剂量;如果既往曾经DAA治疗失败,需要考虑等待使用更佳的DAA方案;HCV/HIV合并感染者尤其要关注DAA与抗HIV药物的相互作用等。
《论坛报》:已有DAA药物在安全性和有效性方面还有哪些不足?新药的研究重点何在?
饶慧瑛副教授:我国目前已经上市的DAA方案存在一些未解决的临床问题,期待将来我国上市的DAA能解决以下所有的临床问题:疗效优异几乎100%的SVR率;对所有基因型有效,基因3型肝硬化患者疗效也很好;特殊人群均可使用(HBV合并感染、HIV合并感染、吸毒、肝硬化失代偿、慢性肾脏病甚至透析、肾移植、肝移植、DAA经治、儿童等);服药方便1天1次1片,疗程短(8周或更短);药费便宜,药物相互作用少,安全性好;基线各位点的RAS不影响疗效。
如有一种或者两种治疗方案能够满足以上所有的临床需求,那我们可能就不需要治疗前的HCV基因型检测,也不需要治疗中的HCV RNA监测,仅需要治疗前的HCV RNA检测来明确诊断,以及治疗后的HCV RNA检测来评估丙型肝炎是否治愈。目前欧美等国家已经上市的药物中,艾伯维公司的glecaprevir/pibrentasvir、吉利德公司的velpatasvir/索磷布韦和velpatasvir/索磷布韦/voxilaprevir几乎可以解决以上的临床问题。
我们如果有了优效安全、服用简便、价格合理、容易获取的抗病毒治疗方案,我国丙型肝炎的治疗问题就能真正获得解决,这将是我国实现世界卫生组织(WHO)2030年病毒性肝炎目标的重大基石。
如果治疗问题得到解决,下一步就是尽早筛查诊断出更多需要治疗的丙肝患者,治愈他们,减少传播,消灭丙肝!(杨力实整理)
本文来自中国医学论坛报“2018医学十大学科(疾病)即将回答的临床问题”专题策划,文中临床试验数据来自全球专业信息提供与分析服务领域的领导者——科睿唯安(Clarivate Analytics)。
《中国医学论坛报》2018年1月18日A5版
未经授权,请勿转载。
查看更多