查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





推送环扫EUS至食道下端,压大钮找寻胸主动脉并将其旋转至5点位(类似CT图像),随后环扫EUS跟随主动脉进入胃腔,进镜过程中依次可见腹腔干(celiac trunk CT)和肠系膜上动脉(Superior Mesenteric Artery SMA),腹腔干自主动脉发出后分为胃左动脉、脾动脉和肝总动脉,脾动脉前方即为胰体。探头压住胰体右旋并稍退镜,屏幕上见探头似乎从胰体滚向胰尾,最终在胰尾外侧探及脾脏和脾门。
线阵型EUS进入胃腔后贴近前壁搏动处,此时显示为肝左叶,右旋转镜身约180°找到腹主动脉,循腹主动脉缓慢进镜,依次显示腹腔干(celiac trunk CT)及肠系膜上动脉(Superior Mesenteric Artery SMA)。自肠系膜上动脉稍进镜并右旋镜身,可显示胰体、尾部结构以及标准的脾动、静脉横切面。因为脾动脉走行迂曲(图1),故跟随脾静脉进一步右旋镜身并略退镜探查胰尾、左肾及左肾上腺。进一步退镜并右旋,就可探及脾脏及脾门结构。
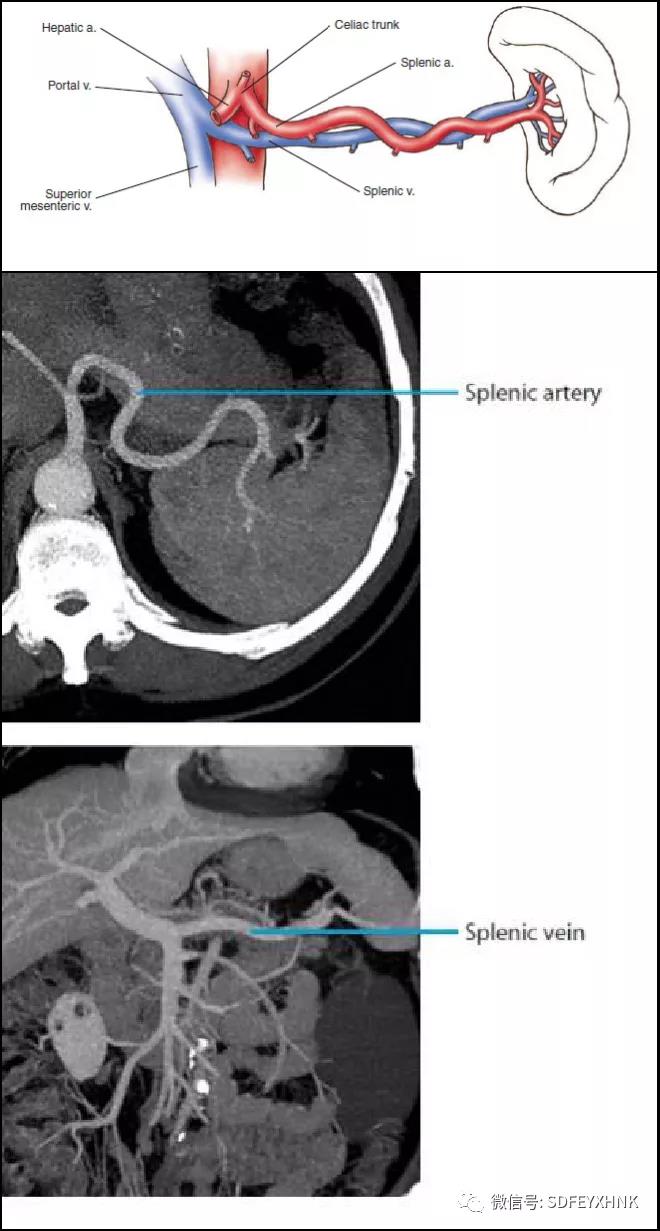
图 1 脾动静脉和脾脏
脾脏原发病变包括弥漫性病变如炎症性、结核、淋巴瘤;局灶性病变如脾囊肿、淋巴瘤、血管瘤,脾梗死,恶性血管内皮肉瘤、转移癌等。脾脏病灶较沉默,缺乏明显症状,早期易漏诊、误诊。
是指脾脏局部钙盐沉积,为继发性改变,常见于脾梗死修复后、慢性炎症等。患者多无临床症状,体检时偶然发现。EUS影像表现为脾脏内点片状高回声,后方声影,当探头移动时点状高回声时隐时现,宛如星空闪烁(图2)。
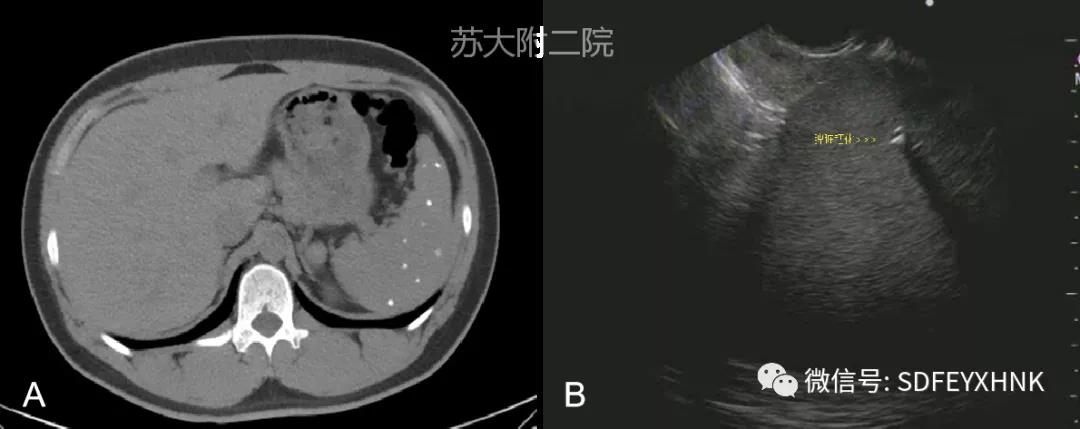
图2 脾多发钙化: A CT ;B 超声内镜
脾脏淋巴管瘤通常是由先天性局部淋巴管发育异常引起的,由于梗阻,囊下小梁和小动脉周围的淋巴管不断扩张,呈现海绵状和囊状病变。脾脏淋巴管瘤在脾脏良性肿瘤中较为常见,占总数的2/3,通常表现为单个或多个结节,有时弥漫在整个脾脏。下面患者为中年女性,CT考虑脾脏淋巴管瘤,胃镜发现胃底后壁多发隆起,EUS见脾内多个低回声囊性病灶,对胃后壁形成外压。(图3)
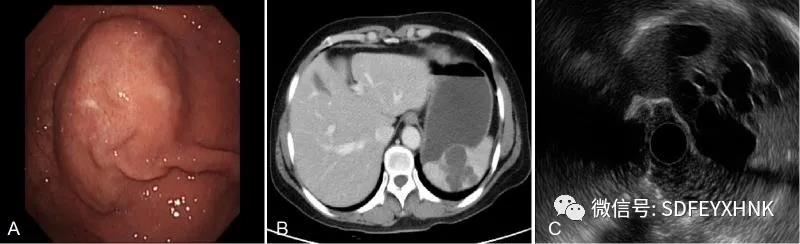
图3 脾脏淋巴管瘤: A 胃镜 ; B CT ;C 超声内镜
脾脏囊肿是脾组织内单发或多发囊性改变,多无临床症状。女性患者,胃镜检查无意中发现胃底黏膜下隆起,超声内镜提示局部胃壁五层结构清晰完整,病灶位于脾脏实质内,边界清晰,内部呈均匀无回声改变,考虑囊肿,后增强CT亦证实(图4)。
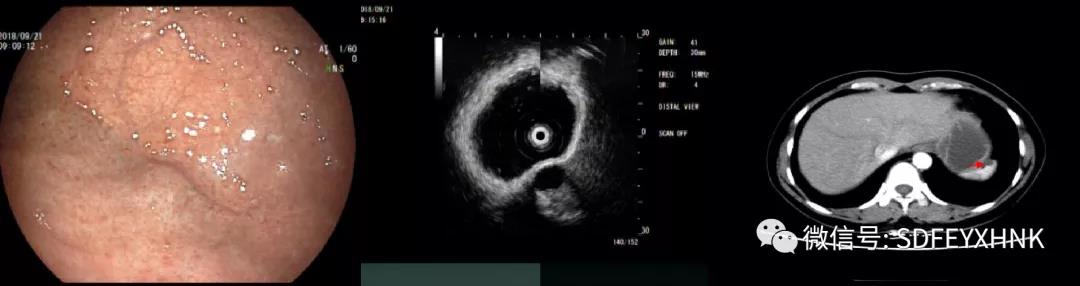
图4 脾囊肿外压 A:胃镜 ;B:超声内镜 C: 增强CT
淋巴瘤是脾脏较常见的恶性肿瘤,它可以是全身淋巴瘤的脾脏受累,也可以是原发脾脏淋巴瘤,以前者较为多见。下面患者,49岁男性,因“腹痛9天”入院,外院腹部平扫+增强磁共振提示脾肿大、脾内多发占位、腹腔及后腹膜淋巴结肿大。EUS于胃腔探查,见腹腔干旁、脾门多发肿大淋巴结,脾脏见巨大低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏占位分别进行穿刺。(图5)
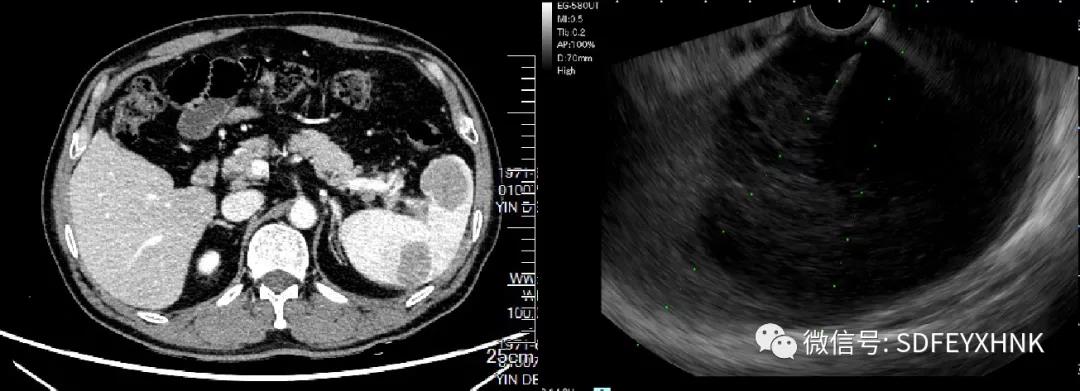
图5:脾淋巴瘤
脾占位EUS-FNA细胞块免疫组化:LCA(+),CD20(+),CD79α(+),CD3(-),CD30(-),Ki-67(+,60%),CK-pan(-),CD5(少数散+),Bcl-2(+),Bcl-6(+),MUM1(+),CD10(少量弱+),CyclinD1(-),EBER-ISH(+),C-myc(+,约40%)(图6),高侵袭性B细胞淋巴瘤,确诊后患者至血液科接受R-CHOP方案化疗,至今情况稳定。
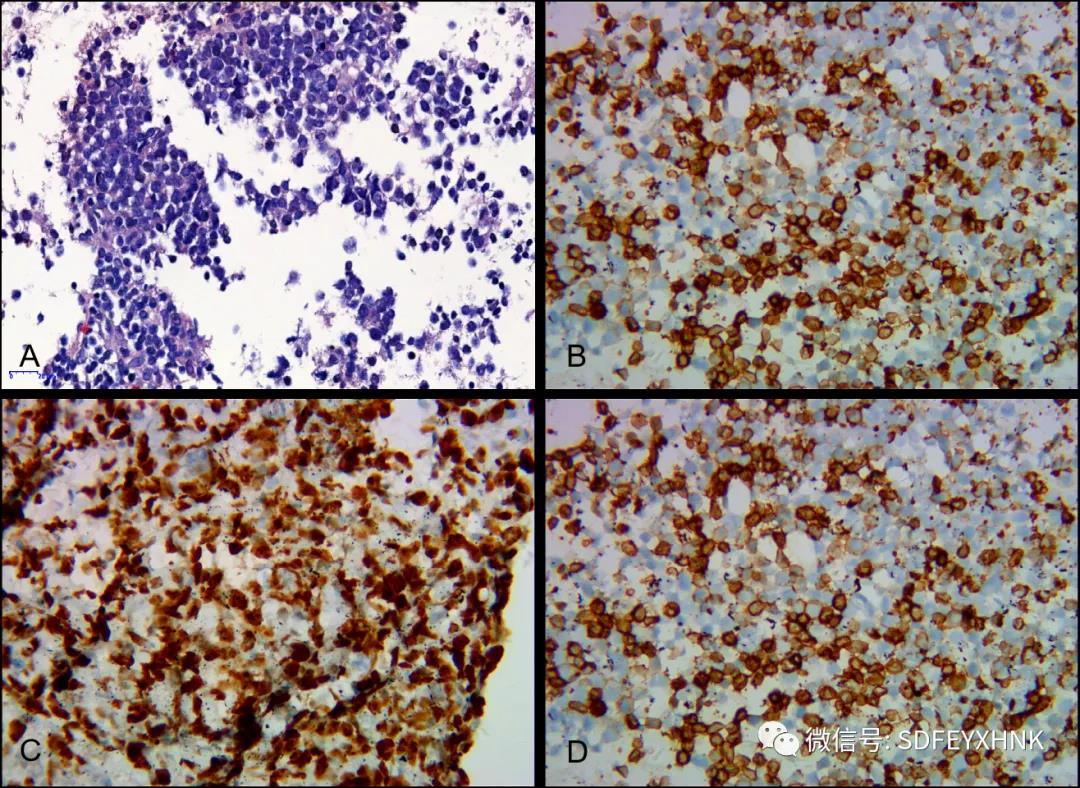
图6 脾占位EUS-FNA细胞块免疫标记
A:HE染色( 100倍)B:CD20(100倍)C:Ki67(100 倍) D: CD79a(100倍)
73岁男性,因“体检发现后脾脏占位一周”入院,腹部增强CT提示脾脏巨大占位,后腹膜及腹腔淋巴结增大,腹膜增厚,淋巴瘤可能,恶性肿瘤伴转移待排,腹腔积液等。EUS于胃腔探查,见肝门多发肿大淋巴结,脾内巨大低回声病灶,遂行脾脏EUS-FNA,(图7)病理组化结果诊断为弥漫大B细胞淋巴瘤。
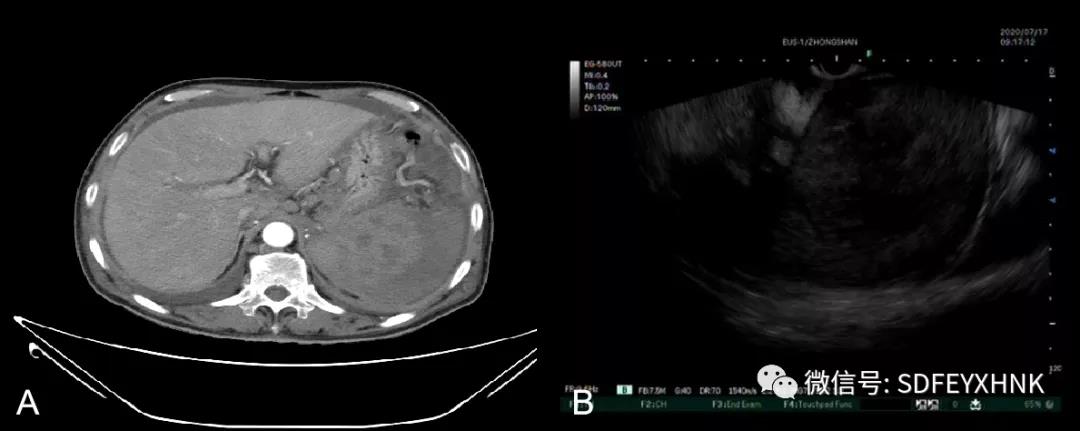
图7:脾淋巴瘤 A: CT B:EUS
脾脏在恶性淋巴瘤的分期诊断中非常重要,它有无浸润影响最终分期和治疗方案。脾淋巴瘤有四种类型:①脾肿大,无局灶性病变,②弥漫性浸润见大量的粟粒状小病变,③多发性离散型局灶性结节,④单个孤立性肿块。上述两个病例分别为第三型和第四型。
脾脏的转移癌少见,其可能的原因:① 脾脏淋巴系统发育不成熟,尤其是缺乏传入淋巴管,通过淋巴途径转移肿瘤细胞的可能性较小;② 脾动脉走行迂曲,有时形成大的锐角,从而使大块的肿瘤细胞难以通过; ③ 脾脏的微环境阻碍了微转移灶的生长。脾转移癌多继发于肺癌、乳腺癌、胃癌、胰腺癌和肝癌。转移癌的超声下特点主要是:脾脏明显增大,实质内可见多发低回声团,边缘尚清,轮廓不规则。
65岁老年男性,因左上腹疼痛不适2月于外院行B超检查提示胆囊炎并胆囊内结石,脾中部实质性占位,性质待查。入院后查CEA437.9 ng/ML,CA199>1000 U/ML。增强CT结果:1.脾脏占位,考虑恶性病变,血管内皮肉瘤可能,邻近胰腺体尾部受; 2.脾包膜下异常信号灶,考虑肿瘤破裂后种植性转移; 3.大网膜和腹膜多发转移瘤; 5.区域性门脉高压:腹盆腔积液,腹腔内多发侧支循环形成。EUS于胃腔探查,见脾脏巨大低回声病灶,遂行EUS-FNA对腹腔积液、肿大淋巴结和脾脏占位进行穿刺。)病理组化结果诊断为胰腺癌。(图8 )
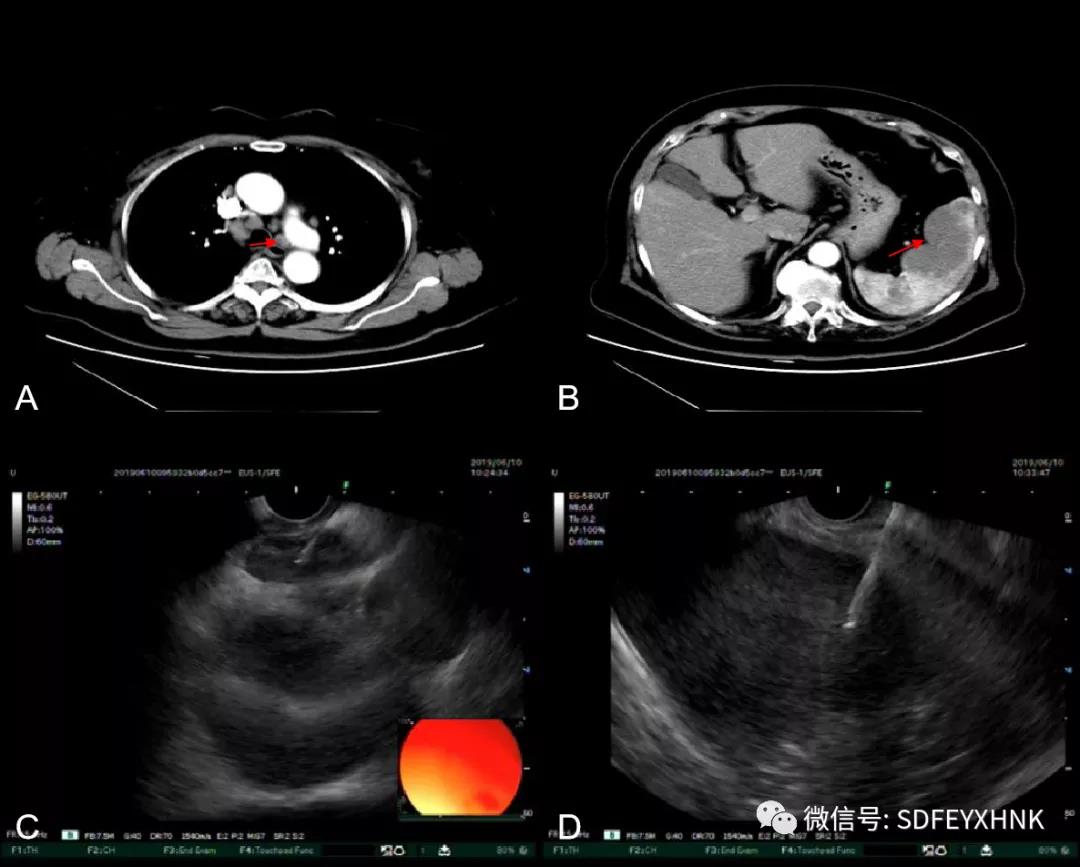
图8 脾转移癌 A CT见脾脏内乏血供病灶 B MRI的T1相低信号 C MRI的T2高信号 D EUS低回声病灶
81岁老年女性,因腹胀半月余入住我院,完善CT示:脾脏占位,两侧肺门区、纵隔及后腹膜区多发增大淋巴结,CT上脾脏占位呈不规则低密度影,增强后呈轻-中度渐进性强化。EUS见肝门及纵隔多发肿大淋巴结,脾脏低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏进行穿刺。病理结果提示淋巴细胞多克隆性增生疾病,考虑炎症性疾病。(图9 )
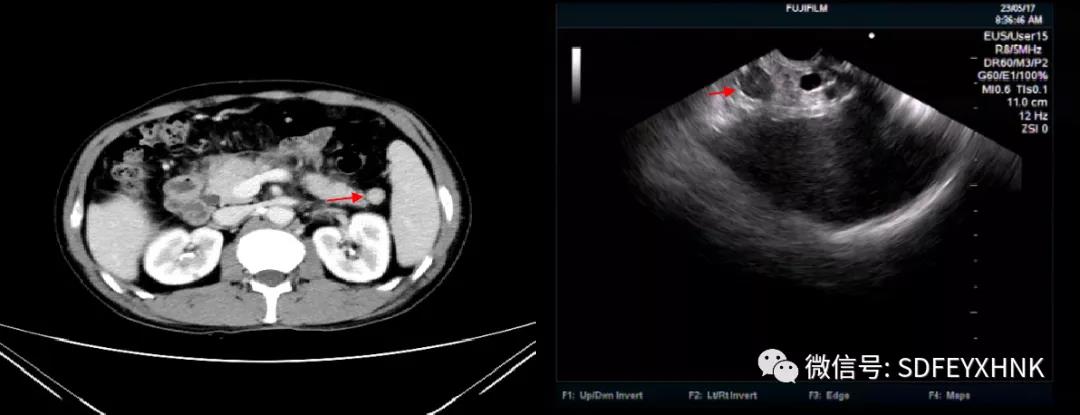
图9 脾淋巴细胞多克隆增生 A: CT纵隔肿大淋巴结 B:CT脾脏乏血供病灶 C: 纵隔淋巴结EUS-FNA D: 脾脏病灶EUS-FNA
随着影像方法的进步,越来越多的脾脏局灶性和弥漫性病变被发现,而影像工具只能提供初步诊断,部分病例为进一步治疗,需要最终病理。尤其是当脾是唯一存在异常病变或是最容易被活检时,获取脾脏的病理尤为重要。既往方法主要包括脾切除术和行经皮超声引导活检。随着近年EUS技术的发展,EUS-FNA被证实也是可行的 , 但是临床工作中,由于脾脏穿刺存在一定的风险,以及对EUS操作者的经验技术有一定的要求,目前应用并不广泛。
临床实践中,患者如有腹部手术史、腹腔积液,或者过度肥胖时,经皮影像学引导下脾穿刺存在一定限制,相关风险也明显提高;此外,当病灶较小,或病变位于脾门时,经皮穿刺更为困难;EUS引导下的脾脏活检作为一种较新的获取病理方式,借助于胃壁与脾脏毗邻的位置优势,同时借助彩色多普勒实时监测功能,很大程度上减少了出血等并发症。实际操作时,在对脾脏病灶实施EUS-FNA时,也可同时对纵隔、腹膜后和胃肠周围淋巴结进行采样,从而提高整体的准确率。
脾脏穿刺的主要并发症为:腹腔积血、气胸、低血压以及与穿刺相关的失血性休克。相对比较轻微的并发症有:无贫血的包膜下血肿、腹痛和血管迷走神经症状。
但脾脏质地脆,穿刺它确实让人担心。就笔者有限经验,建议穿刺时注意:① 尽量选取细针,比如22G和25G的针。② 肿瘤相对于脾脏是乏血供,故尽量少经过正常脾组织。③ 大钮下压时线阵超声探头的压迫力类似于手指的机械压迫,故建议穿刺后,探头深压数分钟。总之、脾脏EUS-FNA是一种相对安全,值得信赖的临床技术,希望本期文章对大家有所帮助。
作者:苏州大学附属第二医院 徐丽明 吴伟 程桂莲 徐龙江 胡端敏
来源:苏州大学附属第二医院消化内科
查看更多