查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





中国肺腺癌人群中,表皮生长因子受体(EGFR)突变的患者占比高达48.4%[1]。EGFR抑制剂的应用开启了肺癌靶向治疗时代,随着表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)药物的更新换代,患者的生存期越来越长。FLAURA研究结果表明,奥希替尼一线治疗EGFR突变晚期非小细胞肺癌(NSCLC)患者的中位总生存时间(OS)达到38.6个月[2]。EGFR突变的患者,在活得更久的同时,我们也会考虑到如何让他们活得更好。
骨相关事件(SREs)是指在恶性肿瘤骨转移或骨病患者中,由于疾病进展带来的一系列骨并发症总和。包括病理性骨折、骨放疗、骨手术及脊髓压迫。尽管接受EGFR-TKI治疗的NSCLC患者生存得到了很好的改善,但骨转移患者骨相关事件仍然高发,SRE的发生严重降低患者生活质量,影响原发疾病的治疗,对患者生存造成严重的不利影响。

周彩存 教授
主任医师,教授,博士生导师,享受国务院特殊津贴
同济大学附属上海市肺科医院,同济大学医学院肿瘤研究所
国际肺癌协会研究会(IASLC)董事会核心成员
CSCO非小细胞肺癌专委会主委
中国医促会胸部肿瘤分会主委
上海市抗癌协会肺癌分子靶向和免疫治疗专委会主委
中国东西部肺癌研究协作组(E-WEST)组长
CSCO肿瘤转化医学专委会候任主委
中国抗癌协会肿瘤药物临床研究专委会候任主委
国际肺癌研究协会(IASLC)教育委员会委员
国际肺癌研究协会(IASLC)控烟委员会委员
一、EGFR突变肺癌骨转移患者需要重视SRE管理
1.1 EGFR突变患者骨转移发生率较高
NSCLC通常存在分子突变驱动,常见突变有EGFR+, KRAS+, ALK+[3-4]。一项回顾性分析纳入荷兰癌症注册中心收集的2013例IV期非鳞NSCLC患者,根据分子亚型将患者分为4组:EGFR+组、ALK+组、KRAS+组及三阴性组,评估患者的分子亚型和转移器官的相关性。
结果表明,非鳞NSCLC患者最常见(发生率≥20%)的转移器官分别是骨(N=1320;33.8%)、胸膜(N=469;23.5%)、肺(N=460;23.1%)和脑(N=438;22.0%)。
其中,EGFR+患者的骨转移发生率最高,为53.8%,显著高于无敏感突变人群的31.5%,尤其是L858R 突变人群骨转移发生率高达60%以上(图1)[5]。
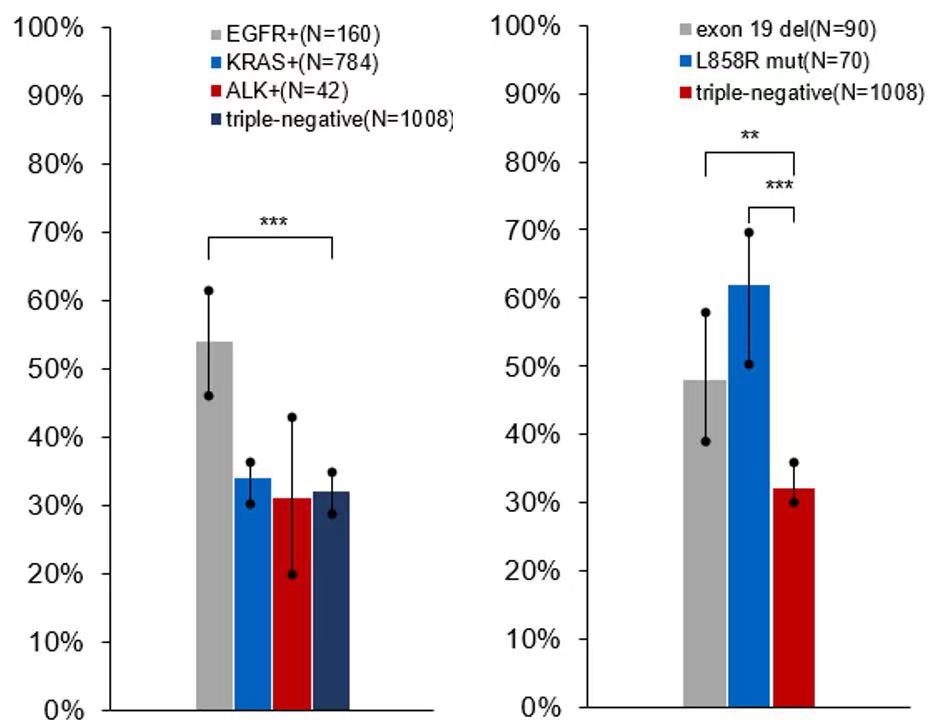
图1 不同基因突变的非鳞NSCLC患者骨转移发生率比较(左图:不同分子亚型的非鳞NSCLC患者骨转移发生率;右图:不同EGFR亚型非鳞NSCLC患者骨转移发生率)
1.2 骨转移影响EGFR-TKIs治疗患者的生存,且发生SRE后生存更差
靶向治疗已成为EGFR突变NSCLC患者的标准一线治疗。为探究骨转移是否会影响EGFR+非小细胞肺癌患者的生存和预后,一项纳入604例一线使用EGFR-TKI治疗的晚期EGFR突变NSCLC患者的回顾性研究结果表明,接受EGFR-TKI治疗的患者中,骨转移组患者的无进展生存时间(PFS)显著低于无骨转移组(11.7个月 vs. 14.0个月,HR = 0.73, P= 0.00013) ;骨转移组患者OS也显著降低(32.8个月vs.46.1个月, HR=0.54,P<0.0001) 。同时,发生SRE的患者相较于未发生SRE的患者OS更差(33.5个月vs.26.1个月,HR=1.84,P=0.005)[6]。
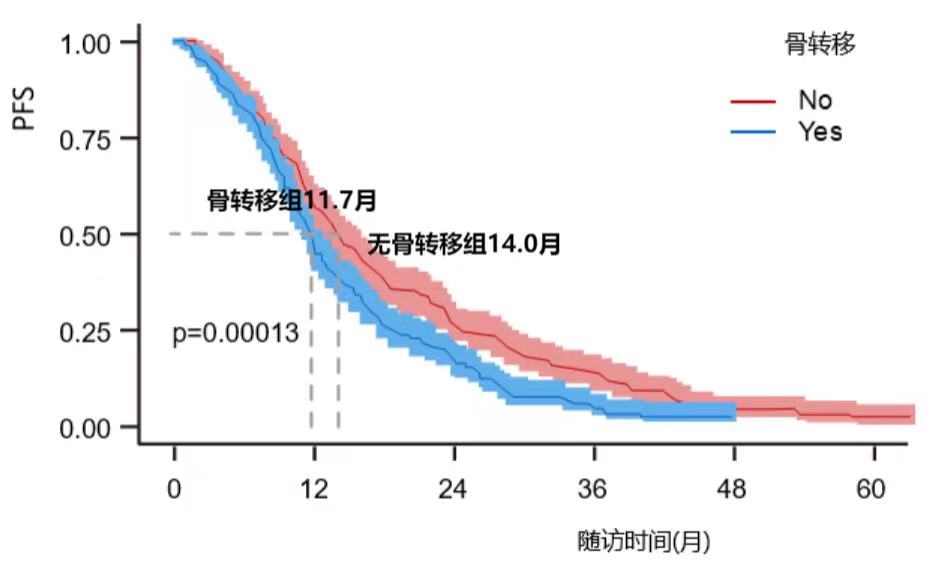
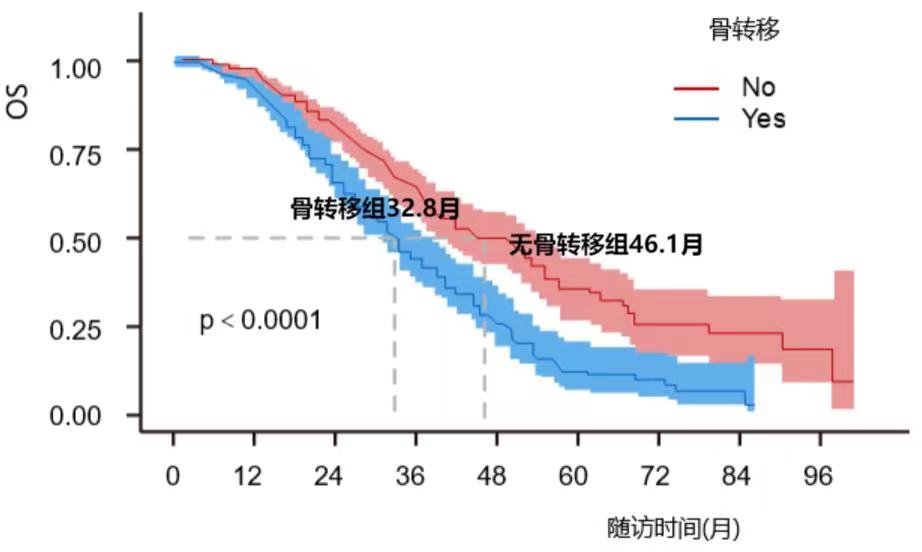
图2 骨转移组和无骨转移组患者生存
二、TKI药物联合双膦酸盐可降低EGFR+骨转移患者的SRE风险,提高PFS
由本中心参与的一项回顾性研究,共计纳入205例EGFR+ M1b期骨转移NSCLC患者,以期评估骨保护剂能否增强EGFR-TKI对于伴骨转移EGFR敏感突变患者的疗效,本研究最终对196例患者进行了有效性分析。患者分为EGFR-TKIs单独治疗组(n=91)和EGFR-TKIs联合双膦酸盐治疗组(n=105),两组患者基线水平相当。
结果显示,与单独使用EGFR-TKI药物的患者相比,联合双膦酸盐的患者SRE发生率更低(SRE发生率39.4% vs. 29.7%)(图3),且联合治疗组患者PFS更高(中位PFS为11.6个月vs.9.3个月,HR=0.68,P=0.009)(图4)[7]。
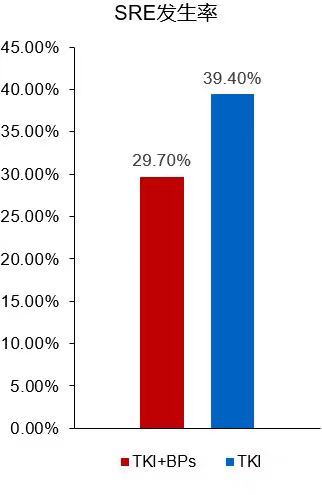
图3 EGFR-TKI单独治疗组和EGFR-TKI+双膦酸盐联合治疗组的SRE发生率
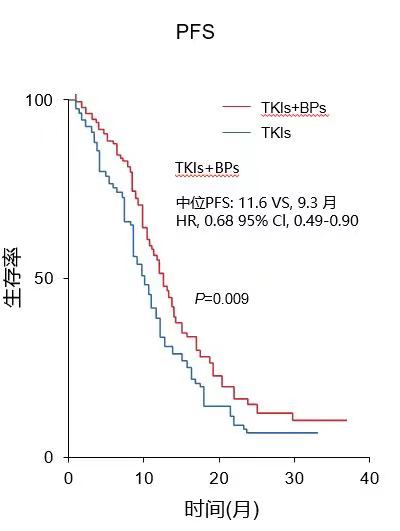
图4 EGFR-TKI单独治疗组和EGFR-TKI+双膦酸盐联合治疗组PFS
三、地舒单抗在预防SRE发生方面优于唑来膦酸,且更能延长肺癌患者OS
244研究是一项国际多中心、随机、双盲双模拟、对照的Ⅲ期研究,共纳入1779例实体瘤(除乳腺癌和前列腺癌以外)及多发性骨髓瘤的成年患者。
实体瘤亚组(n=1597)分析结果表明,地舒单抗较唑来膦酸可显著延迟患者首次SRE发生时间并降低SRE累积发生率(首次SRE时间21.4个月vs.15.4个月;HR=0.81,P=0.017。累积SRE发生次数328次vs.374次;RR=0.85,P=0.048)[8]。
2012年一项发表在J Thorac Oncol的研究[9]对244研究中811例肺癌骨转移患者(地舒单抗组411例,唑来膦酸组400例)进行亚组分析。地舒单抗较唑来膦酸显著延长肺癌骨转移患者的中位OS(8.9个月vs.7.7个月,P=0.01)(图5)。
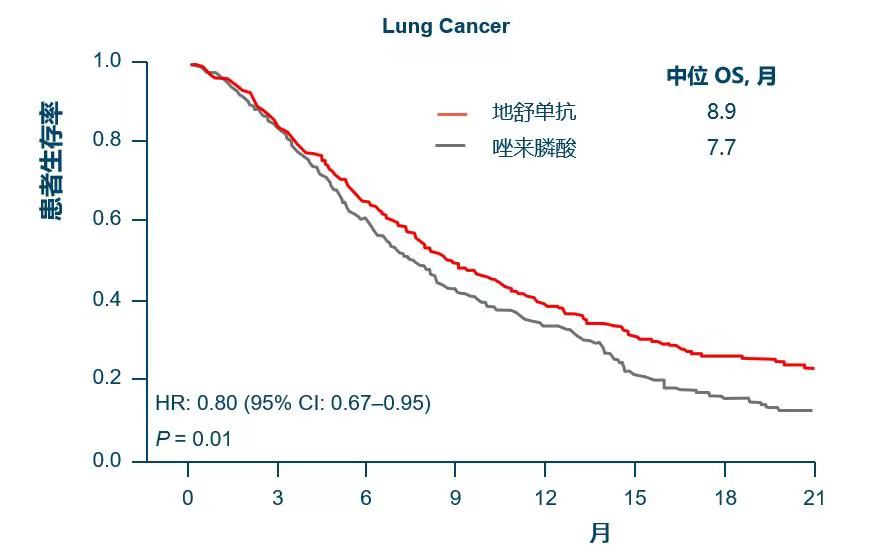
图5 肺癌亚组患者OS
对于NSCLC患者,地舒单抗组(n=350)中位OS较唑来膦酸组(n=352)延长1.5个月(9.5个月vs.8.0个月,P=0.01);
肺腺癌患者中,地舒单抗组(n=189)较唑来膦酸组(n=211)中位OS延长1.4个月(9.6个月vs.8.2个月,P=0.075)。
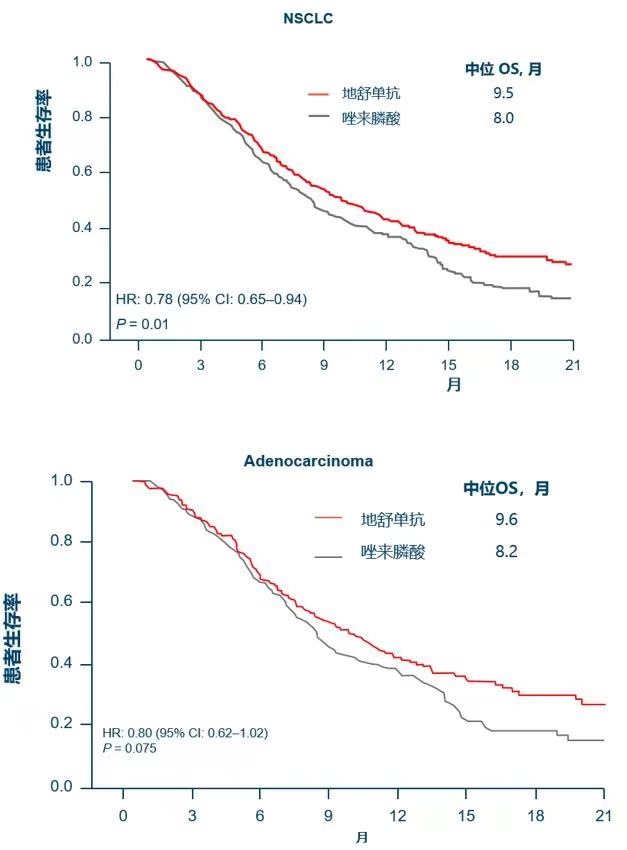
图6 NSCLC患者和肺腺癌患者OS
专家点评
EGFR突变非小细胞肺癌在我国肺腺癌患者中占比近50%。各类EGFR-TKI获批用于临床后,大大改善了EGFR 敏感突变阳性患者的治疗结局。但正因为EGFR-TKI在肿瘤控制中取得了较好的临床疗效,我们更应该重视肿瘤患者骨转移灶的治疗和对SRE的预防,以提高患者的长期生活质量。
接受EGFR-TKI治疗的患者,骨转移仍是不良的预后因素,伴骨转移的患者PFS和OS显著降低。SRE的发生不仅严重影响患者生活质量,也影响患者生存,接受EGFR-TKI治疗的患者,发生骨相关事件后OS仍然很差。
地舒单抗是核因子κB受体活化因子配体(RANKL)的全人源化单克隆抗体,可特异性结合RANKL以抑制破骨细胞的成熟和功能,减少骨转移引起的骨破坏。地舒单抗较唑来膦酸显著延缓首次SRE的发生,并降低SREs的发生频次。此外,244研究肺癌亚组分析显示地舒单抗组较唑来膦酸组可显著延长肺癌骨转移患者中位OS。
多项真实世界研究验证了地舒单抗联合EGFR-TKI的可行性及安全性[10-12],欧洲肿瘤内科学会(ESMO)指南推荐肺癌患者骨转移诊断后即应开始骨改良药物治疗,且整个病程持续应用。2021中国临床肿瘤学会(CSCO)非小细胞肺癌指南对孤立性骨转移的处理,推荐使用地舒单抗(I级推荐,2B)。
参考文献
[1] Gou L Y, Wu Y L. Prevalence of driver mutations in non-small-cell lung cancers in the People's Republic of China[J]. Lung Cancer, 2014, 5(default):1-9.
[2] Ramalingam S S , Vansteenkiste J , Planchard D , et al. Overall Survival with Osimertinib in Untreated, EGFR -Mutated Advanced NSCLC[J]. New England Journal of Medicine, 2019, 382(1).
[3] Dpfb A , Pjm B , Jpmc D , et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT)[J]. 2016.
[4] Implementing multiplexed genotyping of non-small-cell lung cancers into routine clinical practice[J]. Annals of Oncology, 2011, 22(12):2616-2624.
[5] Kuijpers C C H J , Hendriks L E L , Derks J L , et al. Association of molecular status and metastatic organs at diagnosis in patients with stage IV non-squamous non-small cell lung cancer[J]. Lung Cancer, 2018:S0169500218303702.
[6] Chen Y Y, Wang P P, Yang- Fu, et al. Inferior outcome of bone metastasis in patients with non-small cell lung cancer treated with epidermal growth factor receptor inhibitors[J]. Journal of Bone Oncology, 2021.
[7] Zhang G , Cheng R , Zhang Z , et al. Bisphosphonates enhance antitumor effect of EGFR-TKIs in patients with advanced EGFR mutant NSCLC and bone metastases[J]. Rep, 2017, 7:42979.
[8] Thigpen, T J. Randomized, Double-Blind Study of Denosumab Versus Zoledronic Acid in the Treatment of Bone Metastases in Patients With Advanced Cancer (Excluding Breast and Prostate Cancer) or Multiple Myeloma[J]. Yearbook of Medicine, 2011.
[9] Overall survival improvement in patients with lung cancer and bone metastases treated with denosumab versus zoledronic acid: subgroup analysis from a randomized phase 3 study.[J]. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer, 2012, 7(12):1823-1829.
[10]Journal of Clinical Oncology (2015) 33:15 SUPPL. 1. Date of Publication: 20 May 2015
[11] Miwa M , Okuma Y , Kashima J , et al. Survival analysis of advanced NSCLC patients harboring EGFR mutations with zoledronate or denosumab[C]// ERS International Congress 2017 abstracts. 2017.
[12] Saito G , Ebata T , Ishiwata T , et al. Risk factors for skeletal-related events in non-small cell lung cancer patients treated with bone-modifying agents[J]. Supportive Care in Cancer, 2021, 29(7).
查看更多