查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





6月22日,我国国家药品监督管理局首次获批上市了CAR-T细胞疗法产品。自从CAR-T细胞疗法问世以来,各个阶段的研究进展就备受关注,作为当下最热门的抗癌研究领域,“谁”都想从中分一杯羹,但CAR-T是否也能应用于肺癌,掀起肺癌免疫治疗的新浪潮?
CAR-T细胞疗法最早的临床应用是一位患有急性淋巴细胞白血病的6岁小女孩艾米莉,她经过化疗、骨髓移植、复发等多重疾病恶化后无计可施。而这时,她接受了一种新的试验性疗法:先抽取血液里的白细胞,用改良的艾滋病毒进行遗传改造,教会它们识别并杀伤肿瘤细胞,再重新注入小女孩的体内。一周后,神奇的结果出现了,小女孩的骨髓检查正常,癌细胞消失了。如今,她已经无癌生存9年。

这一例奇迹般的治愈事例进一步推动了CAR-T细胞的研究。2017年,美国FDA批准了第一款免疫细胞治疗——靶向CD19的CAR-T(CTL019,Kymriah)正式上市,掀起了医疗创新的新前沿,通过重新编组患者自己的细胞来攻击癌症,成为难治性疾病的新拐点,揭开了免疫细胞治疗的序幕。
所谓CAR-T细胞疗法,也就是嵌合抗原受体T细胞免疫疗法。CAR-T就是把患者的免疫T细胞在体外通过生物技术改造,令其识别肿瘤细胞表面的抗原,然后把这些细胞输回患者体内,达到识别、杀死癌细胞的治疗效果。
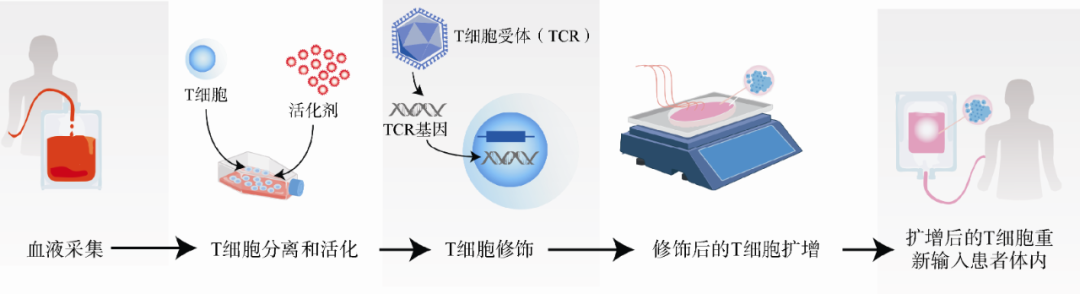
CAR-T细胞治疗流程
CAR-T细胞回输到患者体内后将有效识别肿瘤细胞,被激活并继续增殖,形成持续的杀伤力,而且还将通过释放细胞因子等方式召集数量更多、种类更全的免疫细胞来协同作战。
目前,CAR-T疗法在血液系统恶性肿瘤的研究相对成功,如此次获批的药物在疗效上的研究显示,101例复发/难治性大B细胞淋巴瘤成人患者1年随访结果为,最佳总缓解率为82%,完全缓解率达到了54%;2年随访结果为:中位随访27.1个月,仍有39%的受试者持续缓解,其中37%的受试者持续完全缓解。
而在肺癌领域,CAR-T疗法却很难突破。
如果说PD-1/PD-L1为代表的免疫药物,是癌症治疗领域的“一条腿”,而CAR-T细胞免疫疗法则是癌症治疗的“另一条腿”,想要实现双腿走路,甚至跑起来,这些挑战不可忽视。
与血液系统恶性肿瘤的治疗不同,迄今为止,CAR-T 细胞治疗实体瘤(如肺癌)的成功有限,目前遇到的障碍包括:①靶向/非肿瘤毒性;②神经毒性;③细胞因子释放综合征(CRS);④缺乏肿瘤特异性抗原;⑤免疫抑制性肿瘤微环境(TME);⑥对肿瘤组织的低水平浸润;⑦肿瘤抗原逃逸;⑧脱靶效应
目前,CAR-T细胞治疗实体瘤的有效方法是识别肿瘤特异性细胞表面抗原。然而,实体瘤生物结构的异质性是一个重要的限制因素,肺癌可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)及其他分型,NSCLC中又可分为腺癌、鳞癌等几个亚型。
因此,靶点选择对肺癌治疗疗效和患者安全起到关键性作用。在临床试验中用于 CAR-T 细胞治疗的NSCLC相关抗原最常见的包括 EGFR、间皮素 (MSLN)、粘蛋白 1 (MUC1)、酪氨酸激酶受体 EphA2、人表皮生长因子受体 2 (HER2)、抗癌胚抗原(CEA)、PD-1/PD-L1等。
这些抗原在不同患者中的表达量不同,且并不是所有的细胞都会表达CAR-T疗法靶向的靶标。对于CAR-T疗法来说,很难在肺癌患者中找到一个目标清晰的”地址“。
理想的CAR-T细胞靶点是在肿瘤细胞中高表达,而在正常组织中不表达或低表达的抗原。
脱靶效应指的是CAR-T细胞发挥细胞毒性的过程中识别正常机体的抗原导致机体正常组织器官的损伤。解决脱靶问题,应在寻找更安全的靶点同时,可以通过降低单链抗体的结合力减轻免疫反应,同时应用抑制性CAR,调控CAR-T细胞的活性。
不能特异性的识别肿瘤细胞带来的另一个不良反应就是会导致人体产生一些非肿瘤毒性,这是因为许多抗原不是肿瘤特异性的,当CAR-T细胞与正常(非肿瘤)细胞上的靶向抗原结合时可能引起各种器官系统(包括肺、血液和胃肠系统)疾病,甚至危及生命。
CAR-T细胞输注后最常见最严重的副作用是细胞因子风暴(CRS)。这是由于嵌合抗原受体与相应的肿瘤相关抗原特异性结合,引发大量细胞因子释放,TNF-α、C反应蛋白、IL-2、IL-6、IL-的表达水平显著升高,激活多类免疫反应,主要临床表现是高热、高血压、呼吸困难甚至多器官衰竭,严重时可导致患者猝死。
肺癌作为实体瘤的一种,存在肿瘤免疫抑制微环境(TME ),TME中包含着多种具有免疫抑制能力的细胞,例如调节性T细胞、肿瘤相关巨噬细胞等等,以及过度表达TGFβ、IL-10、IL-4等具有免疫抑制能力的细胞因子。
这一环境会影响CAR-T 细胞的活化,抑制其杀伤肿瘤的功能。因此克服肿瘤微环境的影响,增强CAR-T细胞浸润至肿瘤组织的能力是亟待解决的问题。
前不久,《自然回顾药物发现》 (Nature Reviews Drug Discovery)发表了一篇综述,针对CAR-T疗法治疗实体瘤遇到的挑战和解决策略进行了深度分析。
总结来说,能够选择合适的靶标和嵌合抗原受体、克服肿瘤微环境的免疫是CAR-T在实体肿瘤需要解决的两个方向。

即使遭遇重重困难,但研究人员在实体瘤领域的研究并未停止。
一项I期临床研究显示:纳入免疫组化检测EGFR表达超过50%的中晚期NSCLC患者11例,回输剂量为0.97x107cells·kg-1的Anti-EGFR CAR-T细胞抗肿瘤治疗,结果发现2例患者达到部分缓解,5例患者维持稳定并有2例稳定期长达8个月,11例患者均未发生明显的毒副反应,提示Anti-EGFR CAR-T细胞治疗肺癌的有效性和安全性,对EGFR耐药的肺癌患者可能具有一定的改善作用。
2020年在8月13日《肿瘤基因》(Oncogenesis)杂志发表的一篇研究中,来自广州医科大学第一附属医院和美国贝勒医学院等机构的研究人员构建了靶向PD-L1的CAR-T细胞,证明了PD-L1-CAR-T细胞在体外具有抗实体瘤活性,不仅如此小鼠体内PD-L1高表达的NSCLC异种移植肿瘤也获得延长缓解。这项发现为支持CAR-T细胞靶向PD-L1来治疗NSCLC和其他实体恶性肿瘤提供了临床前证据。
2021年美国临床肿瘤学会(ASCO)年会上,针对肝细胞癌的GPC3(磷脂酰肌醇蛋白聚糖,潜在治疗肝癌的新靶点)靶点的CAR-T细胞疗法最新研究数据公开,对于GPC3阳性复发/难治性肝细胞癌患者,CAR-T细胞疗法(Ori-CAR-001)后线治疗,疾病控制率达到了77.8%,且表现出良好的安全性和疗效,或许将成为晚期肝癌患者的一种新疗法。
在此,期待在CAR-T细胞疗法在肺癌领域乃至更多领有所突破,为更多患者造福!
肺癌康复圈 平台发布
查看更多