查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2022年10月,亚太胃肠病学协会(Asian Pacific Association of Gastroenterology)发布了功能性消化不良重叠其他功能性胃肠病的诊治指南,我们摘录并翻译了其中一些重要内容,在此与大家分享学习。
背景
罗马Ⅳ标准将功能性胃肠病(functional gastrointestinal disorders,FGID)定义为脑-肠互作异常所导致的一组临床综合征。功能性消化不良(functional dyspepsia,FD)是其中最常见的一种亚型,包括上腹痛综合征(epigastric pain syndrome,EPS)和餐后不适综合征(postprandial discomfort syndrome,PDS)。在真实世界中,多种FGID会互相重叠,特别是FD常与胃食管反流病(gastroesophageal reflux disease,GERD)、肠易激综合征(irritable bowel syndrome,IBS),功能性便秘(functional constipation,FC)等重叠。FGID的重叠对患者的疗效有很大影响,而大部分临床医生会着重处理最严重的症状,或独立干预每一种症状,而忽视FGID之间的关联。本指南旨在帮助临床医生从FGID共同的病理生理机制出发,从复杂的症状当中,探寻出共同的治疗靶点。
方法
◆ 目标受众 本指南适用于亚太地区常规临床诊疗环境,旨在管理一级和二级护理级别的患者,三级护理级别和难治性患者不在讨论范围内。
◆ FD重叠症状组
(1) FD-GERD
(2) EPS-IBS
(3) PDS-IBS
(4) FD-FC
◆ 从症状出发,分析高质量的基础研究结果,探寻重叠症状共同的病理生理机制,进一步转化为治疗靶点(图1)。
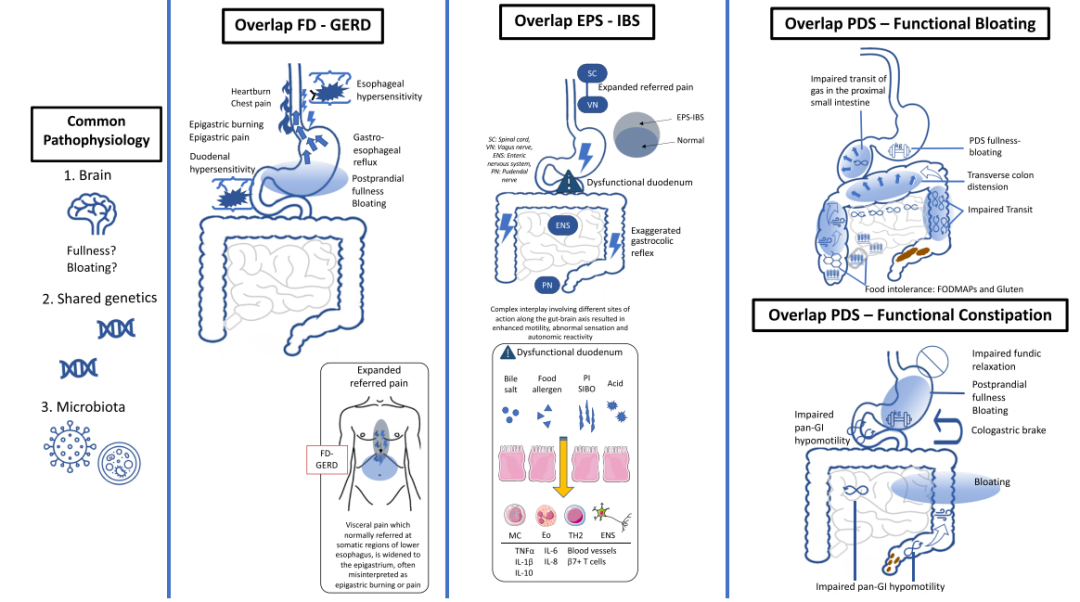
图1 FGIDs重叠可能的病理生理机制
1. FD-GERD:上腹灼热感和/或餐后饱胀,伴有嗳气和/或反酸。
病理生理
◆ 胃容受性舒张功能受损及一过性下食管括约肌松弛(transient lower esophageal sphincter relaxations,TLESR),两者分别是造成FD患者饱胀感及GERD患者嗳气、反酸的主要机制。有研究显示,GERD患者胃容受性舒张功能异常,且与TLESR的发生相关。
◆ 近年来发现FD患者多有十二指肠嗜酸性粒细胞增多(duodenal eosinophilia,EOS),且EOS是FD及PDS患者发生GERD的独立危险因素。
◆ 十二指肠酸暴露增加和十二指肠高敏感已被证实与FD发病相关。
治疗
◆联合使用H1/H2受体拮抗剂。有研究显示氯雷他定联合雷尼替丁、羟嗪联合雷尼替丁治疗FD有效,EOS是治疗有效的预测因子。
◆ 质子泵抑制剂(PPI)。十二指肠酸暴露是FD和GERD的共同机制,因此,抑制胃酸分泌对两者均有效果。
◆ 神经调节剂:阿米替林50 mg和艾司西酞普兰10 mg均可改善FD患者的餐后饱胀感,两者都不影响胃排空,但胃容受性舒张功能似乎有所改善。阿米替林10 mg和泮托拉唑40 mg联用可改善GERD患者症状。
◆ 胃底松弛剂:巴氯芬是一种GABA受体激动剂,可通过抑制TLESR而减少儿童胃食管反流。5-HT1A受体激动剂丁螺环酮可显著改善FD患者的症状和胃容受性舒张功能。阿考替胺是一种乙酰胆碱酯酶抑制剂,可以改善伴有烧心且PPI治疗无效的FD患者的上腹部症状,且增加胃食管结合部压力,减少原发性食管蠕动异常的发生。
2.EPS-IBS:与饮食相关的上腹疼痛或灼热感,在排便排气后好转,并伴随排便次数改变。
病理生理
◆ EPS患者中有相当一部分可能是由于IBS引起上腹部症状。向IBS患者空肠输注气体,有27%的受试者报告上腹部症状,50%则报告疼痛位于脐周中线。
◆ IBS患者的胃结肠反射增强,并且高脂饮食会使IBS患者的腹部疼痛区域扩大,直到上腹部,并降低腹泻型IBS(IBS-D)患者的腹痛阈值。
◆ 十二指肠显微病变(如免疫激活、微生态失调、肠道通透性和神经内分泌变化)与FD、IBS有关。触发因素包括感染、胃酸和胆汁酸、食物抗原和压力。沙门氏菌感染后FGID患者中,有1/3表现为FD-IBS重叠。IBS和FD患者十二指肠病理结果表明IBS患者的肥大细胞数量较正常人显著增加,FD则表现为嗜酸性粒细胞显著增加。
治疗
◆ 解痉药。曲美布汀是一种肠道阿片受体非选择性激动剂,研究报道它通过调节胃结肠反射改善FD-IBS动物模型的症状。
◆ 三环类抗抑郁药物。阿米替林对不伴有焦虑或抑郁的FD患者有效,且疗效优于艾司西酞普兰。阿米替林对EPS的治疗效果优于泮托拉唑,但对患者心理评分或睡眠质量无影响。这些研究表明阿米替林对胃肠道的作用独立于中枢调节机制。同样,阿米替林对IBS有效,且可以降低内脏敏感性。
◆ 双重抗组胺药。酮替芬具有肥大细胞稳定剂和H1受体拮抗剂双重作用,可以改善IBS患者腹痛、腹胀和胀气。AST-120是一种不可吸收的碳基吸附剂,具有吸附组胺和血清素的能力,可以改善IBS患者腹痛、腹胀和大便性状,还可以提高IBS患者的内脏痛觉阈值。
3. PDS-IBS:饱胀、腹胀、嗳气和胀气。
病理生理
◆ IBS患者餐后小肠气体传输异常,气体滞留于空肠,引发打嗝、恶心、呕吐、腹痛和腹胀的症状,部分IBS患者会将这种腹胀症状描述为饱胀感,从而被医生判断为PDS。
◆ 食物不耐受。低FODMAP饮食已被证实对IBS患者的腹胀有疗效。有研究发现高FODMAP饮食可触发酸反流和恶心。与健康对照相比,FD、IBS和FD-IBS重叠患者采用富含乳果糖饮食引起的腹胀明显更多。
◆ 近年来,有大量研究发现小肠细菌过度生长(SIBO)在FD的发病机制中起重要作用。最近一项系统综述表明,FD患者SIBO发病率与IBS相似。
治疗
◆ 促动力药。可同时作用于上下消化道的胃肠道促动力药物可能对饱胀感和腹胀症状都有效。普芦卡必利是一种5-HT4受体激动剂,被证明可改善胃轻瘫患者的饱胀感、腹胀症状,并促进胃排空。普芦卡必利也能改善FC患者的腹胀症状,并且比改善粪便性状和直肠症状的作用更明显。费西塞拉和维司曲格也有类似的同时促进上下消化道动力的作用。
◆ 低FODMAP饮食。来自澳大利亚的一项研究表明,FODMAP饮食可改善FD患者的上腹不适症状。
◆ 利福昔明。利福昔明已被证明可以改善IBS患者的腹胀。随机对照试验显示,利福昔明可改善FD患者的整体消化不良症状、打嗝和餐后饱胀感,并且对EPS和PDS均有效。其他用于治疗SIBO的抗生素有新霉素、甲硝唑、四环素,和氟哌嗪。
◆ 中草药。有证据支持STW-5、薄荷油香兰油(POCO)和枳术宽中胶囊可改善FD患者的饱胀和腹胀。而STW-5和POCO也被证实对IBS有效。
4. FD-FC:上腹部疼痛或不适,并与排便次数减少或粪便干硬相关。
病理生理
◆ 胃肠运动可能存在相互抑制作用。研究显示健康志愿者在抑制排便3天后,会出现胃排空延迟。而一些慢传输型便秘(slow transit constipation,STC)患者的胃排空延迟在结肠次全切除后恢复正常,同时胃电图参数也会改善。有研究观察到便秘型IBS(IBS-C)患者的胃排空比IBS-D慢。伴有FD症状的IBS患者胃排空延迟,且其中90%为IBS-C,餐后饱胀与胃排空延迟独立相关。
◆ 横结肠扩张可能是上腹饱胀感和腹胀之间重叠的原因。影像学研究表明,在健康对照组和腹胀患者中横结肠的气体体积是其他肠段的2-3倍;在IBS-C患者中,横结肠体积与腹胀严重度呈正相关。
◆ 呼气试验中甲烷浓度增加与便秘和结肠传输延缓有关,抗生素治疗能够改善便秘,加快肠传输。肠道产甲烷增加也会造成小肠传输延缓,胃窦十二指肠动力减退导致肠道血清素减少。
治疗
◆ 排空肠道。伴有严重胃排空障碍的STC患者,在结肠次全切除术后1年,85%的患者胃排空改善。便秘患儿在接受药物和手法辅助排便后,其消化不良症状也能得到改善。
◆ 促动力药。同时作用于上下消化道的普芦卡必利可改善胃轻瘫患者的饱胀、腹胀症状,促进胃排空,也能增加患者排便次数。如果没有这类促全消化道动力的促动力药,可联合使用促胃动力药和泻剂。
◆ 减少甲烷生成。利福昔明可减少甲烷生成并改善便秘。限制高纤维饮食(富含FODMAP)有望减少肠道中甲烷生成。
讨论
根据对亚太地区FGIDs患者症状群的调查,我们确定了FD四种常见的重叠情况:FD-GERD、EPS-IBS、PDS-IBS、FD-FC。我们探索了可能解释这些重叠的病理生理学机制,并根据病理生理学推断,提出了治疗方案(图2)。在现实世界中,临床医生可根据这些症状,将患者分为四组重叠综合征中的一组。然后,随着对我们列举的假定病理生理学机制的理解,临床医生可以为患者提供一个解释模型,并利用这个模型来合理化他们的治疗建议。但我们承认,本指南的证据基础和我们针对具体治疗的建议仍是有限的。
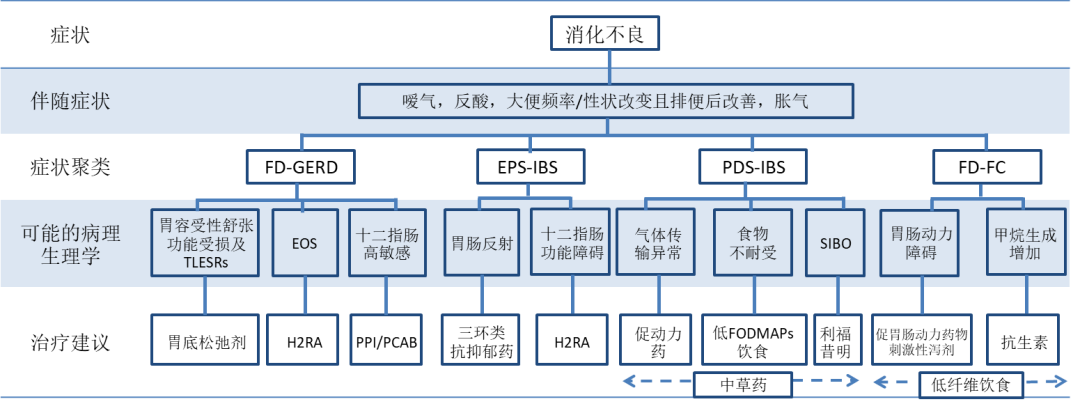
图2 重叠症状管理流程图
编译:俞汀
审核:汤玉蓉
审定:肖英莲
来源:GIMQCC
查看更多