查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:上海交通大学附属第六人民医院 陈明云 李连喜
血管内皮细胞是覆盖血管内腔表面的细胞层,在血管收缩舒张、止血和局部炎症的调节过程中起重要作用。另外,在血管结构、血流动力学中也起着整合作用。当血管内皮由生理状态转向功能失调状态,通常称为内皮功能障碍,内皮功能障碍在糖尿病患者的动脉粥样硬化和心血管并发症的发生、发展中发挥早期和关键作用。血管内皮细胞还可通过自分泌、旁分泌和内分泌而调控其他多种细胞功能。
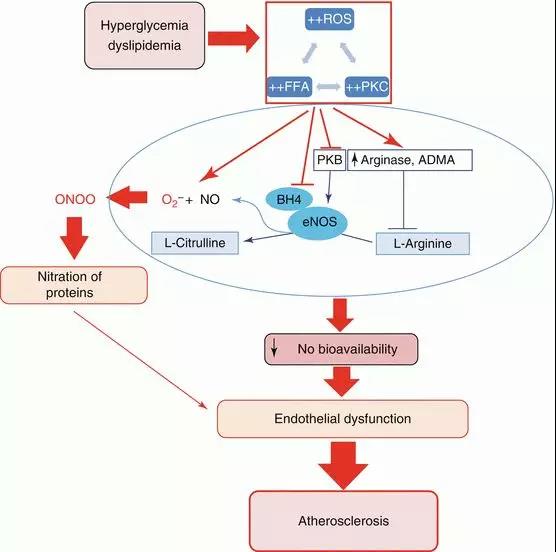
图 血管内皮功能障碍在糖尿病大血管病变中的作用
糖尿病对血管内皮有多种负性影响,包括损伤内皮功能和促进局部血栓形成等,从而加剧动脉粥样硬化的发生及发展。如上所述,糖尿病时能增加白细胞黏附分子的表达,从而调节单核细胞与动脉内皮下区域的结合和浸润。另外,糖尿病能损伤内皮的屏障功能,增加内皮通透性和促进黏附分子沉积于血管间质。糖尿病还能改变内皮细胞内多种血管活性因子的合成,从而影响血管紧张性、血流动力学、凝血和血管平滑肌细胞的生理功能。糖尿病对内皮功能的影响主要包括以下几个方面:
内皮通透性增加是糖尿病血管功能障碍的标志之一。内皮通透性增加可以促进致动脉粥样硬化细胞因子和脂蛋白进入内皮下区域并沉积于血管间质。糖尿病能通过血管平滑肌细胞增加血管内皮生长因子(VEGF)的产生而损伤内皮的屏障功能。在此过程中,高血糖和其他因素如血管紧张素Ⅱ受体拮抗剂等,都可以促进血管平滑肌细胞合成VEGF。继而,VEGF以旁分泌的方式作用于内皮细胞,与激酶插入区受体VEGF-R2(KDR)结合,诱导紧密连接蛋白发生磷酸化。此外,高血糖还能通过激活PKC、增加AGEs及活性氧的形成而直接作用于内皮细胞导致内皮通透性增加。
血管内皮可释放多种诱导血管平滑肌舒张的因子,包括NO、前列环素I2 (PGI-2)以及多种内皮源性超极化因子。NO生物活性降低是糖尿病内皮依赖性血管舒张功能损伤的主要因素之一。NO是由内皮eNOS合成,可增加对血流剪切力和潜在血管舒张因子如乙酰胆碱和缓激肽的反应性。血管内皮细胞释放的NO以旁分泌方式作用于血管平滑肌细胞。NO和可溶性鸟苷环化酶(sGC)结合,使环磷酸鸟苷(cGMP)合成增加,cGMP升高可以激活cGMP依赖的蛋白激酶,而cGMP激酶Ⅰ对调节胞质钙离子的稳态发挥重要作用,可引起血管平滑肌细胞舒张。
研究发现,1型糖尿病动物模型中内皮依赖性血管舒张功能减低可以发生于冠状动脉、肠系膜动脉、颈动脉和主动脉等组织,提示这种血管舒张功能障碍可发生于孤立的血管。此外,内皮依赖性血管舒张功能受损还可发生于以胰岛素抵抗为特点的2型糖尿病患者中。2型糖尿病的内皮功能障碍是高血糖以及与胰岛素抵抗相关的其他代谢异常因素共同作用所致,如游离脂肪酸增加和胰岛素敏感性减低。大量研究提示,糖尿病对NO供体如硝普钠有正常血管舒张反应,其血管舒张功能受损主要由内皮源性NO减少所致。还有少量研究报道糖尿病和胰岛素抵抗对NO供体的血管舒张反应是减弱的,提示在某些情况下,内皮依赖性血管舒张功能受损可能与非内皮依赖的血管舒张功能受损同时存在,二者共同介导了糖尿病大血管损伤。然而,血管对NO供体舒张反应呈抵抗的机制目前尚未明确,潜在的机制可能与内皮素(endothelin,ET)或者血管紧张素Ⅱ引起的慢性血管收缩或氧化产物有关,但有待进一步研究明确。
研究认为,糖尿病个体内皮依赖性的NO介导的血管舒张功能受NO合成减少和稳定性降低所调控。糖尿病个体中过多的ROS通过把NO转变为过氧化亚硝酸盐而缩短了NO的半衰期导致NO减少。同这一理论相一致的是,研究发现高血糖可通过NADPH氧化酶促进ROS的产生。而抗氧化治疗如维生素C则可以改善糖尿病患者内皮依赖性血管舒张功能。此外,通过NADPH氧化酶gp91phox基因靶突变来降低NAPDH氧化酶活性也可以抑制动脉ROS生成,从而改善内皮依赖性血管舒张功能。研究者们还提出了多种机制来解释胰岛素抵抗时eNOS活性降低的原因。例如,已有研究发现,呈现胰岛素抵抗的Zucker肥胖大鼠的脂肪微血管和四氢嘧啶诱导的糖尿病狗的冠状微血管中eNOS表达减少,提示eNOS蛋白水平降低可能导致NO产生减少。另外,血液循环中内源性eNOS抑制剂非对称二甲基精氨酸(ADMA)和eNOS辅助因子四氢生物嘌呤缺乏,都可以引起胰岛素抵抗个体NO生成减少。
糖尿病个体内皮源性NO生物活性降低的影响不仅局限于对血流动力学效应的影响。NO通过cGMP依赖途径可以抑制血管壁内致动脉粥样硬化和血栓形成,包括新生内膜血管平滑肌细胞迁移和增殖、白细胞在内皮处的黏附等。与NO抗动脉粥样硬化作用相一致的是,已有文献报道,eNOS缺乏能增加ApoE-/-基因敲除小鼠动脉粥样硬化病变的面积。NO还能抑制血栓形成因子如内皮细胞型纤溶酶原激活物抑制因子(PAI-Ⅰ)和组织因子的表达,这些因子可以改变动脉血栓形成过程中的凝血平衡。
总之,糖尿病会损害血管内皮eNOS活性并促进ROS生成,从而减少NO的生物利用,进而导致血管发生动脉粥样硬化样改变。此外,在生理状态下,内皮通过几种血管活性介质(主要是NO)来调节血管紧张度。然而,这些功能在糖尿病状态下发生改变。高血糖、胰岛素抵抗和高游离脂肪酸(FFA)可引发全身炎症反应并损害NO的生物利用,最终导致血管内皮功能受损。胰岛素通过连续磷酸化激活eNOS和生成NO,胰岛素也可通过激活磷脂酰肌醇3-激酶/Akt途径,增强eNOS活化和随后的NO产生。但糖尿病患者存在的胰岛素抵抗可抑制NO产生的生理过程从而减少正常NO的分泌。此外,在糖尿病的病理生理改变中,FFA水平显著升高,NO生物利用度进一步受损,而氧化型低密度脂蛋白(oxLDL)形成增强,进而加剧了动脉粥样硬化进程。
直到二十世纪末,血管生成被认为仅发生在胚胎发生期间,而出生后新生血管形成则完全来自预先存在的血管发生增殖、迁移和重塑,即血管发生的过程。然而1997年,Asahara等人在人类外周血中鉴定出一种能分化为血管内皮细胞的前体细胞,并发现其能够进入宿主血管受伤区域进行再生而有助于血管损伤的修复。骨髓、外周血和脐血中存在的这种能进一步分化为内皮细胞进而参与受损血管内皮修复与血管新生的细胞,被称为血管内皮祖细胞 (EPCs),该细胞不仅参与胚胎血管生成,在出生后对稳定血管内膜、修复受损血管,促进血管新生与缺血区侧支循环的建立,改善缺血区域血供发挥重要作用。同时也可迁移到其他缺血、炎症及肿瘤组织中,形成新生血管。它在修复心梗患者心脏血管的病变,改善冠心病、肢体缺血、脑卒中、糖尿病患者血管损伤等方面有独特的功能。
在血管损伤或组织缺血的情况下,存在于骨髓中的EPCs可以受局部释放的生长因子和细胞因子的刺激而发生增殖、分化并释放至外周血液循环中,特异性的归巢于损伤或缺血部位,再进一步增殖、分化为成熟的内皮细胞,参与血管新生和再内皮化,从而替代缺失或者功能失调的内皮细胞。目前把CD133、CD34和血管内皮生长因子受体2(VEGFR 2)视作EPCs的特征性表面标志,其中CD133是造血干/祖细胞的标志。而CD133的表达缺失以及CD34、血管性血友病因子(vWF)、CD144、含激酶插入区受体(KDR)等的表达则作为EPCs分化成熟的特异性标志。
已有诸多研究发现,EPCs与糖尿病大血管病变存在密切关系。临床以及实验室研究都提示糖尿病损害EPCs的数量以及质量,从而使EPCs对血管损伤的应答速度减缓。与健康对照组相比,2型糖尿病大血管病变患者血循环中CD34 + / KDR +细胞数量显著减少,而CD34 + / KDR +细胞水平与踝肱指数、颈动脉狭窄程度和跛行严重程度密切相关。单纯1型糖尿病患者中也可观察到血循环中EPCs数量和颈动脉内膜-中层厚度(CIMT)及斑块形成之间的相关性,EPCs失调可诱发血管内皮功能障碍,从而在糖尿病动脉粥样硬化发病中起重要作用。
糖尿病大血管病变具有发病率高、进展迅速和典型的远端多部位损害等特点。已有大量的研究证实,糖尿病并发大血管病变患者外周血中EPCs的数量及功能普遍下降,提示糖尿病大血管病变发生与外周血EPCs数量减少和功能改变密切相关。已有诸多研究证实EPCs在血管形成中起显著作用,尤其在创伤或缺血时通过刺激骨髓源性内皮祖细胞向外周迁移,并释放进入血液循环中。提高外周EPCs的数量和活化程度,到达内皮损伤部位或缺血组织并黏附在现有的内皮细胞上进行修复或形成新的血管。目前认为EPCs促进新生血管形成的机制包括两个方面:一方面是通过自身的分化增殖而形成新生血管,无须依赖原来的血管系统;另一方面,EPCs本身可以分泌VEGF等细胞生长因子,通过旁分泌效应促进局部血管内皮细胞增殖,即增强血管生成效应。此外,基质细胞衍生因子1(SDF-1)、血小板源性生长因子(PDGF)、成纤维细胞生长因子和干细胞因子等也有动员EPCs的作用,这些细胞因子对EPCs动员及功能的调节与磷脂酰肌醇-3激酶/丝氨酸/苏氨酸蛋白激酶(P13K/Akt)信号通路有关。
高血糖可导致循环成血管细胞(CAC)和内皮克隆形成细胞(ECFC)的功能障碍,减少其迁移、分泌和血管生成能力。研究发现,2型糖尿病患者的EPCs与活化内皮细胞的黏附、增殖以及形成血管的能力下降,从而使糖尿病新生血管形成能力受损。研究还发现,CAC和ECFC对高血糖诱导的过度氧化的耐受性降低,从而导致其功能障碍。此外,AGEs的积累可促进CAC和ECFC细胞凋亡并损害其迁移、黏附和分泌潜能。
系列文章推荐
来源:糖甲大院
查看更多