查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





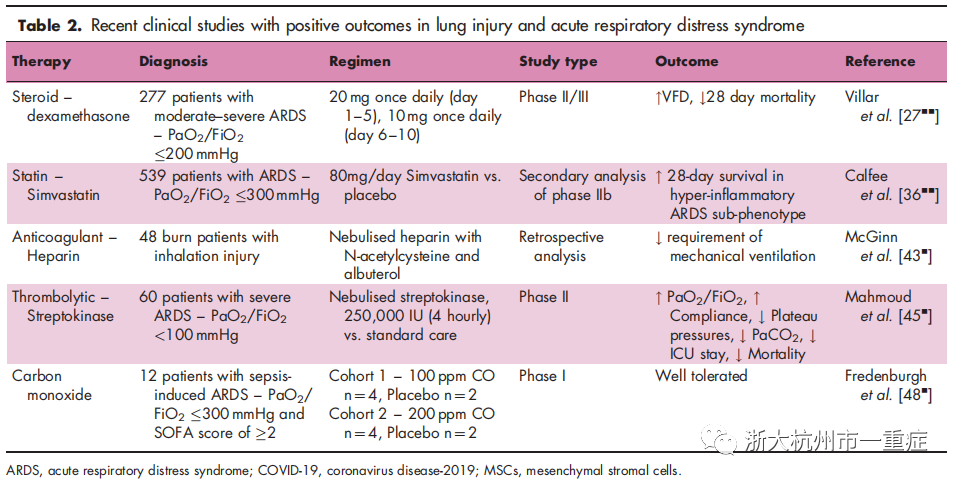
ARDS临床试验中的药物治疗
最近的研究为几种新兴的 ARDS药物治疗提供了支持,包括类固醇,他汀类药物,维生素,抗凝剂,干扰素和一氧化碳(表 2)。
类固醇
类固醇不仅是有效的抗炎药,而且还能抑制宿主免疫反应,从而导致感染的风险,关于其是否用于ARDS的治疗,研究结论一直有争议。但是,最近的发现表明,在ARDS早期使用有针对性的类固醇激素可能是有益的。Villar等人观察到,地塞米松(每天 20 mg,共 5天,然后每天 10 mg,共 5天)早期(在 ARDS诊断的 24小时内)增加了无呼吸机天数(VFD),并降低了中重度 ARDS患者死亡率。一项回顾性研究发现肺癌切除手术后被确诊为ALI并接受早期类固醇治疗(ALI诊断后<72小时)的患者肺损伤评分降低,并且更容易从呼吸机支持中撤机。
对16项回顾性观察性研究的荟萃分析,侧重于非HIV合并肺炎支原体肺炎患者的类固醇辅助治疗,结果显示类固醇可降低死亡率,但仅在低氧血症或呼吸衰竭的患者中。对接受类固醇治疗的ARDS患者的12项随机对照试验(RCT)的另一项荟萃分析显示,ARDS早期(7天)的低剂量(2 mg / kg /天氢化可的松或同等剂量)改善了氧合作用,减少了对机械通气的需求,降低了死亡率。对七个RCT的荟萃分析显示,类固醇疗法可增加 VFD并降低死亡率。
至关重要的是,类固醇的作用似乎取决于肺损伤的具体原因。最近的一项荟萃分析显示,在流感性肺炎患者中,使用类固醇与较高的死亡率相关。另一项研究表明,早期大剂量类固醇(ICU入院3天内 200mg )可增加流感性肺炎患者的死亡率,并增加对菌血症的敏感性。
最近,RECOVERY 研究人员证明,相对低剂量的地塞米松(每天6mg,连续10天)可提高COVID-19患者生存率,在需要辅助通气的患者中效果最大。
他汀类药物
他汀类药物是一种降脂药物,可抑制HMG-CoA还原酶并具有免疫调节特性。重症 ARDS或脓毒症的重症患者在 ICU入院前接受他汀类药物治疗,在最近的荟萃分析中显示其30天死亡率较低,但院内死亡率无差异。在ARDS患者中进行的辛伐他汀疗法(80mg /d)的 HARP-2 试验未观察到主要或次要疗效的改善。然而,对 HARP-2试验中539名患者的潜在分类分析表明,这些患者可以分为两种亚型。高炎症亚型占登记患者的35%,接受辛伐他汀治疗的该组患者的28天死亡率较低,而90天死亡率较低。最近一篇文章讨论了分别对 ARDS和脓毒症的他汀类药物的HARP-2和SAILS试验进行分层再分析,强调了未来的表型分析技术的必要性,该技术可以识别最有可能从他汀类药物和其他药物中受益的 ARDS患者。
维生素 C
针对ARDS,正在研究以其免疫调节和保护作用而闻名的维生素C和D。CITRIS-ALI多中心 II 期对167例脓毒症和 ARDS患者进行了研究。考察了维生素C输注(4天中每 6小时50 mg / kg)对器官衰竭,炎性生物标志物和血管损伤的影响。尽管维生素C不会影响这些主要结果,但次要分析表明,维生素C降低了 28天的死亡率。
维生素D缺乏症在重症患者中普遍存在,并已显示出会导致肺损伤和ARDS。最近,一项大规模的Ⅲ期维生素D阶段研究使用即时检验来确定重症监护病房(ICU入院时)维生素D3水平低而有死亡风险的重症患者。危险因素包括肺炎,败血症,休克,肺挫伤,误吸,胰腺炎,吸烟或进行急性呼吸衰竭的机械通气。这些患者被随机分配接受维生素D或安慰剂,但不幸的是,与安慰剂相比,早期给予维生素D治疗并没有改善结局。另一项 II期研究检查了术前单次高剂量(7.5mg)维生素D对食管切除术后患者肺部损伤发展的影响。早期大剂量维生素D并未影响主要结局,尽管已证明治疗可降低术后肺血管通透性。有必要进一步研究维生素在ARDS中的复杂作用。
抗凝剂,抗凝血酶和溶栓
凝血异常与ARDS的病因有关,患者常有栓塞风险。在脓毒症诱发的ALI大鼠模型中,肝素降低BAL细胞因子,肺水肿和血管渗漏。此外,在油酸滴注和LPS损伤的双重打击大鼠模型中,雾化吸入肝素和抗凝血酶均下调了炎症和凝血损伤,而不会影响全身性凝血。
在一项回顾性研究中,雾化吸入肝素与N-乙酰半胱氨酸和沙丁胺醇一起减少了吸入性肺损伤患者的机械通气。此外,肝素降低了H1N1引起的ARDS患者血栓栓塞的风险。最后,最近有研究表明,对标准治疗无反应的60名ARDS患者的RCT中,链激酶可改善肺氧合和功能,并减少ICU停留时间和死亡率。
抗凝疗法正在作为COVID-19诱导的ARDS的一种潜在疗法进行试验,其研究依据是:肺微血栓形成和明显的静脉血栓栓塞在严重COVID-19诱发的呼吸衰竭的发病机理中起着关键。
干扰素
干扰素(IFN)的类型和功能不同,并且在ARDS中起相反的作用。IFN-g是具有促炎作用的I型干扰素,抗IFN-g治疗可减轻小鼠的H1N1流感。
FN-b1a是具有免疫调节和抗病毒作用的Ⅲ型干扰素。尽管在II期研究中显示安全性,但IFN-b1a未能改善中至重度ARDS患者的Ⅲ期评估结果。有必要进行进一步的研究来破译 ARDS中IFN的复杂作用。干 扰 素 疗 法 已 在 COVID-19 诱 导 的 ARDS (NCT04385095)中作为一种潜在疗法进行了试验,最近的一项最新报道(尚未发表)指出,吸入干扰素β1a制剂可减少严重呼吸衰竭的发生。
一氧化碳
一氧化碳(CO)因其对肺部的抗炎和保护作用而被公认,在八项接受低吸入剂量(100-200ppm)的 ARDS患者的I期研究中显示是安全的。SOFA评分和肺损伤评分趋于改善,目前正在进行针对 ARDS的 CO(200ppm)的II期研究(NCT03799874)。
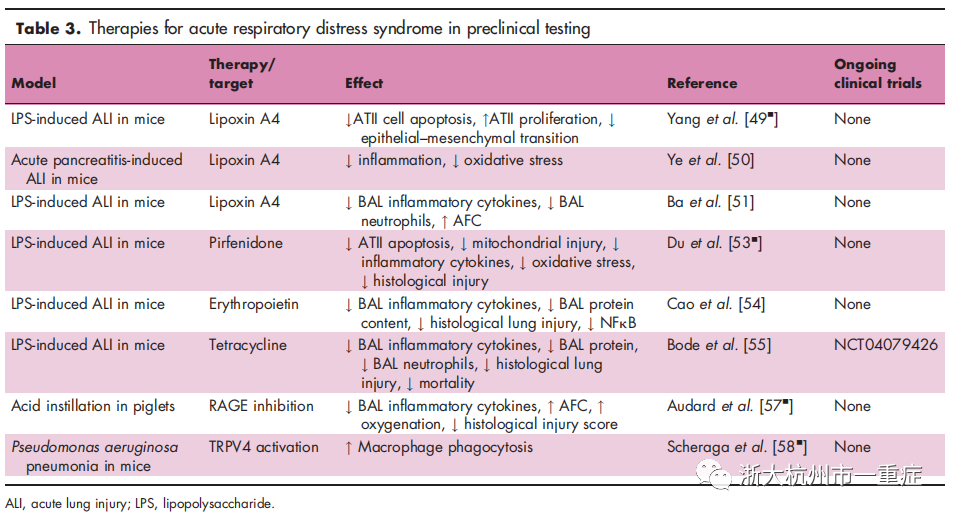
临床前研究
临床前研究中,针对ARDS的许多有前景的药物疗法,包括脂蛋白A4、NLRP3炎性小体抑制剂,以及减轻上皮损伤的疗法均在试验中(表 3)。
脂氧素A4
LipoxinA4是一种脂质介质,在肺中具有抗炎,抗氧化和促分解作用。在体外,脂蛋白A4已被证明可以限制LPS损伤后II型肺泡上皮细胞(ATII)的细胞凋亡并增强其增殖,同时抑制上皮-间充质细胞转化。LipoxinA4在体内的作用类似,可抑制 LPS诱导的小鼠ALI 。在小鼠急性胰腺炎诱导的 ALI模型中,脂蛋白A4下调炎症细胞因子和氧化剂损伤,并最终通过部分调节核因子E2相关因子2(Nrf2)信号通路及其下游基因血红素加氧酶降低ALI-1。另一项 LPS诱导的ALI小鼠研究强调,脂氧还蛋白A4减少了BAL中性粒细胞浸润,炎性细胞因子。此外,脂蛋白A4已显示出至少通过部分减轻肺上皮中水通道蛋白5的下调来增强肺泡液清除(AFC)和维持上皮屏障功能。最后,研究表明,脂蛋白A4抑制p38和JNK的激活,丝裂原激活的蛋白激酶(MAPK)通路,分别参与下游炎症性细胞因子的释放和细胞凋亡。
NLRP3炎性体抑制剂
NLRP3炎性小体在ALI期间被激活,导致细胞死亡和炎性细胞因子释放。吡非尼酮,抗纤维化剂和NLRP3炎性小体抑制剂被证明可抑制LPS诱导的ALI后ATII凋亡,内质网应激,线粒体损伤,BAL炎性细胞因子,氧化应激和组织学肺损伤。另一项最新研究表明,促红细胞生成素(一种促红细胞生成素)通过抑制 NLRP3炎性体的活化来改善LPS诱导的小鼠 ALI。四环素最近被证明可以在体外LPS攻击后选择性抑制NLRP3炎性体的激活。在体内,在小鼠受到LPS攻击后,四环素降低了BAL炎性细胞因子,BAL蛋白含量,BAL中性粒细胞,组织学肺损伤和死亡率.目前正在招募ARDS患者使用四环素的临床试验(NCT04079426)。
针对肺上皮的疗法
肺上皮损伤是 ARDS病理的标志。晚期糖基化末端的可溶性的血浆中的代表上皮损伤的产物(sRAGE)已被证明是识别有发展为ARDS风险的重症患者的潜在预测工具,也是预测ARDS严重性的工具。在仔猪酸滴灌损伤模型中,RAGE拮抗剂肽和可溶性RAGE(充当诱饵受体)均抑制炎症和组织学肺损伤,并改善AFC和氧合。
研究表明,在机械和化学诱导的ALI中,瞬时受体电位香草酸4(TRPV4)通道激活增加,并增强炎症和氧化损伤。然而,最近的一项研究表明,铜绿假单胞菌肺炎小鼠模型和健康人捐赠者的LPS攻击的巨噬细胞都需要TRPV4通道激活巨噬细胞的吞噬作用。有趣的是,一项研究在接受LPS攻击的健康人类志愿者中检测TRPV4抑制作用的研究未能实现其主要终点(降低的BAL蛋白),并被提早终止(NCT03511105)。
结论
ARDS病理学和疾病发生的时间过程涉及复杂的机制,这意味着具有多种抗炎,免疫调节和修复作用的疗法(例如MSC)可能具有重要的治疗潜力。最近的研究为几种新兴的ARDS药物疗法提供了支持,包括类固醇,他汀类药物,维生素,抗凝剂,干扰素和一氧化碳。在临床前实验中,许多针对ARDS的有前途的药物疗法,包括脂蛋白A4,NLRP3炎性小体抑制剂,以及减轻上皮损伤的疗法。最终,使用精准医学方法和工具来确定最有可能从靶向治疗中受益的同质 ARDS亚群可能是找到有效的 ARDS治疗方法的最有效方法。
小结:ARDS的几种疗法在临床研究中显示出希望,而越来越多的疗法正在临床前实验中。对ARDS的生物同质亚型的识别,可能使我们能够为这种严重综合征找到更具体、更精确的药物。
来源:浙大杭州市一重症 未亚平
查看更多