查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





综述
幽门螺杆菌感染对胃癌免疫治疗影响及其潜在机制的研究进展
康博, 许锦彪, 顾伟国, 邱峰
(南昌大学第一附属医院)
摘要
幽门螺杆菌(Helicobacter pylori,Hp)是人类消化系统常见的致病菌,世界卫生组织国际癌症研究机构公布的致癌物清单中,Hp被列为Ⅰ类致癌物。免疫治疗为胃癌患者带来新的希望,然而临床中胃癌免疫治疗响应率存在显著个体差异,部分患者疗效不佳的现象始终是亟待突破的瓶颈。近年来,越来越多研究表明Hp感染可能通过重塑肿瘤微环境、调控免疫检查点分子表达等独特路径,深度参与胃癌免疫治疗疗效的调控,这一交叉领域的研究为解析免疫治疗抵抗机制提供全新视角,具有重要的探索价值。本文系统综述Hp感染对胃癌免疫治疗的影响及潜在机制的研究进展,旨在为破解胃癌免疫治疗瓶颈、优化个体化治疗策略提供理论依据和研究方向。
前言
胃癌是全球高发恶性肿瘤,其高死亡率始终是临床治疗的严峻挑战。尽管诊断技术和治疗手段不断进步,但晚期患者预后仍不理想[1]。免疫治疗的兴起为胃癌治疗带来革新,其中免疫检查点抑制剂通过阻断免疫抑制通路激活抗肿瘤免疫,在部分患者中展现显著疗效。然而,免疫治疗响应率存在明显个体差异,仅20%~30%的患者能从中获益,寻找可靠的疗效预测生物标志物成为关键。目前研究较多的生物标志物包括程序性死亡蛋白配体-1(programmed death protein-ligand 1,PD-L1)表达水平、微卫星不稳定状态(microsatellite instability,MSI)、肿瘤突变负荷(tumor mutation burden,TMB)等,但这些标志物的预测价值仍受肿瘤异质性、检测方法等因素限制,临床应用存在局限性。幽门螺杆菌(Helicobacter pylori,Hp)长期感染可通过毒力因子(如 CagA、VacA)及炎症通路诱导胃黏膜癌变[2]。近年来研究发现,Hp感染可能通过重塑肿瘤微环境、调控免疫检查点分子等途径影响免疫治疗疗效,为解析治疗抵抗机制提供新视角[3]。深入探究二者关联及潜在机制,有望为优化免疫治疗策略、开发精准预测标志物奠定基础。
01
Hp感染与胃癌的关系
1.1 Hp感染在胃癌发生发展中的作用
Hp感染是胃癌发生的重要启动因素,Hp感染后可通过多种机制导致胃黏膜上皮细胞损伤和炎症反应。Hp分泌的尿素酶可分解尿素产生氨,升高局部pH值,破坏胃黏膜屏障[4];另一方面,Hp的毒力因子如细胞毒素相关基因A(cytotoxin-associated gene A,CagA)、空泡细胞毒素A(vacuolating cytotoxin A,VacA)等可直接损伤胃上皮细胞从而诱导细胞凋亡和增殖异常[5]。长期的炎症刺激可使胃黏膜上皮细胞发生一系列病理改变,从慢性浅表性胃炎逐渐发展为萎缩性胃炎、肠上皮化生、异型增生,最终导致胃癌的发生。
1.2 Hp感染影响胃癌发生发展的分子机制
1.2.1 CagA蛋白
Hp通过Ⅳ型分泌系统将CagA注入胃上皮细胞内,CagA在细胞内发生磷酸化,进而与多种信号分子相互作用,激活一系列信号通路,如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路、 磷脂酰肌醇3-激酶-蛋白激酶B(phosphoinositide-3 kinase-protein kinase B,PI3K-Akt)通路等,促进细胞增殖、迁移和侵袭,抑制细胞凋亡,从而参与胃癌的发生发展过程。此外,CagA还可通过影响细胞骨架重排,改变细胞形态和极性,增强细胞的恶性表型[6]。
1.2.2 VacA蛋白
VacA可在胃上皮细胞内形成空泡,干扰细胞内的正常生理功能。VacA还具有免疫调节作用,能够抑制T细胞的增殖和活化,减少细胞因子的分泌,从而削弱机体的免疫防御功能,为肿瘤细胞的免疫逃逸创造条件。VacA还可诱导胃上皮细胞产生氧化应激反应导致DNA损伤和基因突变,进一步增加胃癌发生的风险[7]。
1.2.3 炎症相关信号通路
Hp感染引发的炎症反应在胃癌发生发展中起着关键作用。Hp长期慢性感染,在体内激活干扰素基因刺激物(STING)通路信号传导[8]。来自细菌或坏死细胞的细胞双链DNA(double-stranded DNA,dsDNA)被宿主细胞的胞质DNA感受器环状GMP-AMP合成酶(cyclic GMP-AMP Synthase,cGAS)捕获,催化合成第二信使环状GMP-AMP(cGAMP),cGAMP作为“信使”与内质网上的接头蛋白STING结合并激活STING,STING激活后会招募TANK结合激酶1(TANK-binding kinase 1,TBK1)和IκB激酶(IκB kinase,IKK),这种招募会导致干扰素调节因子3(interferon regulatory factor 3,IRF3)和核因子-κB(nuclear factor-kappa B,NF-κB)磷酸化[9],释放多种炎症细胞因子,如白细胞介素(interleukin,IL)-1、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α等。以上细胞因子又可激活NF-κB、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)等炎症相关信号通路,促进炎症介质的持续产生,导致胃黏膜上皮细胞的增殖、凋亡失衡,以及细胞周期紊乱,进而促进胃癌的发生发展[10]。同时,由于长期的慢性炎症,STING通路的持续过度激活,会导致树突状细胞及其他免疫细胞功能紊乱,促进免疫抑制性肿瘤微环境的形成。此外,持续的炎症状态还可诱导活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的产生,进一步损伤DNA,增加基因突变的概率[11]。
02
Hp感染对胃癌免疫治疗疗效的影响
2.1 Hp感染影响胃癌免疫治疗疗效的临床研究
近年来,许多研究均探讨了Hp感染与胃癌免疫治疗疗效之间的关系,但结果存在争议。其中部分研究表明,Hp感染可能降低胃癌免疫治疗的疗效。一项回顾性研究显示与Hp未感染组相比,Hp感染组患者对PD-1抗体产生非临床应答的风险更高(OR=2.91,95%CI:1.13~7.50)。Hp未感染组患者的总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)较感染组均显著延长,中位OS分别为17.5个月和6.2个月(HR=2.85,95%CI:1.70~4.78;P=0.021),中位PFS为8.4个月和2.7个月(HR=3.11,95%CI:1.96~5.07;P=0.008)。多因素分析显示,Hp感染与PFS呈独立相关性(HR=1.90,95%CI:1.10~3.30;P=0.022)[12]。一项Meta分析结果显示Hp未感染患者OS则显著延长(HR=1.25,95%CI:1.05~1.50;P=0.012;I2= 87%);与Hp感染组相比,Hp未感染组的临床应答率显著增高(OR=0.40,95%CI:0.28~0.57;P<0.00 00 01;I2=0)[13],提示Hp感染可能会显著降低胃癌免疫治疗的应答率。一项针对80例胃癌术后使用抗Hp疗法联合新辅助化疗患者的研究显示,试验组(抗HP疗法联合FOLFOX4化疗)治疗1、3、6、12个月时血清血管内皮生长因子(vascular endothelial growth factor,VEGF),成纤维细胞生长因子(basic fibroblast growth factor,bFGF)值均较对照组(FOLFOX4化疗)显著降低(P<0.05),且试验组PFS及OS明显长于对照组,间接表明对Hp感染胃癌患者采取抗Hp治疗可能对胃癌免疫治疗具有积极影响[14]。此外,还有研究发现Hp感染状态与胃癌免疫治疗疗效之间无明显关联[15]。上述研究结果的差异可能与研究设计、样本量、患者人群、免疫治疗药物种类、检测Hp感染方法的不同以及肿瘤微环境的个体差异等多种因素有关。因此,需要进一步开展大规模、多中心、前瞻性的临床研究,以明确Hp感染对胃癌免疫治疗疗效的影响。
2.2 Hp感染影响胃癌免疫治疗疗效的可能原因
2.2.1 免疫逃逸
Hp感染可通过多种机制导致机体免疫逃逸,从而影响胃癌免疫治疗的疗效。Hp感染诱导胃黏膜上皮细胞表达PD-L1,增加肿瘤细胞与T细胞表面PD-1的结合,抑制T细胞的活化和抗肿瘤免疫反应,使肿瘤细胞逃避机体免疫系统的监视和杀伤。另外,Hp感染引发的慢性炎症反应可导致肿瘤微环境中免疫抑制细胞的浸润,如调节性T细胞(regulatory T cells,Treg)、髓源性抑制细胞(myeloid-derived suppressor cells,MDSC)等[16]。Treg细胞可通过分泌抑制性细胞因子(如IL-10、转化生长因子β等)抑制效应T细胞的功能,MDSC则可通过多种途径抑制T细胞、自然杀伤细胞等免疫细胞的活性,促进肿瘤细胞的免疫逃逸。此外,Hp感染还可能影响抗原提呈细胞的功能,降低其对肿瘤抗原的摄取、加工和提呈能力,导致T细胞无法有效识别肿瘤细胞,从而影响免疫治疗的效果。
2.2.2 炎症微环境
长期的Hp感染可导致胃黏膜持续处于炎症状态,这种慢性炎症微环境可对胃癌免疫治疗产生负面影响。炎症微环境还可诱导肿瘤血管生成,为肿瘤细胞提供营养和氧气,促进肿瘤的生长和转移[17]。免疫治疗药物在这种复杂的炎症微环境中可能难以发挥最佳疗效,导致治疗效果不佳。
2.2.3 菌群失调
Hp感染可破坏胃内正常菌群的平衡,导致菌群失调。正常菌群在维持机体免疫稳态中起重要作用,菌群失调可能影响免疫系统对肿瘤细胞的识别和攻击。此外,菌群失调还可能影响免疫治疗药物的代谢和疗效。肠道微生物群可通过影响免疫细胞的发育、分化和功能,以及调节免疫检查点分子的表达,对免疫治疗疗效产生影响[18]。因此,Hp感染引起的胃内菌群失调可能间接影响胃癌免疫治疗的疗效。
2.2.4 菌株特异性
VacA和CagA是目前研究较广泛的Hp毒力因子,根据是否分泌VacA或CagA可将Hp分为Ⅰ型和Ⅱ型,其中Ⅰ型分泌VacA或CagA,Ⅱ型则不分泌。炎性反应的程度可能取决于Hp菌株的细胞毒性,菌株的细胞毒性越强,则炎性反应程度越严重[19],推测不同Hp菌株感染所创建的独特免疫背景,可能是导致胃癌患者对免疫治疗产生异质性应答的因素之一,因此有必要在未来开展前瞻性队列设计,探讨不同Hp菌株与免疫治疗的关联性。
03
Hp感染影响胃癌免疫治疗疗效的潜在机制
3.1 对肿瘤微环境中免疫细胞的影响
3.1.1 T细胞
Hp感染可影响肿瘤微环境中T细胞的数量和功能。Nasr等[20]研究表明,Hp感染胃癌患者肿瘤组织中CD8+T细胞的浸润数量减少,且CD8+T细胞的活性受到抑制,表现为细胞毒性相关分子(如穿孔素、颗粒酶B等)的表达降低,以及T细胞耗竭标志物如PD-1、淋巴细胞活化基因-3(lymphocyte activation gene 3,LAG-3)、T淋巴细胞免疫球蛋白黏蛋白-3(T cell immunoglobulin and mucin domain-3,TIM-3)等的表达升高。此外,Hp感染还可导致肿瘤微环境中Treg细胞的比例增加,Treg细胞通过分泌抑制性细胞因子,抑制CD8+T细胞等效应T细胞的功能,从而促进肿瘤细胞的免疫逃逸。进一步研究发现,Hp感染可能通过影响T细胞的分化和极化,改变T细胞亚群的分布。如Hp感染可促进辅助性T细胞17(type 17 helper T cell,Th17)的分化,Th17细胞分泌的IL-17等细胞因子可加重炎症反应,同时抑制抗肿瘤免疫反应。
3.1.2 巨噬细胞
巨噬细胞在肿瘤微环境中具有重要的免疫调节作用,可分为经典活化的M1型巨噬细胞和替代活化的M2型巨噬细胞。M1型巨噬细胞具有抗肿瘤活性,能够分泌促炎细胞因子和活性氧等物质,杀伤肿瘤细胞;M2型巨噬细胞则具有免疫抑制作用,可促进肿瘤细胞的生长、转移和血管生成。Zhou等[21]研究发现,Hp感染可诱导肿瘤微环境中的巨噬细胞向M2型极化,使其分泌更多的免疫抑制因子,如IL-10、精氨酸酶1等,从而抑制机体的抗肿瘤免疫反应。此外,Hp感染还可通过调节巨噬细胞表面的受体表达,影响其对肿瘤细胞的吞噬和杀伤功能。
3.1.3 树突状细胞
树突状细胞是体内功能最强的抗原提呈细胞,能够摄取、加工和提呈肿瘤抗原,激活初始T细胞,启动抗肿瘤免疫反应。Hp感染可影响树突状细胞的功能,使其抗原提呈能力下降。Xue等[22]表明,Hp感染后,树突状细胞表面的共刺激分子(如CD80、CD86等)表达降低,导致其与T细胞之间的相互作用减弱,无法有效激活T细胞。此外,Hp感染还可抑制树突状细胞的成熟和迁移,使其无法正常迁移至淋巴结,与T细胞相互作用,从而影响抗肿瘤免疫反应的启动。
3.2 对免疫检查点分子表达的影响
3.2.1 PD-1/PD-L1通路
如前所述,Hp感染可上调肿瘤细胞和肿瘤微环境中免疫细胞表面PD-L1的表达。Hp的毒力因子CagA可通过激活相关信号通路,如PI3K-Akt-mTOR通路、MAPK通路等,促进PD-L1的转录和翻译。另外,Hp感染引发的炎症反应产生的细胞因子,如干扰素-γ(interferon-gamma,IFN-γ)、TNF-α等,也可诱导PD-L1的表达上调。PD-L1表达的增加可增强其与T细胞表面PD-1的结合,抑制T细胞的活化和功能,导致肿瘤细胞免疫逃逸[23]。在免疫治疗过程中,高表达的PD-L1可与免疫检查点抑制剂竞争结合PD-1,降低免疫检查点抑制剂的疗效。
3.2.2 其他免疫检查点分子
除了PD-1/PD-L1通路外,Hp感染还可能影响其他免疫检查点分子的表达,如细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、TIM-3、LAG-3等。有研究[24]发现,Hp感染胃癌患者肿瘤组织中CTLA-4、TIM-3、LAG-3等免疫检查点分子的表达水平高于Hp未感染患者。这些免疫检查点分子可协同作用,进一步抑制T细胞的活性,促进肿瘤细胞的免疫逃逸,从而影响胃癌免疫治疗的疗效。然而,目前关于Hp感染对这些免疫检查点分子调控机制的研究较少,仍需进一步深入探讨。
3.3 对肿瘤相关信号通路的影响
3.3.1 NF-κB信号通路
NF-κB是一种重要的转录因子,在调节细胞炎症反应、免疫应答、细胞增殖和凋亡等过程中发挥着关键作用。Hp感染可激活胃黏膜上皮细胞和免疫细胞中的NF-κB信号通路。Hp的CagA蛋白可与细胞内的一些信号分子相互作用,间接激活NF-κB;Hp感染引发TNF-α、IL-1β等炎症因子,可通过相应的受体激活NF-κB信号通路。激活的NF-κB可促进一系列炎症介质、细胞因子和免疫调节分子的转录和表达,导致肿瘤微环境中的炎症反应持续存在,抑制抗肿瘤免疫反应。此外,NF-κB还可上调肿瘤细胞中一些抗凋亡蛋白的表达,增强肿瘤细胞的存活能力,促进肿瘤的生长和发展,从而影响免疫治疗的效果[25]。
3.3.2 STAT3信号通路
STAT3是一种重要的信号转导和转录激活因子,对肿瘤细胞的增殖、存活、侵袭和免疫逃逸均有重要作用。Hp感染引发的炎症反应产生的细胞因子可与细胞表面的相应受体结合,激活Janus激酶(Janus kinase,JAK),进而磷酸化STAT3,使其发生二聚化并转位至细胞核内,调节相关基因的表达。激活的STAT3可促进肿瘤细胞的增殖和存活,抑制细胞凋亡,同时还可诱导肿瘤细胞分泌免疫抑制因子,抑制机体的抗肿瘤免疫反应[26]。
3.4 对肠道微生物群的影响
Hp感染不仅会影响胃内微生态,还可能通过多种途径对肠道微生物群产生影响,进而间接影响胃癌免疫治疗的效果。研究显示PD-1治疗应答者的肠道菌群Shannon多样性指数显著高于非应答者,且其多样性水平可作为预测PD-1疗效的生物标志物。有研究[27]对50例接受PD-1阻断剂治疗的癌症患者(包括15例非小细胞肺癌与35例胃癌)的粪便样本进行分析,发现无论癌症类型,菌群多样性高的患者PFS更长。在Hp感染小鼠模型中发现肠道内拟杆菌门、厚壁菌门等菌群的相对丰度发生改变,且微生物群的多样性降低[28]。肠道微生物群的失衡可能影响肠道屏障功能,导致肠道通透性增加,使肠道内的细菌及其代谢产物易位进入血液循环,引发全身炎症反应,影响免疫系统的正常功能。此外,肠道微生物群还可通过与免疫系统相互作用,调节免疫细胞的发育、分化和功能。肠道内的某些共生菌可促进T细胞的分化和成熟,增强机体的抗肿瘤免疫反应;而菌群失调时,可能导致免疫细胞功能紊乱,抑制抗肿瘤免疫反应。在胃癌免疫治疗中,肠道微生物群的失衡可能干扰免疫治疗药物对免疫系统的激活作用,降低治疗疗效[29]。此外,肠道微生物群还可能影响免疫治疗药物的代谢和药代动力学。肠道微生物群可参与药物的代谢过程,影响药物的吸收、分布、代谢和排泄。肠道内的某些细菌可产生特定的酶,对免疫治疗药物进行修饰,从而改变药物的活性和疗效。因此,Hp感染引起的肠道微生物群改变可能间接影响免疫治疗药物在体内的代谢和作用,进一步影响胃癌免疫治疗的效果。
04
针对Hp感染改善胃癌免疫治疗疗效的策略
4.1 Hp根除治疗联合免疫治疗
鉴于Hp感染可能对胃癌免疫治疗疗效产生负面影响,可尝试将Hp根除治疗与免疫治疗相结合(图1),以提高治疗效果。Hp根除治疗主要采用质子泵抑制剂、铋剂和抗生素联合的方案,如经典的四联疗法。一项回顾性研究纳入429例接受根治性胃切除术的早期胃癌(early gastric cancer,EGC)患者,将其分为Hp成功根除组及非根除组,分别计算无病生存期(disease-free survival,DFS)和OS,结果表明根除Hp治疗可以预防EGC术后复发,延长EGC患者生存率[30]。根除Hp可减少其对胃黏膜的持续损伤和炎症刺激,减轻肿瘤微环境中的免疫抑制状态,恢复免疫系统对肿瘤细胞的正常识别和攻击能力[31]。根除Hp后,肿瘤细胞和肿瘤微环境中免疫检查点分子(如PD-L1)的表达可能降低,从而增强免疫治疗药物的作用效果。此外,Hp根除治疗还可能调节肠道微生物群,恢复肠道微生态平衡,间接增强机体的抗肿瘤免疫反应。然而,目前关于Hp根除治疗联合免疫治疗的最佳时机、疗程以及具体方案等问题尚未完全明确,仍需要进一步开展大规模、多中心的临床研究进行探索和优化。同时,由于抗生素的使用可能导致肠道微生物群的短期紊乱,在实施Hp根除治疗时,应注意合理选择抗生素,并采取适当措施维护肠道微生态平衡,如补充益生菌等。
4.2 调节肿瘤微环境增强免疫治疗疗效
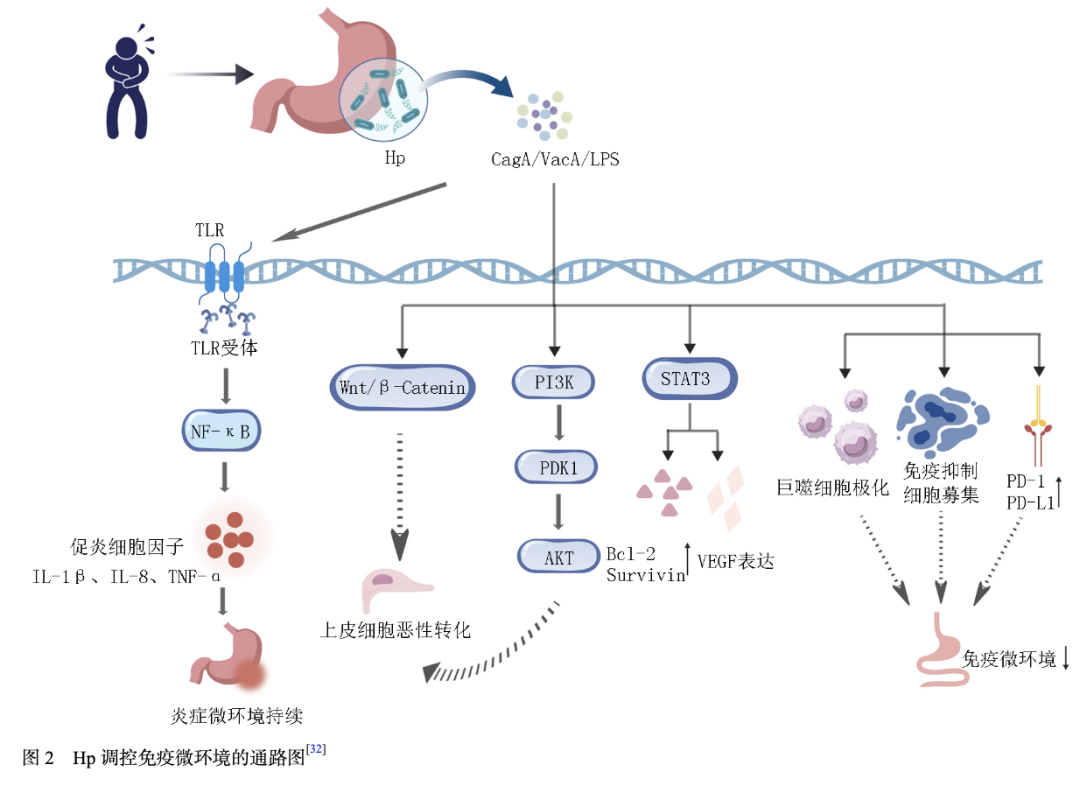
鉴于Hp感染导致的肿瘤微环境改变是影响免疫治疗疗效的重要因素(图2)[32],通过调节肿瘤微环境来增强免疫治疗疗效成为一种潜在的策略。针对肿瘤微环境中的免疫抑制细胞,如Treg细胞、MDSC等,可以采用相应的靶向治疗药物,抑制其功能或减少其数量,从而解除对效应T细胞的抑制,增强抗肿瘤免疫反应。如使用抗CTLA-4抗体可以阻断Treg细胞表面CTLA-4的功能,促进效应T细胞的活化;使用针对MDSC的靶向药物,如小分子抑制剂等,可抑制MDSC的增殖和功能[33]。此外,还可以通过调节肿瘤微环境中的细胞因子网络来改善免疫治疗疗效。针对Hp感染引发的炎症微环境中高表达的细胞因子,如IL-6、TNF-α等,可以使用相应的细胞因子拮抗剂或信号通路抑制剂,阻断其信号传导,减轻炎症反应,改善肿瘤微环境。有研究[34]表明,使用IL-6受体拮抗剂托珠单抗,可阻断IL-6与其受体的结合,抑制相关信号通路的激活,从而减轻炎症对免疫细胞功能的抑制作用,增强免疫治疗效果。
4.3 基于免疫调节的联合治疗策略
除上述策略外,还可以探索基于免疫调节的联合治疗策略,以克服Hp感染对胃癌免疫治疗的不良影响。如将免疫治疗与放疗、化疗等传统治疗方法相结合。放疗可以通过诱导肿瘤细胞凋亡、释放肿瘤抗原,增强机体的抗肿瘤免疫反应;化疗则可以直接杀伤肿瘤细胞,同时调节肿瘤微环境,增强免疫细胞的浸润和活性[35]。在Hp感染的胃癌患者中,放疗或化疗可能有助于改善肿瘤微环境,提高免疫治疗的敏感性[36]。此外,还可以考虑联合使用免疫调节剂,如卡介苗多糖核酸、胸腺肽等,这些免疫调节剂可以增强机体的免疫功能,提高免疫细胞对肿瘤细胞的杀伤活性。同时,一些中药及其提取物也具有免疫调节作用,如黄芪、人参等,可以通过调节免疫系统、抑制炎症反应等机制,与免疫治疗协同发挥作用,提高胃癌的治疗效果[37-38]。但这些联合治疗策略的具体疗效和安全性仍需要进一步的临床研究验证。
05
结语与展望
Hp感染与胃癌的发生发展密切相关,且可能通过多种机制影响胃癌免疫治疗的疗效。Hp感染可导致机体免疫逃逸、改变肿瘤微环境、影响免疫检查点分子表达以及干扰肠道微生物群等,从而降低免疫治疗的效果。然而,目前关于Hp感染对胃癌免疫治疗影响的研究仍存在诸多争议,需要进一步开展大规模、多中心、前瞻性的临床研究,明确Hp感染与胃癌免疫治疗疗效之间的关系,并深入探讨其潜在机制。针对Hp感染对胃癌免疫治疗的不良影响,采取Hp根除治疗联合免疫治疗、调节肿瘤微环境以及基于免疫调节的联合治疗等策略,可能有助于提高胃癌免疫治疗的疗效。但这些策略仍处于探索阶段,需要进一步优化和完善。未来,随着对Hp感染与胃癌免疫治疗关系研究的不断深入,有望开发出更加有效的治疗策略,改善胃癌患者的预后,为胃癌的临床治疗带来新的突破。同时,加强对Hp感染的预防和早期诊断,对于降低胃癌的发病率和提高免疫治疗效果也具有重要意义。
来源:中国肿瘤临床
查看更多