查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






简介
目的:本文用于实时逆转录-聚合酶链反应(real-time RTPCR, rRT-PCR)试剂盒体外定性检测呼吸道和血清标本中2019新型冠状病毒(2019-nCoV)。针对2019新型冠状病毒设计引物和探针组合,用于SARS样冠状病毒的通用检测和2019新型冠状病毒的特异检测。
方案应用的限制性:除本文所述的平台或化学方法,其他提及的rRT-PCR检测尚未经过验证。
标本
生物安全注意事项
处理临床标本时,应穿戴适当的个人防护用品(例如防护服、手套、护目镜)。标本处理应遵循二级生物安全等级或更高标准,并在经认证的II级生物安全柜中进行。更多相关信息请参阅:
●采集、处理和检测疑似患者(PUI)临床标本中2019新型冠状病毒(2019-nCoV)的暂行准则
●微生物和生物医学实验室的生物安全(第5版)
可接受的标本
●呼吸道标本包括:鼻咽或口咽抽吸物或洗液、鼻咽或口咽拭子、支气管肺泡灌洗液、气管吸出物和痰液。
○拭子标本只能用带有铝杆或塑料杆的人造合成拭子头(例如聚酯纤维或涤纶)收集。不允许使用木杆的海藻酸钙或棉质的拭子头。
●血清
标本处理和储存
●标本采集后在4℃最多保存72小时。
●如果不能及时检测,则将标本在-70 ℃或以下保存。
●提取的核酸应在-70℃或以下保存。
标本拒收标准:
●标本未保存在2-4℃(≤4天)或冷冻在-70℃及以下。
●标本标签或记录不齐全。
●标本类型不合适。
●标本量不足。
试剂、耗材和设备要求
免责声明:以下列举的供应商或制造商的产品是适用的,但不代表获得疾病预防控制中心的认可。
试剂与耗材
●实时逆转录-聚合酶链反应的引物/探针组合
●阳性对照
●TaqPath™1-Step RT-qPCR预混液,CG(ThermoFisher;货号A15299)
●无核酸酶的分子级水
●一次性无粉手套
●P2/P10、P200和P1000气溶胶屏障的吸头
●无菌、无核酸酶的1.5 mL微量离心管
●0.2 mL PCR反应管条或96孔实时PCR反应板和光学8联管盖
●实验室记号笔
●适用于1.5 mL微量离心管和96孔0.2 mL PCR反应管的冷却冰盒
●1.5 mL微量离心管架
●可接受的表面清洁剂
○DNAZapTM(Life Technologies;货号#AM9890)
○DNA AwayTM(Fisher Scientific;货号21-236-28)
○RNAse AwayTM(Fisher Scientific;货号21-236-21)
○10%的漂白剂(1:10稀释的5.25%-6.0%次氯酸钠)
仪器设备
●PCR工作站[紫外线灯;层流(100级HEPA过滤)]
●涡旋混合器
●小型离心机
●微量移液器(2或10 µL、200 µL和1000 µL)
●多通道微量移液器(5-50 µL)
●2x96孔冰盒
●-20℃(无霜)和-70℃冰箱;4℃冰箱
●实时PCR检测系统
●核酸提取系统
核酸提取
●基于rRT-PCR扩增技术的检测性能取决于模板RNA的数量和质量。在检测标本之前,应鉴定和验证RNA提取程序的回收率和纯度。
●已证明可获得高度纯化RNA的商售提取程序包括:bioMérieux NucliSens®systems, QIAamp® Viral RNA Mini Kit, QIAamp® MinElute Virus Spin Kit 或RNasy®Mini Kit (QIAGEN), EZ1 DSP Virus Kit (QIAGEN), Roche MagNA Pure Compact RNAIsolation Kit, Roche MagNA Pure Compact Nucleic Acid Isolation Kit, RocheMagNA Pure 96 DNA and Viral NA Small Volume Kit和 Invitrogen ChargeSwitch®Total RNA Cell Kit.
●保留剩余标本和提取的核酸,立即保存至-70℃。
●仅复融当天需检测的核酸标本数量。在测试之前,勿冻融核酸标本超过1次。
质量控制
由于rRT-PCR敏感性高,上述检测应执行严格的质量控制和质量保证程序。遵循以下标准有助于最大程度地减少假阳性扩增的可能。
一般注意事项
●检测人员需熟悉使用检测流程和仪器。
●为检测试剂配制及核酸提取提供独立区域和专用设备(例如移液器、微小离心机)和耗材(例如微量离心管、移液器吸头、防护服和手套)。
●工作流程必需始终由清洁区到污染区。
●试剂配制和处理提取核酸时,穿戴干净的一次性防护服和未使用过的无粉手套。任何时候若怀疑污染,请更换手套。
●引物/探针和酶预混合物(请参阅说明书)保存在适宜温度下。请勿使用过期试剂。
●尽可能尽快盖好试剂管盖和反应体系管盖。
●清洁和消毒表面。
●请勿将提取的核酸或PCR产物带入试剂准备区。
●仅使用带气溶胶屏障(滤芯)的吸头。
●仅使用PCR板条盖。不可使用PCR板密封膜。
检测对照
●对照应与所有标本同时检测。
●PTC(阳性对照)-有预期Ct值范围的阳性模板对照。
●NTC(阴性对照)-在rRT-PCR反应开始时加入阴性模板对照。
●HSC –与待测标本同时提取的人类标本提取对照;提供核酸提取程序对照和辅助阴性对照以验证核酸提取程序和试剂的完整性。
●RP-检测所有临床标本中的人类RNAse P基因以评估标本质量。
*注意:请保留PTC性能运行日志。在每次运行临床标本后,应记录对照的Ct值。
rRT-PCR检测
库存试剂准备
rRT-PCR引物/探针组合(若CDC提供,请参阅说明书 )
●注意事项:这些试剂只能在清洁区处理,避光保存于适宜温度(见下文)。避免反复冻融。复融后保持低温。
●使用无菌技术,将干粉试剂重悬于500 μL无核酸酶水(工作浓度为50X),避光于室温下复溶15分钟。
●轻柔混匀,以100 μL的体积等分引物/探针至5个预先标记的分装管中。将其中一管引物/探针避光保存于2-8℃。勿重新冻存(稳定期长达4个月)。剩余分装管保存于≤-20℃的无霜冰箱中。
阳性对照(PTC)(如果使用CDC阳性对照nCoVPC,请参见CDC提供的说明书)
●注意事项:本试剂应在核酸处理区内谨慎处理,避免造成污染。避免反复冻融。复融后保存于冰上。
●用于评估rRT-PCR的检测性能。除非已经水溶,否则将每管干粉试剂重悬于1 mL无核酸酶水中,以得到适合的工作稀释液。以100 μL的体积将试剂分装至10个分装管中,储存在≤-70°C。
●准备nCoVPC的工作稀释液,复融上述100 μL浓缩的nCoVPC分装管,以1:10进行稀释(终体积为1.0 mL)。根据检测的需求,将稀释的nCoVPC分装成适合的规格。将未使用的材料存放在≤-70°C的环境中。
●每次实验需复融单管稀释的阳性对照,保存于冰上,直至加入反应板中。丢弃未使用完的部分。
●nCoVPC也包含人类DNA,可作为RP检测的阳性对照。
仪器准备
1)首先,使用RNase Away®或新配制的10%漂白剂清洁所有工作台面、移液器、离心机和其他设备。
2)打开AB 7500 Fast DX,将模块升温至适宜温度。
3)在仪器上设置反应板并选择扩增程序。
4)仪器设置:检测通道(FAM);淬灭基团(无);参比荧光:(无);运行模式:(标准);样本体积(25 µL)
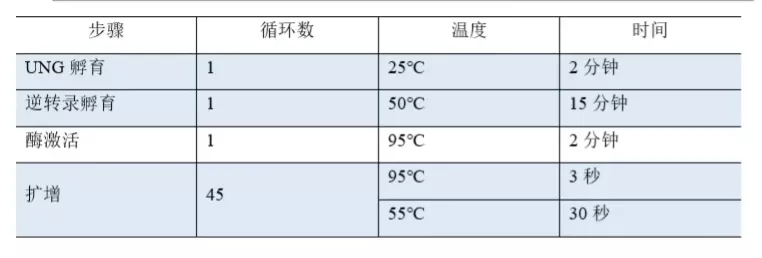
*在55℃这一步骤采集荧光信号数据(FAM)
反应体系和反应板设置
注意:反应板设置根据标本数量和工作安排而定。每批次中必须包括NTC和nCoVPCs。
1)在试剂准备区的清洁通风柜中,将rRT-PCR缓冲液、酶和引物/探针置于冰或冰盒上。在配制和使用过程中保持低温。
2)使用前将2X反应混合液复融。
3)将缓冲液、酶和引物/探针颠倒混匀5次。
4)短暂离心缓冲液和引物/探针后放回冰上。
5)标记每组装有引物/探针的1.5mL离心管。
6)确定每次检测配制的反应数(N)。由于存在移液误差,需配制NTC、nCoVPC和RP过量的反应体系。根据以下说明确定N:
如果包括对照在内的标本数(n)在1到14之间,则N=n+1
如果包括对照在内的标本数(n)等于或大于15,则N=n+2
7)对于每组引物/探针,计算每个反应需要加入的量。
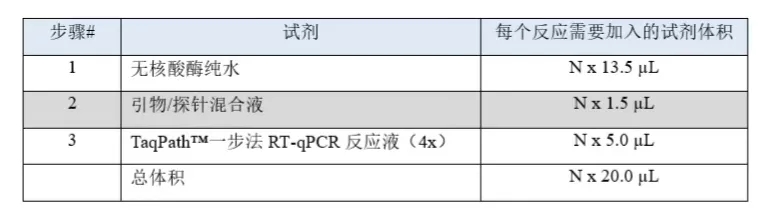
TaqPath™一步法RT-qPCR反应液
8)将试剂分别加入标记的1.5 mL离心管中。加入试剂后,通过移液器吹打混匀反应液。请勿涡旋震荡。
9)瞬离5秒,将试剂收集至试管底部,然后将离心管放回至冰盒。
10)在96孔冰盒上放置反应条或反应板。
11)将20 µL的反应体系按行加入反应孔中,如下所示(图1):
图1:反应板设置示例
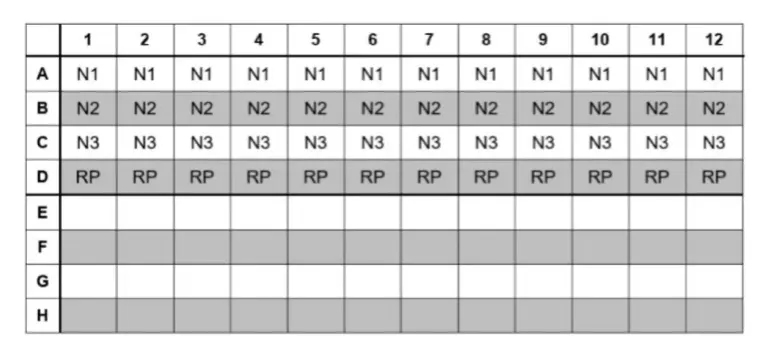
12)移动至标本制备区之前,在试剂准备区中准备第1列的NTC。
13)将5 µL无核酸酶纯水加入NTC样品孔。在进行下一步操作之前,盖紧NTC孔的盖子。
14)密封整块反应板并将反应板移至标本制备区。
加入模板
1)轻柔地涡旋震荡核酸标本约5秒。
2)离心后,将核酸标本管放入冰盒中。
3)如图2所示,应将标本加入第2-11列(第1列和第12列为对照列)试剂中。小心地将5.0 µL一号标本加入对应的反应孔中(即在第2列中加入标本“S1”)。在加样过程中关闭其他反应孔。每次加样后更换吸头。
4)盖紧加完标本的反应列的盖子,以防止交叉污染并确保标本溯源性。
5)勤换手套以避免污染。
6)其余标本重复步骤3和4。
7)必要时,可将5 µL抽提后的HSC加入到HSC孔中(图2,第11列)。加样完毕后盖紧盖子。
8)密封整块反应板,并将反应板移动到阳性对照处理区。
加入检测对照
1)将5 µL nCoVPC RNA加入第12列的标本孔中(图2)。加完RNA对照后盖紧盖子。
注意:如果使用8孔反应条,应做相应标记以提示标本位置。
不要在反应管的上方做标记!
2)将反应条瞬离10-15秒,离心完毕后放回冰盒。
注意:如果使用96孔反应板,则将反应板在4℃下,以500 g转速离心30秒。
图2. 2019-nCoV rRT-PCR诊断试剂盒:标本和对照设置示例
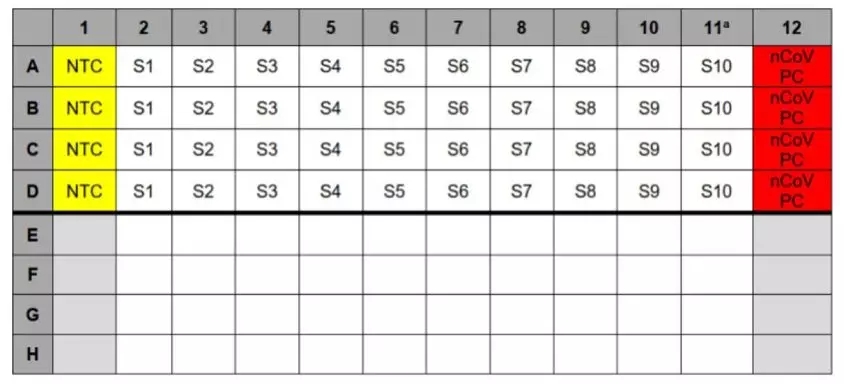
a必要时,可将本列标本替换为抽提后的HSC。
数据分析
运行完成后,请按照仪器厂商的说明保存并分析数据。手动设定阈值并对每个靶标分别分析。阈值应设在荧光曲线的指数增长期,并高于任何背景信号(请参见图3)。阈值设定的程序需保持一致。
图3. 扩增曲线窗口
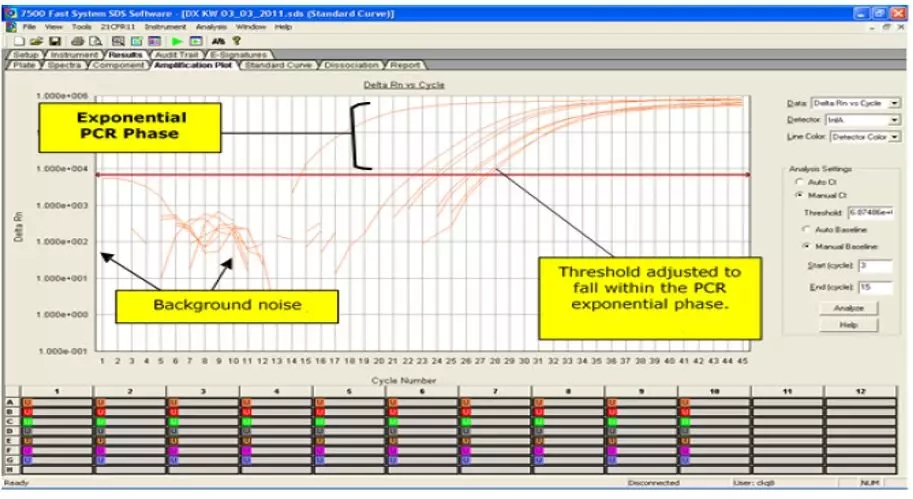
图中中英对照翻译框
Amplification Plot Window:扩增曲线窗口
Exponential PCR Phase:PCR指数期
Background noise:背景干扰
Threshold adjusted to fall within the PCR exponential phase.:阈值设定在PCR指数增长期内。
检测结果解释
●NTC应该为负值,荧光扩增曲线不应超过阈值线。
○如果一个或多个引物和探针的NTC反应出现假阳性,则可能发生标本污染。
判定该运行无效,并严格遵守操作指南重新检测。
●PTC反应结果应为阳性,且本次检测的所有靶标的Ct值都应在预期范围内。
○如果未达到预期的阳性结果,则判定该批次检测无效,并严格遵守操作指南重新检测。
○分析PTC反应失败的原因,采取纠正措施,并记录调查结果和纠正措施。
○勿使用无法产生预期结果的PTC试剂。
●对于所有临床标本和HSC,RP需在≤35个循环呈阳性,提示人RNAse P基因的核酸充足,并且标本质量合格。
○无法在HSC中检测到RNAse P可能提示:
检测方法设置和运行错误。
试剂问题或设备故障。
○在HSC中检测到RNAse P,但在临床标本中未检测到RNAse P可能提示:
从临床标本中提取核酸时操作不当导致核酸丢失或临床标本中PCR抑制剂残留。
标本中缺乏足够的人类细胞以供检测。
●对于2019-nCoV特异性引物/探针组合,HSC应为阴性。
○若任意2019-nCoV特异性引物/探针的扩增曲线超过阈值线,则解释如下:
可能已发生核酸提取试剂的污染。判定该批次检测无效,并在进一步检测之前确认核酸提取试剂的完好性。
在核酸提取步骤或检测设置过程中发生标本的交叉污染。判定该批次检测无效,并严格遵守操作指南重新检测。
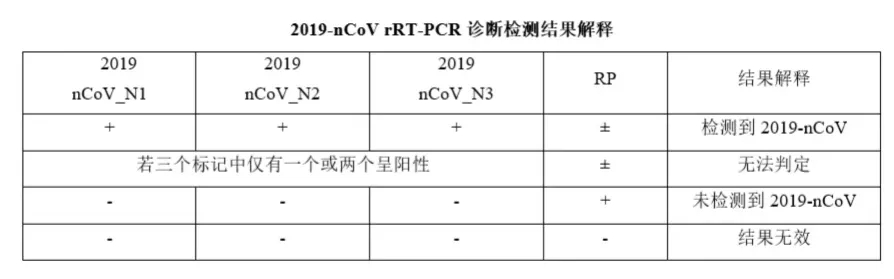
●对照均呈现预期结果时,若所有2019-nCoV靶标(N1、N2、N3)的扩增曲线均未超过阈值,且RNAse P扩增曲线均超过阈值线,则标本判定为阴性。
●对照均呈现预期结果时,若所有靶标(N1、N2、N3)的扩增曲线均超过阈值线,则该标本判定为2019-nCoV阳性。如上所述,RNase P可能是或不是阳性,但2019-nCoV结果仍然有效。
●当所有对照均呈现预期结果,且2019-nCoV靶标(N1、N2、N3)和RNAse P靶标的扩增曲线未超过阈值时,结果无效。标本中提取的RNA需重新检测。若无剩余RNA,请从剩余标本中重新提取RNA后,再复检。若复检标本的所有靶标均为阴性,但所有对照均呈现预期结果,则结果为“无效”。
●当所有对照均呈现预期结果,且任意一个或两个(N1、N2、N3)(非全部三个)靶标的扩增曲线超过阈值线时,则无法判定2019-nCoV结果。需从剩余标本中重新提取RNA复检。
检测局限性
●在检测之前,需对分析人员进行培训,并熟悉检测流程和结果解释。
●采集、运送或处理不当导致的标本中的病毒核酸丢失,则可能会导致假阴性结果。
●RNA病毒具有强大的遗传变异性。尽管已经在努力设计检测病毒基因组保守区域的rRT-PCR方法,但变异所致的引物和探针与靶序列之间的错配会导致检测性能下降和可能的假阴性结果。
来源:复旦大学附属中山医院检验科
查看更多