查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





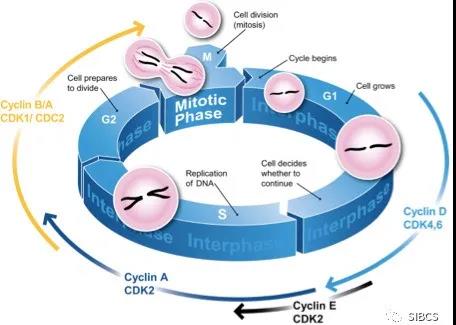
众所周知,人类成年以后,正常细胞有丝分裂周期大多逐渐减缓停滞,这主要受到周期蛋白依赖性激酶CDK控制。其中,CDK4和CDK6主要控制细胞有丝分裂周期由DNA合成前期进入DNA合成期。癌细胞的基本特征之一就是有丝分裂周期失控而疯狂分裂繁殖,这主要由于CDK4和CDK6过度活跃引起。
CDK4/6抑制剂哌柏西利、瑞博西利、阿贝西利已经先后获得美国食品药品监督管理局批准上市用于治疗乳腺癌患者,从而三分天下。目前,美国辉瑞原研的哌柏西利、山东齐鲁仿制的哌柏西利、美国礼来原研的阿贝西利已经先后获得国家药品监督管理局批准上市。2021年3月25日,国家药品监督管理局药品审评中心官方网站公示:中国恒瑞原研CDK4/6抑制剂达匹西利(SHR6390)结束征求异议,已被纳入突破性治疗品种。
2021年4月12日,英国生物医学中心旗下《生物标志研究》在线发表中国医学科学院肿瘤医院张频、徐兵河、桂琳、王文娜、修萌、中国恒瑞朱晓宇和邹建军等学者的SHR6390-I-101研究报告,公布了达匹西利首次用于人类的初步结果,探讨了达匹西利用于中国晚期乳腺癌患者的耐受性、药物代谢动力学、安全性和抗肿瘤活性。
SHR6390-I-101 (NCT02684266): A Tolerability and Pharmacokinetics Study of SHR6390 in Advanced Solid Tumor Patients
该单中心非盲I期临床研究于2016年4月15日~2018年12月21日从中国医学科学院肿瘤医院入组激素受体阳性HER2阴性晚期乳腺癌标准治疗失败的中国患者40例,以3+3的剂量递增方式口服达匹西利25→175毫克进行治疗,第1周口服1次,随后每28天的前3周每天口服1次。根据剂量递增阶段的耐受性、药物代谢动力学、抗肿瘤活性数据,选择3组剂量扩大至8~10例患者。
该研究主要终点为最大耐受剂量、药物代谢动力学,次要终点包括安全性、客观缓解率(完全缓解+部分缓解)、疾病控制率(完全缓解+部分缓解+疾病稳定≥6周)。
结果显示,达匹西利100、125、150毫克被扩大至10例患者。未见剂量受限毒性,亦未达到不可耐受剂量。
未报告严重不良事件,22例患者(55.0%)出现3或4级不良事件:
中性粒细胞减少(52.5%)
白细胞减少(35.0%)
血小板减少(5.0%)
高血压(2.5%)
50→175毫克剂量递增时,浓度-时间曲线及其峰值浓度下稳态面积与剂量几乎成正比。
疾病控制率为62.5%(95%置信区间:45.8~77.3)。客观缓解率为5%(125、150毫克组各1例部分缓解,分别持续169天、≥356天)。
在3组剂量中,150毫克:
疾病控制率最高(80.0%,95%置信区间:44.4~97.5)
无进展生存最长(中位8.4个月,95%置信区间:2.1~未达终点)
因此,该I期临床研究结果表明,达匹西利用于中国晚期乳腺癌患者的安全性可接受、血浆浓度依赖于剂量、观察到临床活性初步证据、推荐剂量为150毫克,故有必要开展进一步研究进行验证,让我们期待II期、III期临床研究结果早日发表。
来源:SIBCS

查看更多