查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,间质性肺疾病(ILD)领域首个新机制的药物nerandomilast两项III期临床研究获得成功,为ILD治疗领域带来全新的治疗选择1,2。十年来,ILD领域的新药探索研究屡遭失败3-5,为何nerandomilast能够获得成功,它的作用机制有哪些特别之处?本篇文章特邀上海交通大学医学院附属瑞金医院周敏教授,为您深度解析nerandomilast的作用机制及其可能对ILD治疗带来的影响。
间质性肺疾病发病机制复杂,多细胞作用可能是nerandomilast的破局之法
间质性肺疾病是一组以肺间质炎症和纤维化为主要表现的异质性疾病,具体类型超过200种,病因复杂6。特发性肺纤维化(IPF)是其中最具代表性的一种,以慢性、进行性、纤维化性间质性肺炎为特征,目前的研究主要也集中在此类患者中。除此之外,进行性肺纤维化(PPF)也是近年来非常受到临床关注的一组患者群体7。PPF是在过去1年内至少符合呼吸系统症状恶化、疾病进展的影像学证据、疾病进展的生理学证据中的2项,除IPF外,存在已知或未知病因的经影像学证明为进展性纤维化的ILD患者7。
目前肺纤维化(PF)的发病原因尚未完全明确,但已知多种细胞参与了其发病的病理过程,其发病机制可分为三个主要阶段:肺泡的免疫炎症反应和组织损伤、肺泡修复、肺纤维化8。参与这一系列过程的细胞包括:
肺泡上皮细胞:肺泡上皮是气体交换的关键组织,由AT1和AT2细胞组成。当肺部受损时,AT2细胞会分化为AT1细胞和新生AT2细胞,助力上皮组织修复。当肺泡上皮反复损伤时,AT2细胞会发生修复机制失调,AT2细胞功能障碍是导致肺纤维化的核心诱因之一8。
免疫细胞:免疫反应是纤维化形成的关键驱动因素。AT2细胞的初始损伤会触发多种危险信号和细胞因子的释放,例如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6),这些炎症因子会吸引并激活免疫细胞。包括巨噬细胞、中性粒细胞和淋巴细胞在内的各类免疫细胞,会向损伤部位迁移并释放更多促炎介质。这种炎症环境对启动组织修复至关重要,但若未能及时消退,则可能演变为慢性病理状态8。
血管内皮细胞:内皮细胞在肺纤维化的发病机制中起着重要作用。这些细胞通过内皮间质转化、异常血管生成信号传导以及成纤维细胞与上皮细胞的相互作用促进纤维化形成8。
成纤维细胞:在肺纤维化进程中,成纤维细胞会受到细胞因子、生长因子和机械应力的激活,分化为肌成纤维细胞。肌成纤维细胞的持续激活、增殖,并产生大量的细胞外基质(ECM),促进肺纤维化的进展8。
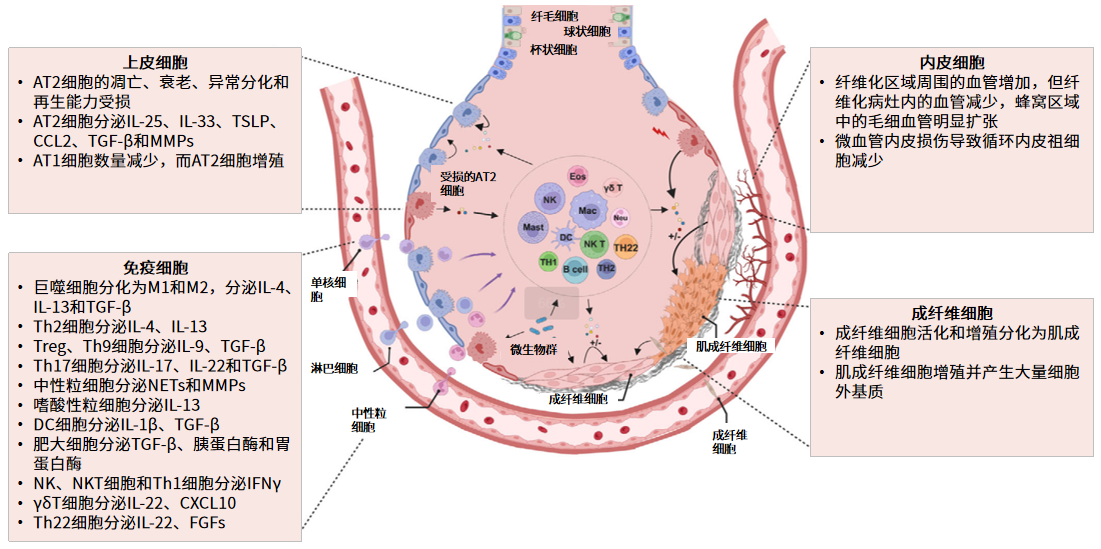
AT1:1型肺泡细胞;AT2:II型肺泡细胞;IL:白细胞介素;TSLP:胸腺基质淋巴生成素;CCL2:趋化因子C-C基序配体2;TGF-β:转化生长因子-β;MMPs:基质金属蛋白酶;DC:树突细胞;NK:自然杀伤细胞;NKT:自然杀伤T细胞;INFγ:干扰素-γ;γδT:执行固有免疫的T细胞的一个亚群;FGF:成纤维细胞生长因子
图.各种细胞对肺纤维化(PF)发病机制的作用3(图源:Jianhai Wang, et al. MedComm (2020). 2024 Sep 23;5(10)e744.)
以上这些细胞共同参与肺纤维化的发病机制及其进展过程。学界认为,IPF的复杂性需要采取多管齐下的综合治疗策略,针对多种细胞类型和信号通路展开干预9,14。
此次在ILD领域获得两项III期研究成功的药物——nerandomilast,是一种磷酸二酯酶4B(PDE4B)选择性抑制剂1,2。磷酸二酯酶(PDEs)是一类在细胞内信号传导过程中水解环鸟苷单磷酸(cGMP)和环腺苷酸(cAMP)的酶10。在单核细胞和巨噬细胞中,PDE4通过水解cAMP来增强促炎细胞因子分泌并抑制抗炎细胞因子释放;而在成纤维细胞中,PDE4对cAMP的水解则会促进ECM合成、成纤维细胞增殖及肌成纤维细胞分化10。
临床前研究显示,nerandomilast可稳定内皮屏障功能、抑制单核细胞粘附、并导致肌成纤维细胞去分化,nerandomilast在IPF和PPF中的疗效可能归因于其对上皮细胞、内皮细胞和免疫细胞以及成纤维细胞中一系列病理机制的影响,主要从免疫调节和抗纤维化两个维度发挥作用11。nerandomilast可以提高细胞内的cAMP的水平,进而减少促炎细胞因子的产生,增加抗炎因子的产生,从而调节T细胞、单核细胞、巨噬细胞的免疫功能11,12,这种免疫调节作用可进一步预防或减少炎症导致的纤维化10。
cAMP:环腺苷酸;AMP:单磷酸腺苷;PDE4B:磷酸二酯酶4B;AAV-DTR/DT:腺相关病毒-人白喉毒素受体/白喉毒素;PBMC:外周血单核细胞;GPCR:G蛋白偶联受体;MAPK:丝裂原活化蛋白激酶;TGF-β1:转化生长因子β1
图. nerandomilast对各种细胞的作用机制11(图源:Matthew J. Thomas, et al. ATS 2025.)
从PDE4泛抑制剂到PDE4B选择性抑制剂,nerandomilast精准靶向凸显机制优势
PDE4抑制剂在几乎所有炎症细胞和免疫细胞中都显示出抗炎作用,因此泛PDE4抑制剂目前已被用于治疗各种免疫炎症相关疾病,包括慢阻肺、银屑病、特应性皮炎等13。但由于泛PDE4抑制剂作用广泛,其相关的常见不良反应较多,包括腹泻、恶心、呕吐等,限制了泛PDE4抑制剂的临床使用13。
PDE4有不同的亚型,且不同的亚型在人体内的分布存在差别10,13。其中,PDE4B在肺部高表达,优先抑制该亚型可能为选择性抑制肺纤维化提供新思路,同时减少对其他组织的不良影响10。研究发现PDE4D(而非PDE4B)才是引发泛PDE4抑制剂相关恶心呕吐反应的主要原因10。体外研究显示,nerandomilast对PDE4B的抑制活性是PDE4D的9倍10,这一作用特点有望改善既往泛PDE4抑制剂突出的不良反应问题,这也意味着,nerandomilast可以在降低胃肠道副作用风险的同时它又保留其内皮保护、免疫调节和抗纤维化的作用10,14。
这一预想在其两项三期研究FIBRONEER-IPF、FIBRONEER-ILD中得到了验证。nerandomilast在IPF和PPF人群开展的III期临床研究中均达到主要终点(显著减少了用力肺活量的下降),与此同时,有着良好的安全与耐受性1,2。任何不良事件、严重不良事件的发生率在nerandomilast的两个剂量组和安慰剂组中相似,在FIBRONEER-IPF、FIBRONEER-ILD研究中均是如此1,2。此外在两项研究中,预先设定的与PDE4抑制相关的不良事件(如血管炎、自杀意念与行为、感染等)在nerandomilast治疗组与安慰剂组之间发生率无差异,未观察到相关不良事件信号1,2。nerandomilast作为一种PDE4B选择性抑制剂,实现了疗效与安全性的平衡。
周敏 主任医师
主任医师,教授,法国居里研究所博士后
瑞金医院呼吸与危重医学科副主任,博士生导师
中华医学会呼吸病分会工作秘书,呼吸治疗学组副组长
中国医师协会呼吸分会慢阻肺委员会委员、政策委员会副主委
中华预防医学会呼吸专委会委员、上海市预防医学会呼吸专委会副主委
上海女医师协会肺部肿瘤专委会副主任委员、上海医学会呼吸病学分会委员
发表论文100余篇,SCI论著80余篇,其中Lancet他引15000余次
主持科技部重大专项4项,国自然3项,入选2023年全球前2%顶尖科学家榜单
中国医师协会呼吸分会优秀中青年医师奖、上海市科委优秀学术带头人
nerandomilast作为间质性肺疾病(ILD)领域十年来首个通过III期临床研究考验的新机制药物1,2,其成功源于对肺纤维化复杂发病机制的精准干预。PDE4抑制剂是一类有着免疫调节作用的经典药物,而nerandomilast与既往泛PDE4抑制剂相比,通过选择性抑制PDE4B亚型,在显现其经典的抗炎疗效同时,也在临床试验中验证了其抗纤维化的疗效10,不仅如此,它降低了胃肠道不良反应风险10,14,实现了疗效与安全性的突破性平衡。其作用机制覆盖肺泡上皮细胞、成纤维细胞、免疫细胞及血管内皮细胞等多种细胞,从内皮功能保护、免疫调节和抗纤维化多维度协同阻断疾病进展,为特发性肺纤维化(IPF)和进行性肺纤维化(PPF)患者提供了全新的治疗选择11,14。未来,nerandomilast或将成为ILD治疗选择中的重要里程碑,推动ILD领域治疗策略的进一步发展。
参考文献
1.Richeldi L, et al. Nerandomilast in Patients with Idiopathic Pulmonary Fibrosis. N Engl J Med. 2025 Jun 12;392(22):2193-2202.2.
2.Maher TM, et al. Nerandomilast in Patients with Progressive Pulmonary Fibrosis. N Engl J Med. 2025 Jun 12;392(22):2203-2214.
3.Maher TM, et al. Ziritaxestat, a Novel Autotaxin Inhibitor, and Lung Function in Idiopathic Pulmonary Fibrosis: The ISABELA 1 and 2 Randomized Clinical Trials. JAMA. 2023;329(18):1567-1578.5.
4.Raghu G, et al. Pamrevlumab for Idiopathic Pulmonary Fibrosis: The ZEPHYRUS-1 Randomized Clinical Trial. JAMA. 2024;332(5):380-389.6.
5.Richeldi L, Schiffman C, Behr J, et al. Zinpentraxin Alfa for Idiopathic Pulmonary Fibrosis: The Randomized Phase III STARSCAPE Trial. Am J Respir Crit Care Med. 2024;209(9):1132-1140.
6.中华医学会呼吸病学分会,中国医师协会呼吸医师分会,代华平, 等.间质性肺疾病多学科讨论规范中国专家共识[J].中华结核和呼吸杂志,2023,46(12):1176-1188.
7.于娜, 等.成人特发性肺纤维化(更新)和进行性肺纤维化临床实践指南(2022版)解读[J].中国现代医学杂志,2023,33(14):1-8.
8.Jianhai Wang, et al. Pulmonary fibrosis pathogenesis and therapeutic strategies. MedComm (2020). 2024 Sep 23;5(10)e744.
9.Reininger D, et al. Insights Into the Cellular and Molecular Mechanisms Behind the Antifibrotic Effects of Nerandomilast. Am J Respir Cell Mol Biol. 2025 Apr 16.
10.Aringer M, et al. Rationale for phosphodiesterase-4 inhibition as a treatment strategy for interstitial lung diseases associated with rheumatic diseases. RMD Open. 2024 Dec 23;10(4)e004704.
11.Matthew J. Thomas, et al. Nerandomilast paves the way for novel strategies in IPF drug discovery. ATS 2025.
12.Blauvelt A, et al. Next Generation PDE4 Inhibitors that Selectively Target PDE4B/D Subtypes: A Narrative Review. Dermatol Ther (Heidelb). 2023 Dec;13(12):3031-3042.
13.Kolb M, et al. Phosphodiesterase 4B inhibition: a potential novel strategy for treating pulmonary fibrosis. Eur Respir Rev. 2023 Feb 21;32(167):220206.
14.Kalina D, Wygrecka M. Nerandomilast - A Multifrontal Therapeutic Approach to Lung Fibrosis. Am J Respir Cell Mol Biol. 2025 May 2.
审批号:SC-CN-18100
有效期至:2026年9月11日
仅供相关医药专业人士进行医学科学交流
PART
↓↓↓
查看更多