查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过









免疫检查点抑制剂(如PD-1抗体)的突破性进展为肿瘤治疗带来革命性改变,但其在实体瘤中的疗效仍面临瓶颈。尤其是消化道肿瘤,基本都是冷肿瘤,免疫治疗单药有效率低,这与其独特的免疫抑制性微环境密切相关,亟须通过联合治疗策略提高疗效。研究团队前期长期致力于逆转消化道肿瘤免疫治疗耐药的探索,前期研究提示抗血管治疗与PD-1抗体联用可部分改善晚期pMMR/MSS肠癌患者疗效(客观应答率从免疫治疗单药的2%左右提升至15.2%),但仍未突破实体瘤免疫治疗瓶颈。

表观遗传调控异常在肿瘤发生发展以及免疫调节中起着重要作用。研究发现HDACi具有增强肿瘤细胞免疫原性,改善效应免疫细胞功能等作用,为突破免疫治疗耐药提供了新思路。在血液系统肿瘤患者中,HDACi与PD-1抗体的联合使用也表现出良好的疗效。然而,这一联合方案在多种实体瘤中的尝试却一直以失败告终,提示表观遗传调控与实体瘤微环境存在复杂的交互作用,亟待进一步探索。
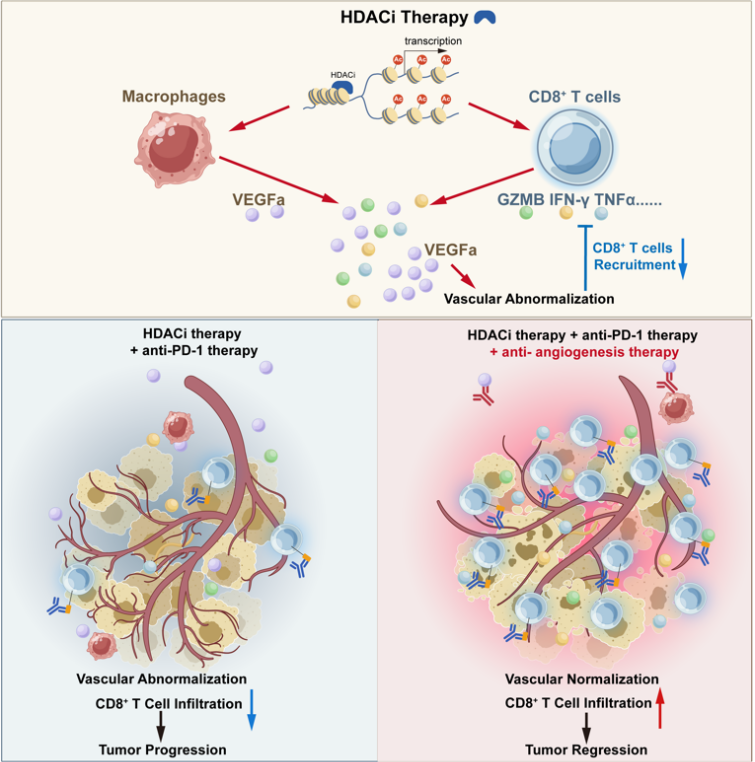
针对以上科学问题,研究团队利用结直肠癌基因工程小鼠模型iKAP等临床前模型,结合ATACseq,scRNAseq等高通量测序,发现HDACi能促进CD8+ T细胞对肿瘤细胞的杀伤功能,但是同时也促进了血管的异常新生,这些功能不健全的血管阻碍了杀伤性CD8+ T细胞浸润到肿瘤核心,这种“双刃剑”效应导致单独使用HDACi联合PD-1抗体时难以产生明显协同疗效。因此,研究团队创新性整合抗血管生成治疗,提出CAP三联新方案,重塑实体瘤免疫微环境,将“冷肿瘤”转变为“热肿瘤”,协同增敏免疫治疗,为免疫治疗不敏感的实体瘤患者提出了新的潜在治疗策略。


研究团队发现,HDACi能通过增加靶基因组蛋白乙酰化水平,开放转录的方式,促进CD8+ T细胞的颗粒酶B、干扰素-γ等杀伤性分子的表达,体外促进其对肿瘤细胞的杀伤功能。然而,体内研究却发现HDACi与PD-1抗体之间没有明显的协同效应。进一步的机制探索发现,HDACi同时上调了肿瘤相关巨噬细胞中血管内皮生长因子A(VEGFA)的转录,导致肿瘤微环境中大量异常血管生成,这些异常血管壁结构不完整、渗漏性强、血流灌注差,空间分析提示杀伤性CD8+ T细胞仅能浸润到肿瘤的边缘,无法进入肿瘤核心发挥效应。联合抗血管生成治疗之后,HDACi的“异常血管生成负性效应”得以解除,能在促进CD8+ T细胞杀伤功能的同时,促进其浸润到肿瘤核心。体内实验证实相比于任意双药治疗,CAP三药新方案均体现出更强的抗肿瘤效应。这一效应也在肠癌、黑色素瘤、肺癌等实体瘤模型中均得到验证,提示CAP新方案的普适性和外推性。
研究模式图
针对这一新方案,研究团队也发起了一项在标准治疗失败的晚期pMMR/MSS肠癌患者中的临床研究(CAPability-01,NCT04724239),对比HDACi+PD-1抗体的CP疗法与在此基础上联合抗血管治疗之后的CAP疗法的疗效差异。结果显示,CAP三药新方案组患者18周无进展率显著高于两药组(64.0% vs. 21.7%),中位无进展生存期长达7.3个月,近5倍于两药组的1.5个月。该研究进一步在临床试验中验证了CAP三药新方案的优效性和安全性,该研究于2024年3月发表于医学权威期刊《Nature Medicine》(自然医学)。

徐瑞华、王峰团队原创免疫治疗新方案破局晚期肠癌治疗困境(点击图片跳转)
综上,研究团队聚焦逆转实体瘤免疫治疗耐药的临床需求,发现由于肿瘤免疫微环境的复杂性,药物对不同细胞类型产生差异化效应,其细胞响应往往难以呈现统一规律。因此在评估药物联用疗效时,系统地考量了不同免疫微环境特征,揭示了表观遗传调控与血管微环境的交互作用机制,创造性地提出了CAP三联新方案,并开展临床研究验证了该方案的有效性。本研究也为新型多药联用策略开发提供了指导——“临床问题为导向-临床前探索-多组学验证-临床转化“的闭环研究模式,推动了抗肿瘤联合疗法的创新突破,展现了中国科研团队多年的积累。
中山大学肿瘤防治中心徐瑞华教授、王峰教授为本文共同通讯作者;汪敏医师、陈衍行医师、田麟研究员、伍宸仪博士、陈嘉颖博士、胡佳佳博士后为共同第一作者。
徐瑞华
中国医学科学院学术咨询委员会学部委员,中山大学肿瘤防治中心主任、医院院长、研究所所长,教授,博士生导师,华南恶性肿瘤防治全国重点实验室主任。中国临床肿瘤学会第四届理事长,中国抗癌协会副理事长,中国抗癌协会肿瘤内科学专业委员会主任委员,中国抗癌协会靶向治疗专委会首届主任委员,中国临床肿瘤学会第二届肠癌专委会主任委员,中国临床肿瘤学会胃癌专委会首届主任委员。以最后通讯作者在NEJM、JAMA(2)、BMJ、Cell、Nature Medicine(4)、Nature Materials、Lancet Oncology(2)、Cancer Cell(3)、Annals of Oncology (2) 等发表IF>20分论文55篇,成果被写入85 部国际指南,连续3年入选科睿唯安(Clarivate)全球高被引科学家,连续7年入选中国高被引学者榜单,H指数90。以第一完成人获得国家科技进步奖二等奖2项,中华医学科技奖、教育部科技奖及广东省科技奖等省部级一等奖共7项。获得第三届全国创新争先奖、何梁何利基金科学与技术奖、谈家桢临床医学奖、吴阶平医学创新奖以及CSCO年度成就奖。入选国家百千万人才工程、全国先进工作者、国务院特殊津贴专家、南粤百杰人才培养工程、国家卫生计生突出贡献中青年专家等人才项目。
王峰
中山大学肿瘤防治中心院长助理、内科主任、主任医师、教授,华南恶性肿瘤防治全国重点实验室PI,博导。主持国家杰出青年科学基金,获“科学探索奖”、“中国青年女科学家奖”、广东青年五四奖章等。兼任中国抗癌协会青年理事会副理事长、中国临床肿瘤学会理事、中国临床肿瘤学会结直肠癌专委会常委等。长期致力于消化道肿瘤的精准化治疗和免疫治疗增效研究,以通讯作者或第一作者,在Nature Medicine、 Cancer Cell、Cell、Journal of Clinical Oncology、JAMA Oncology、Annals of Oncology、The Lancet Gastroenterology and Hepatology 等杂志发表论文多篇。成果获国家科技进步奖二等奖(第2)、中国医学科学院“2022年度重要医学进展”奖(第1)等。作为专家组主要成员制定了ESMO泛亚洲胃癌指南、中国CSCO结直肠癌指南、卫健委结直肠癌诊疗规范等指南或规范。
来源:中山大学肿瘤防治中心
查看更多