查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





乳腺癌晚期患者循环肿瘤细胞表VimentinmRNA与AKT1mRNA水平表达对临床疗效评估的价值研究
作者:陈德波 福建医科大学附属泉州第一医院
有研究发现,在乳腺癌患者的早期便可在外周血中发现循环肿瘤细胞(circulatingtumorcellsCTC)[3]。这部分CTC可能具有不同的生理特点及致病机制,因此寻找具有特异性分子标志的高侵袭性CTC亚群对研究疾病的预后及治疗将有重要作用。CTC从原发灶肿瘤组织中脱落进入外周血循环系统过程中会经历上皮间质转化(epithelial-mesenchymaltransition,EMT),研究发现该过程将极大提高肿瘤侵袭能力[4]。参与EMT过程的间质标志物波型蛋白Vimentin属于纤丝蛋白家族中一员,其在肿瘤细胞中表达将增加肿瘤的生长速度和侵袭力。另有研究发现,蛋白激酶B(AKT1)作为PI3K/Akt信号途径中的核心成分,与肿瘤细胞增殖状态相关。其在乳腺癌癌旁正常组织中无表达,在癌组织中高表达,提示AKT1高表达可能在乳腺癌细胞癌变的过程中起一定作用[6],目前尚未有关于CTC中AKT1的表达与晚期乳腺癌患者治疗疗效存在关联的报告,因此有待进一步研究。本实验将采用阴性富集技术进行乳腺癌患者CTC富集,并联合qRT-PCR技术检测EMT间质标志物VimentinmRNA、细胞增殖标志物AKT1的mRNA表达情况,以期建立无创的外周血生物标志物监控肿瘤患者转移及预后的方法,为乳腺癌患者的预后判断提供依据。
1.1研究对象
本实验收集从2018年6月~2020年1月期间,福建医科大学附属泉州第一医院乳腺外科收治的经病理学初次确诊为晚期乳腺癌的女性患者43例,平均年龄49.6±9.3岁,其中Ⅳ期转移性乳腺癌患者27例,Ⅲ期局部晚期乳腺癌患者16例。另外纳入15例健康志愿者,平均年龄38.8±8.9岁。分别抽取患者进行治疗前及2个周期治疗结束后的静脉血7.5ml。疾病组纳入标准:①经我院确诊为晚期乳腺癌的初治患者。主要包括初诊即伴有远处转移或治疗后出现复发转移的乳腺癌、及不可手术的局部晚期乳腺癌(locallyadvancedbreastcancer,LABC),病理分期上讲通常指除T3N1M0以外的IIIa,IIIb,IIIc及Ⅳ期乳腺癌。②患者依从性良好,ECOG评分为0,1或2。③根据实体瘤疗效评价标准(RECIST)指南标准至少有一个可测量病灶。TNM分期标准采用美国癌症联合委员会AJCC(第八版)标准。本研究已获得泉州市第一医院伦理委员会的批准书及受试者的知情同意。
1.2仪器与试剂
循环肿瘤细胞差相富集试剂盒(美国Cytelligen公司);RNeasyMicroKit(德国Qiagen);RT-PCR逆转录试剂盒SYBR荧光染料(日本TaKaRa);PCR扩增仪(德国Eppendorf公司);实时荧光定量PCR仪(瑞士罗氏公司);血清CEA,CA125及CA15-3检测使用I2000SR雅培全自动化学发光免疫分析仪及相应配套检测试剂盒。
1.3方法
1.3.1治疗方法:患者治疗方案包括化疗或者化疗联合分子靶向治疗、内分泌治疗或者内分泌治疗联合分子靶向治疗,所有治疗方案均为2011版中国乳腺癌临床实践指南所推荐的治疗方案,且包含化疗方案中化疗线数不超过第三线。
1.3.2CTC的富集:为防止上皮细胞污染,弃掉前2ml血液后,收集患者外周血7.5ml于枸橼酸钠抗凝管,混匀,4h内处理。按照循环肿瘤细胞差相富集试剂盒说明书操作步骤,待富集到循环肿瘤细胞,弃上清至100μl后做进一步处理。
1.3.3qRT-PCR反应:按照RNeasyMicroKit操作说明提取上述100μl细胞液的RNA后,RT-PCR逆转录试剂盒进行cDNA合成,SYBR荧光染料试剂盒进行qRT-PCR。实时定量PCR引物由PrimerPremier6设计得出,合成由日本TaKaRa完成。内参基因GAPDH正向:5’-CAAATTCCATGGCACCGTCA-3’,反向:5’-GACTCCACGACGTACTCAGC-3’;Vimentin正向:5’-AGTCCACTGAGTACCGGAGAC-3’,反向:5’-CATTTCACGCATCTGGCGTTC-3’;AKT1正向:5’-CTGCACAAACGAGGGGAGTA-3’,反向:5’-TCACGTTGGTCCACATCCTG-3’。所得结果分析采用2-ΔΔCt方法。△△Ct=(待测样品目的基因Ct平均值-待测样本内参基因Ct平均值)-(健康对照样品目的基因Ct平均值-健康对照样本内参基因Ct平均值)。
1.3.4乳腺癌患者疗效评定标准:影像学RECIST评定标准:影像学的RECIST标准是以患者治疗2~3个周期后,通过超声或者CT等影像方法测量实体肿瘤的最大经线,比较治疗前后差异。治疗的效果分为四类:疾病进展(progressivedisease,PD):基线病灶长径总和增加≥20%或者出现新的病灶;疾病稳定(stabledisease,SD):基线病灶长径总和有缩小但未达到PR或者有增加但未达到PD;部分缓解(partialresponse,PR):基线病灶长径总和缩小≥30%;完全缓解(completeresponse,CR):所有目标病灶消失。以PR+CR认定为治疗有效,PD+SD为治疗无效。
1.4统计学分析
实验所得数据使用SPSS20.0统计学软件进行数据分析,采用GraphPadPrism7.0软件进行数据的作图。计数资料采用率(%)表示,计量资料呈偏态分布时,用中位数(四分位数间距)表示,并用Wilcoxon符号秩和检验比较。呈正态分布时采用均数±标准差(x±s)表示,两组间比较采用Student’st检验。以P<0.05为差异具有统计学意义。
2.1治疗前VimentinmRNA和AKT1mRNA的表达水平乳腺癌组VimentinmRNA和AKT1mRNA表达量(2.32±2.17,1.91±0.93)均大于健康对照组(1.22±0.76,1.23±0.83),差异具有统计学意义(t=2.841,2.480,均P<0.05)。
![]()
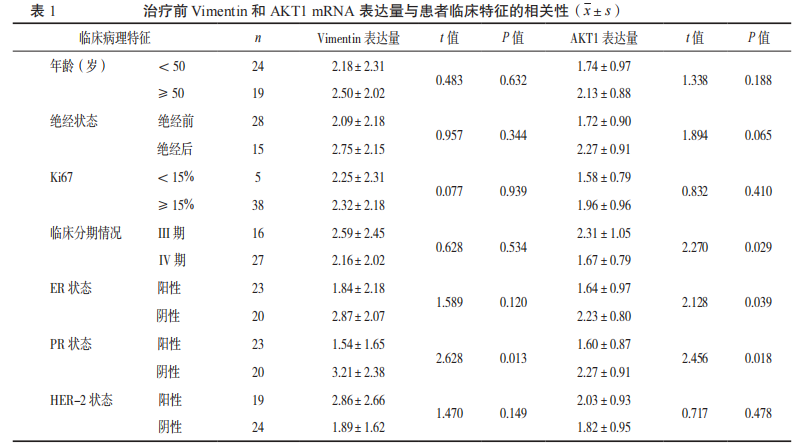
2.2治疗前Vimentin及AKT1mRNA表达量与临床特征的相关性见表1。AKT1mRNA表达量与晚期乳腺癌患者的临床分期、ER状态、PR状态存在相关性(P<0.05),VimentinmRNA表达量与患者的PR状态存在相关性(P<0.05)。
2.3治疗前后VimentinmRNA和AKT1mRNA表达量变化与治疗效果的相关性在接受随访的38例患者进一步复查且根据影像学RECIST1.1标准对其评估治疗疗效。治疗前乳腺癌患者的VimentinmRNA相对表达量为2.32±2.17,治疗后为1.30±0.75,治疗前后差异具有统计学意义(t=2.879,P=0.006);治疗前AKT1mRNA相对表达量为1.91±0.93,治疗后为1.52±0.57,治疗前后的AKT1mRNA表达量差异具有统计学意义(t=2.282,P=0.026)。此外,治疗后VimentinmRNA相对表达量降低的患者其治疗有效率70.37%(19/27),高于治疗后呈现升高者的27.27%(3/11)的治疗有效率,差异具有统计学意义(Pa=0.028,a:Fisher’sexacttest)。
乳腺癌作为女性最常见的一种恶性肿瘤,仅2015年全球因乳腺癌死亡的人数约为50万,占因癌症而死亡人数的14%[7]。CTC作为“液态活检”的良好指标,不仅对患者预后有提示意义,而且可以辅助乳腺癌早期诊断,CTC变化的监测在临床治疗方案的选择等方面同样具有重要的指导意义[8]。有研究指出,CTC上的分子表型可以用于证实肿瘤细胞在尚不明原因的转移性患者中的性质和生物学起源[9]。如ARDAVANIS等[10]的研究证实针对患者组织学检测人表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,HER-2)状态阴性但其外周血中的CTCs表达HER-2阳性的患者,也能从曲妥珠单抗治疗中获益。因此我们需要选取最有潜力的CTC表型标志物作为监测指标。而在本研究选取的CTC两种表型标志物中,Vimentin作为EMT过程中的重要间质型标志物,而AKT1基因则与肿瘤增殖状态相关,最终会增强肿瘤细胞转移的能力,在近年来一直受到关注。
Vimentin是保持细胞完整度的众多中间丝中的一种蛋白质,可参与细胞黏附、迁移和运动。YU等[11]研究发现,乳腺癌患者中的CTC可通过上皮-间质细胞转化进入外周血循环中,因此部分CTC具有间质细胞表型的特征。另外王合兵等[12]人结论表明CK19和Vimentin在早期乳腺癌(I期+II期)中表达相比健康组升高,这与本研究结果中发现的晚期乳腺癌组患者外周血CTC中VimentinmRNA表达量高于健康对照组相似。有学者指出,Vimentin过表达易导致癌细胞的转移并影响患者的预后[13]。本研究通过检测晚期乳腺癌患者治疗前后VimentinmRNA表达量的变化佐证了该观点。我们发现患者在治疗后Vimentin表达量较治疗前有一定的降低,且在治疗后Vimentin表达量降低的患者有更高的治疗有效率(P<0.05),提示我们可通过观察患者治疗前后Vimentin表达量的变化来监测治疗疗效。本研究中另一个CTC相关表型标志物AKT是PI3K/Akt信号途径中的核心成分,与调节细胞存活等多种重要的生物学功能具有相关性,与肿瘤细胞增殖能力有关。目前已有多种针对AKT的小分子抑制剂药物研发,然而也有研究发现抑制AKT1的功能后,反而促进了乳腺癌的转移[14]。值得注意的是,我们发现相比Ⅲ期的局部晚期乳腺癌患者,IV期的转移性乳腺癌患者AKT1mRNA表达量更低。部分学者认为AKT1在乳腺癌的增殖和转移过程中发挥着不同的作用[15-16]。通过激活AKT1可促进肿瘤细胞的增殖,但会抑制肿瘤细胞的侵袭与转移。相反当AKT1功能受抑制而表达下降后,虽然癌细胞的生长受到抑制,但是其转移能力则显著加强。这或许解释了本研究入组的IV期转移性乳腺癌患者其AKT1mRNA表达量更低的原因。此外通过检测患者治疗前后AKT1mRNA表达量,发现治疗后表达量较治疗前有一定的降低,差异具有统计学意义(P<0.05),但并未发现其表达量的降低与治疗疗效之间存在关系。AKT1能否作为一个有效的监测疗效的标志物还有待进一步的研究。

参考文献 :
[1] ANASTASIADI Z, LIANOS G D, IGNATIADOU EA,et al. Breast cancer in young women: an overview[J]. Updates in Surgery, 2017, 69(3): 313-317.
[2]KAHROBA H, HEJAZI M S, SAMADI N. Exosomes: from carcinogenesis and metastasis to diagnosis and treatment of gastric cancer[J]. Cellular and Molecular Life Sciences, 2019, 76(9): 1747-1758.
[3]NAIR V S, KEU K V, KUHN P, et al. Circulating tumour cells in early breast cancer[J]. Lancet Oncology, 2012, 13(9): e370.
[4]BARRIÈRE G, TARTARY M, RIGAUD M. Epithelial mesenchymal transition: a new insight into the detection of circulating tumor cells[J]. ISRN Oncology, 2012,2012: 382010.
[5]JING Yingying, HAN Zhipeng, ZHANG Shanshan, et al. Epithelial-mesenchymal transition in tumor microenvironment[J]. Cell & Bioscience, 2011, 1(1): 29.
[6]ANDRE F, NAHTAR, CONFORTI R, et al. Expression patterns and predictive value of phosphorylatedAKT in early-stage breast cancer[J]. Annals of Oncology, 2008, 19(2): 315-320.
[7]FITZMAURICE C, ALLEN C, BARBER R M, et al . Global,regional,and national cancer incidence,mortality,years of life lost,years livedwith disability,and disability-adjusted life-years for 32 cancer groups,1990 to 2015 a systematic analysis for the global burden of disease study[J]. JAMA Oncology, 2017, 3(4): 524-548.
[8]QI X W,ZHANG F,YANG X H ,et al. Circulating tumor cells predict the clinical efficiency of neoadjuvant chemotherapy for breast cancer patients[J]. International Journal of Gynecological Cancer, 2011, 21(12):S967.
[9]ZHOU Lanlan, DICKER D T, MATTHEW E, et al . Circulating tumor cells: silent predictors of metastasis[J]. F1000 Research, 2017, 6: 1445.
[10]ARDAVANIS A, KOUNTOURAKIS P, KYRIAKOU F, et al. Trastuzumab plus paclitaxel or docetaxel in HER-2-negative/HER-2 ECD-positive anthracycline- and taxane-refractory advanced breast cancer[J]. The Oncologist, 2008, 13(4): 361-369.
[11]YU Min,BARDIAA,WITT NER B S,et al.Circulating breast tumor cells exhibit dynamic changes in epithelial and me sen -chymal composition[J] . Science,2013,339(6619):580-584.
[12]王合兵,肖坚,陈文新,等.外周血细胞角蛋白 -19 和 Vimentin mRNA 在乳腺癌早期诊断中的应用价值 [J].中国肿瘤临床与康复 ,2019,26(5):517-520.
WANG Hebing, XIAO Jian, CHEN Wenxin, et al. Pe- ripheral blood CK-19 and Vimentin mRNA in the early diagnosis of breast cancer [J]. Chinese Journal of Clini- cal Oncology and Rehabilitation,2019,26(5):517-520.
[13]ARUGA N, KIJIMA H, MASUDA R, et al. Epithelial- mesenchymal transition (EMT) is correlated with patient’s prognosis of lung squamous cell carcinoma[J]. The Tokai Journal of Experimental and Clinical Medicine, 2018, 43(1): 5-13.
查看更多