查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





急性Stanford A型主动脉夹层孙氏手术后低氧血症的危险因素分析
作者:柯俊
急性Stanford A型主动脉夹层是极其危险且致命的主动脉急症,临床症状多样,病情轻重不一,早期病死率可高达60%~70%[1] 。主动脉夹层破裂及灌注不良是主要的病死原因,因此一经诊断,应积极行手术治疗。随着心血管外科的不断发展,目前在体外循环下行主动脉弓替换加“象鼻”支架置入术(亦称孙氏手术)[2]已成为急性Stanford A型主动脉夹层常见的手术方式,而术后低氧血症是常见的 并发症,其发生与术前因素[年龄、体重指数(body mass index,BMI)、吸烟、有无肺部基础疾病等],术中因素(体外循环时间、手术时间、机械通气时间、出血输血、应激性高血糖等)[3]相关。本研究纳入的患者术前均未合并肺部的基础疾病,无低氧血症,故可更好地排除因术前即出现的低氧血症而影响术后低氧血症危险因素的探索,且体外循环均由同一团队进行,进一步明确体外循环下行孙氏手术后发生低氧血症的危险因素,从而提出相应的处理策略。
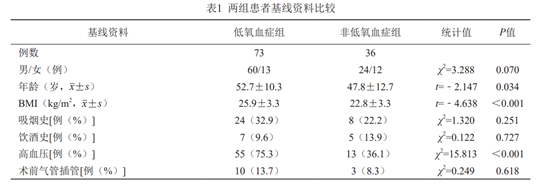
纳入福建省立医院心血管外科2018年1月至2022年1月的急性Stanford A型主动脉夹层患者。纳入标准:①发病14d内累及升主动脉和/或主动脉弓部的主动脉夹层,所有患者均依据主动脉CT血管成像检查明确诊断[4];②符合孙氏手术的手术指征,所有患者及其家属同意手术,签署手术知情同意书;③年龄>18周岁;④患者资料完整。排除标准:①术前有肺部基础疾病患者;②术前出现低氧血症患者;③术中因病情危重台上死亡患者。最终纳入109患者,其中男84例,女25例,年龄21~74岁,平均(51.04±11.29)岁。根据患者是否发生低氧血症将其分为低氧血症组与非低氧血症组,其中低氧血症组73例,非低氧血症组36例。
低氧血症的诊断标准
按照急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS) 柏林标准,在呼气末正压≥5cmH2O或持续气道正压通气压力≥5cmH2O的基础上,将ARDS分为轻度(200mmHg<氧合指数≤300mmHg),中度(100mmHg<氧合指数≤200mmHg),重度(氧合指数≤100mmHg)[5]。在目前的研究中,大多数学者将ARDS的诊断标准之一氧合指数≤200mmHg作为术后低氧血症的定义[6-8]。由于研究的为急性Stanford A型主动脉夹层患者术后发生低氧血症的影响因素,避免因术后其他因素对研究的影响,本文将研究时间范围定义在术后送入重症病房6h内[9]。
手术方式及观察指标
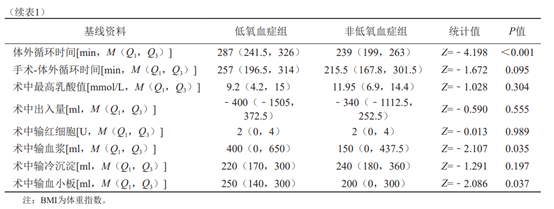
所有患者均接受体外循环下行亦称孙氏手术。患者全身肝素化后常规建立体外循环,转流、降温、阻断升主动脉、灌注心脏停跳液。首先,进行近心端操作即冠状动脉开口移植、主动脉瓣成形或替换、主动脉窦重建、主动脉根部替换。当鼻咽温度降至l8~20℃时,停体外循环,改选择性脑灌注。切除主动脉弓,降主动脉置入直径28~32mm“象鼻”支架,吻合4分支人工血管远端与胸降主动脉,再依次完成左锁骨下动脉、左颈总动脉、无名动脉近端与带分支人工血管的吻合,将4分支人工血管近端与升主动脉做端端吻合。排气,开放升主动脉,心脏复苏,完成手术。术后均送至ICU密切监护治疗。采集信息的方式为查阅病历,记录所有患者的病史资料、临床资料、影像资料及术中资料,统计两组患者的性别、年龄、体重指数(body mass index,BMI)、吸烟史(有、无)、饮酒史(有、无)、合并高血压(有、无)、术前是否气管插管、体外循环时间、手术-体外循环时间、术中最高乳酸值、术中出入量、术中输血量(红细胞、血浆、血小板、冷沉淀因子)。
应用SPSS25.0统计软件进行数据分析。使用Kolmogorov-Smirnov检验评估连续变量分布的正态性,符合正态分布计量资料以(x±s)形式表示,组间比较采用独立样本t检验;非正态分布资料采用中位数及四分位数间距[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验;分类资料以例(%)表示,组间比较采用χ 2 检验。将单因素分析差异有统计学意义的变量,引入多因素Logistic回归分析模型,分析术后低氧血症发生的危险因素。P<0.05为差异有统计学意义。
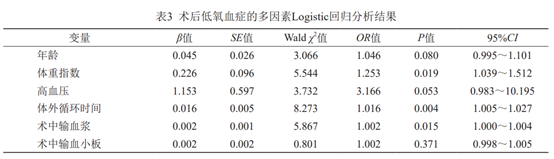
109例患者中73例术后出现低氧血症,发生率为66.97%。比较两组患者的基线情况,单因素分析结果示年龄(P=0.034)、BMI(P<0.001)、高血压病史(P<0.001)、体外循环时间(P<0.001)、术中输血浆量(P=0.035)、术中输血小板量(P=0.037)差异有统计学意义,性别、吸烟饮酒史、高血压病史、术前是否气管插管、手术-体外循环时间、术中出入量情况及术中输注红细胞、血小板、冷沉淀因子等,差异无统计学意义(P>0.05),详见表1。将上述各变量纳入Logistic分析(赋值情况见表2),结果显示BMI(OR=1.253,95%CI:1.039~1.512,P=0.019)、体外循环时间(OR=1.016,95%CI:1.005~1.027,P=0.004)、术中输注血浆量(OR=1.002,95%CI:1.000~1.004,P=0.015)是急性Stanford A型主动脉夹层患者行孙氏手术后低氧血症的独立危险因素(表3)

急性Stanford A型主动脉夹层是极其危险且致命的主动脉急症,早期病死率高,一经诊断,需尽早行手术治疗。急性呼吸功能不全是急性Stanford A型主 动脉夹层术后较为常见的并发症,主要表现为低氧血症,可能与炎症因子释放导致继发性肺损伤,肺间质大量渗出以及肺毛细血管床的减少有关[10]。术后低氧血症的发生会延长患者呼吸机辅助通气时间,延长ICU收住时间,增加医疗费用,严重影响患者的预后。本研究低氧血症的发生率为66.97%,较其他相关研究高,可能与手术创伤大相关。
本研究显示,患者BMI升高是术后低氧血症的危险因素,与其他研究一致[7,11-12]。可能一方面因为肥胖患者胸壁厚,脂肪堆积,胸廓活动受限,肺顺应性下降,呼吸阻力增加,经过手术打击后,更容易出现低氧血症;另一方面因为肥胖患者术后早期生成大量内生水,且生成量与体重呈正相关[11],进一步导致通气血流比例失调;再者肥胖患者脂肪组织因体积膨胀造成血液供应不足,且长时间营养过剩导致慢性缺氧状态,缺氧可刺激释放炎症因子,激活促炎信号通路,故脂肪细胞中有大量炎症因子,进而导致术后低氧血症的发生。本研究中,体外循环时间差异有统计学意义。孙氏手术均需在深低温停循环状态下进行,低温会导致肺顺应性下降,氧弥散能力下降,会激活炎症细胞,组织中酸性代谢性产物增多,且肺组织缺血再灌注损伤,会进一步导致肺泡毛细血管通透性增加,肺间质水肿,肺顺应性进一步下降,从而导致低氧血症的发生[3,13]。有研究表明,术中大量输注库存血是术后低氧血症发生的危险因素[7,14],与本次研究结果一致,可能因为孙氏手术创伤大、渗血多,输血继发炎症反应可诱发肺损伤,且大量输注库存血可能因过敏引起机体免疫反应、微栓子栓塞等增加术后低氧血症的发生。本研究中,对输血成分进行分层分析,结果提示输注红细胞差异无统计学意义,而输注血浆量差异有统计学意义。原因可能因为本院手术过程中自体血回输技术成熟,术中输注库存红细胞少,而自体血回输无法满足血浆的回输,另一方面,由于本研究的局限性(单中心、样本量少)也可能导致结果的偏差,希望后期可扩大调查的范围以得到更有可信度的研究结果。目前患者术前的吸烟病史是否会导致术后低氧血症的发生,不同的研究有不同的结果。有文献表明因香烟中含有尼古丁、焦油、一氧化碳等物质,会影响肺内分泌物排出,增加肺循环阻力,且吸烟患者气道黏膜功能低下,夹层术后大量炎症介质释放,加重肺部损伤[15-16]。但亦有大量研究提示吸烟史与主动脉夹层术后低氧血症无关[9,17-19],本研究中也未发现吸烟史和主动脉术后低氧血症有统计学的意义,这还需要多中心、更大范围的研究进一步地来证实。本研究纳入的患者术前均未合并肺部的基础疾病,术前未出现低氧血症,术前插管的13例患者均是为手术准备的保护性气管插管,故可更好地排除因术前即出现的低氧血症而影响术后低氧血症危险因素的探索。术后低氧血症是主动脉夹层的常见并发症,其危险因素受多种因素的影响,仍需更大量前瞻性、高质量的研究进行分析。基于本次研究结果,建议日后术中应尽可能缩短体外循环时间,尽量完善血液保护措施,避免过度输血,以降低术后低氧血症的发生。
[1] 肖亚茹, 黄素芳. 主动脉夹层过早死亡的研究进展[J]. 内科急危重症杂志, 2018, 24(4):337-339.
[2] 孙立忠, 刘志刚, 常谦, 等.主动脉弓替换加支架“象 鼻”手术治疗Stanford A型主动脉夹层[J]. 中华外科 杂志, 2004, 42(13):812-816.
[3] 林丽珠, 张炳东. A型主动脉夹层术后低氧血症的研究 进展[J]. 海南医学, 2018, 29(15):2152-2155.
[4] ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering actue and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The task force for the diagnosis and treatment of aortic diseases of the european society of cardiology(ESC)[J]. Eur Heart J, 2014, 35(41):2873-2926.
[5] RANIERI VM, RUBENFELD GD, THOMPSON BT, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23):2526-2533.
[6] GIRDAUSKAS E, KUNTZE T, BORGER MA, et al. Acute respiratory dysfunction after surgery for acute type Aortic dissection[J]. Eur J CaRdiothorac Surg, 2010, 37(3):691-696.
[7] WANG Y, XUE S, ZHU H. Risk factors for postoperative hypoxemia in patients undergoing Stanford A aortic dissection surger[J]. J Cardiothorac Surg, 2013, 8(1):118-124.
[8] KURABAYASHI M, OKISHIGE K, AZEGAMI K, et al. Reduction of the PaO2/FiO2 ratio in acute aortic dissection—relationship between the extent of dissection and inflammation[J]. Cire J, 2010, 74(10):2066-2073.
[9] NAKAJIMA T, KAWAZOE K, IZUMOTO H, et al. Risk factors for hypoxemia after surgery for acute type A aortic dissection[J]. Surg Today, 2006, 36(8):680-685.
[10] 中国医师协会心血管外科分会大血管外科专业委员 会. 主动脉夹层诊断与治疗规范中国专家共识[J]. 中 华胸心血管外科杂志, 2017, 33(11):641-654.
[11] AIZAWA K, SAKANO Y, OHKI S, et a1. Obesity is a risk factor of young onset of acute aortic dissection and postoperative hypoxemia[J]. Kyobu Geka, 2013, 66(6):437-444.
[12] 于子翔, 潘旭东, 董松波, 等. 急性A型主动脉夹层孙 氏术后低氧血症的相关因素分析[J]. 心肺血管病杂 志, 2018, 39(6):711-715.
[13] 宋辛叶, 栾永. 体外循环心血管手术后低氧血症的诱 因及预防进展[J]. 山东医药, 2017, 57(13):104-106.
[14] SHENG W, YANG HQ, CHI YF, et a1. Independent risk factors for hypoxemia after surgery for acute aortic dissection[J]. Saudi Med J, 2015, 36(8):940-946.
[15] 宋先荣, 程兆云, 刘富荣, 等. 急性A型主动脉夹层术 后低氧血症的相关因素分析[J]. 中华胸心血管外科杂 志, 2015, 31(5):286-289.
[16] 陈军, 魏翔, 胡敏, 等. 急性Stanford A型主动脉夹层孙 氏手术后呼吸功能不全的治疗[J]. 华中科技大学学报 (医学版), 2015, 44(5):567-571.
[17] 叶津池. 急性Stanford A型主动脉夹层围手术期低氧 血症危险因素分析[D]. 南京: 东南大学, 2015.
[18] 孙舸. Standford A型夹层术后并发低氧血症的危险因 素分析[D]. 大连: 大连医科大学, 2013:1-38.
[19] 鞠帆, 刘楠, 潘旭东, 等. Stanford A型主动脉夹层术后 重度低氧血症风险预测模型的探索[J]. 中华医学杂 志, 2016, 96(13):1001-1006.
查看更多