200
评论
查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2月19日,国家药监局官网显示,君实生物特瑞普利单抗注射液(拓益)新适应证(注册分类:2.2)获批,用于治疗既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)。这是特瑞普利单抗获批的第2个适应证。
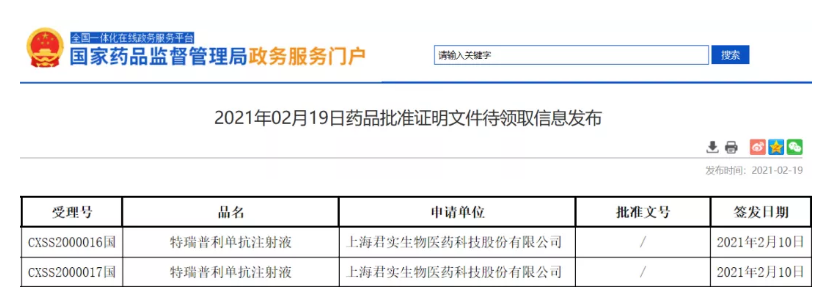
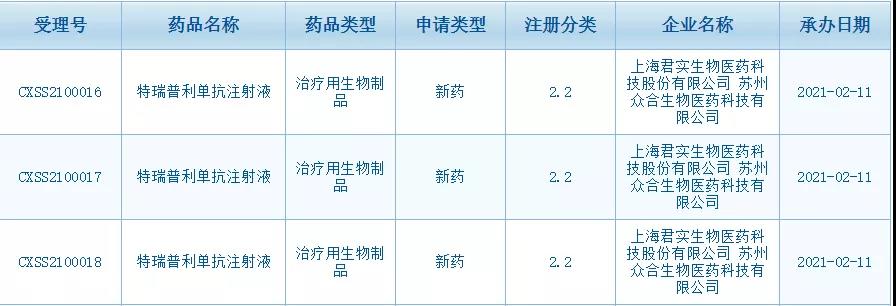
此外,据君实生物发布的公告显示,特瑞普利单抗联合化疗用于未接受过系统治疗复发转移性鼻咽癌一线治疗的适应证上市申请也已于2月11日获得国家药品评审中心(CDE)受理。
特瑞普利单抗是中国首个批准上市的以 PD-1为靶点的国产单抗药物,2018年12月17日,特瑞普利单抗获得国家药监局有条件批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗,并获得 2019 年和 2020 年 《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南》推荐。
特瑞普利单抗三线治疗复发/转移性鼻咽癌,以及二线治疗转移性尿路上皮癌的新适应证上市申请分别于 2020年4月和2020年5月获得国家药监局受理。2020年7月,上述两项新适应证上市申请已被国家药监局纳入优先审评程序。2020年12月,特瑞普利单抗注射液成功通过国家医保谈判,被纳入新版医保目录。
2020年9月,特瑞普利单抗用于治疗复发/转移性鼻咽癌获得FDA突破性疗法认定。目前,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤领域获得FDA授予1项突破性疗法认定、1项快速通道认定和3项孤儿药资格认定。
中国医学论坛报综合整理自国家药监局官网、君实生物公众号
查看更多