查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





播散性组织胞浆菌病在本栏目既往疑难病例中曾有提及,有兴趣的读者可翻看2014年的相关病例。本次介绍这个病例,主要是想和大家讨论一下如果播散性组织胞浆菌病严重到触发了噬血细胞性淋巴组织细胞增生症(HLH),如何处理才更合理。是否需要使用地塞米松?是否需要用环孢素和依托泊苷?虽然这个病例只是个例,但其中的曲折值得大家一起琢磨探讨。
作者:复旦大学附属华山医院感染科 王睿莹 杨飞飞 顾剑飞 刘红 王新宇 张继明
病史简介
主诉
患者男性,30岁,公交车司机,安徽省安庆人。发热伴畏寒寒战、三系下降1个月。
现病史
患者自2018年5月1日起,无明显诱因出现发热,体温最高40 ℃,无明显规律性,伴有畏寒、寒战。发热时无头痛、头晕,无胸闷痛、气促,无恶心、呕吐,无腹痛、腹泻等情况。
5月2日
患者就诊于当地医院,查血常规示白细胞(WBC)2.53×109/L,中性细胞百分比(N%)73.9%,红细胞(RBC)3.47×1012/L,血红蛋白(Hb)90 g/L,血小板计数(PLT)83×109/L。
尿常规蛋白质(+),大便潜血(+)。
血生化示白蛋白(ALB)27.2 g/L,甘油三酯(TG)1.5 mmol/L,丙氨酸氨基转移酶(ALT)59.4 U/L,天门冬氨酸氨基转移酶(AST)84.5 U/L,碱性磷酸酶(ALP)494 U/L,γ-谷氨酰转肽酶(γ-GT)101U/L。
降钙素原(PCT)2.62ng/ml,血沉(ESR)56 mm/h,铁蛋白>2000 ng/ml。
肿瘤指标示糖蛋白抗原125(CA125)48.57 U/ml。
腹部彩超示“肝脾肿大,胆囊壁毛糙增厚,盆腔积液”。心脏彩超未见异常。予抗感染及对症支持治疗2天(具体不详),无明显好转。
5月4日
患者转诊至上级医院,复查血常规WBC2.35×109/L,PLT 70×109/L,Hb 79 g/L,N% 70.2%。血生化检查结果基本同前。
血疟原虫阴性,血弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒、EB 病毒、结核、肺炎支原体抗体检测均阴性。
计算机体层摄影(CT)示“双肺少许炎症伴双侧胸腔少量积液;左肺上叶小结节;肝右叶钙化灶;胆囊炎;右肾小结石;脾稍大;盆腔少量积液”。
后血培养回报人葡萄球菌人亚种。考虑患者为“血流感染”,给予美罗培南+左氧氟沙星抗感染治疗,症状无明显好转,仍有高热,且出现咳嗽、咳白色黏痰,可咳出。
5月9日
患者转诊至外院血液科,复查血常规及肝功能较前相仿,C反应蛋白(CRP)、PCT仍升高,铁蛋白>2000ng/ml,自身免疫抗体阴性,(1,3)-β-D-葡聚糖检测(G试验)>1000 pg/ml,血培养阴性。
完善骨髓穿刺检查,涂片示“血小板减少伴巨核细胞成熟障碍;全片见少量吞噬功能增强的网状细胞”,骨髓流式细胞学检查未见明显异常,骨髓液45种白血病融合基因及相关基因检测均阴性。
颈部彩超示左侧颈部淋巴结肿大。正电子发射计算机体层摄影(PET)-CT示“①肝脏体积增大,两侧颌下、颈部、肝门部、后腹膜多发肿大淋巴结,均伴葡萄糖代谢增高,考虑血液系统疾病可能,建议行颈部淋巴结穿刺活检;②鼻咽部局部葡萄糖代谢增高,考虑炎症可能;③ 两侧上颌窦炎,两侧胸腔积液;肝右后叶钙化灶,脾大,胆囊结石可能,右肾小结石;腹盆腔积液”。
结合患者病史及辅助检查,考虑“噬血细胞综合征”。先后给予比阿培南、莫西沙星、万古霉素、头孢哌酮他唑巴坦抗感染,激素及免疫抑制剂抗炎(5月15 日予甲泼尼龙40 mg q12h,5 月19 日予甲泼尼龙40 mg q8h,5月22日予地塞米松10 mg q12h,5月25 日予环孢素125 mg bid)及其他对症支持治疗。
患者诉使用激素1周后体温曾转平数天,后再次发热,每日最高体温38℃左右,仍有咳嗽咳痰,且三系仍进行性下降。
5月30日
患者来我院急诊就诊。复查血常规,WBC 0.45×109/L,PLT 15 × 109/L,Hb67 g/L,RBC 2.64×1012/L。
考虑患者诊断为“发热待查,噬血细胞综合征”。给予美罗培南抗感染、卡泊芬净抗真菌,人免疫球蛋白20 g qd、地塞米松15 mg qd、白蛋白10 g qd 等抗炎及对症支持治疗。
5月31日
为进一步明确发热原因,将患者收入我科住院。入院前诊疗概况见图1。

患者患病以来精神不好,萎靡,胃纳差;睡眠好,大小便正常,有体重明显下降,自发病以来体重下降约10 kg。
既往史
患者既往体健。2018年3月曾因腹泻就诊于当地医院,查血常规未见异常,行胃镜检查结果显示浅表性胃炎,行肠镜检查结果显示炎性息肉,于当地医院住院治疗后症状好转。余无特殊。
体格检查
患者体温35.6℃,脉搏78 次/分,呼吸19 次/分,血压118/60 mmHg,身高170 cm,体重65 kg。神志清楚,精神萎靡,发育正常,营养好,回答切题,自动体位,查体合作,平车推入病房,全身皮肤及巩膜未见黄染,有肝掌,双侧颈部可触及肿大淋巴结,约0.5 cm×0.5 cm,质地中等,无压痛。
未见皮下出血点,头颅无畸形,眼睑正常,睑结膜未见异常,巩膜无黄染。双侧瞳孔等大等圆,对光反射灵敏,耳廓无畸形,外耳道无异常分泌物,乳突无压痛。
外鼻无畸形,鼻通气良好,鼻中隔无偏曲,鼻翼无扇动,两侧副鼻窦区无压痛,口唇无紫绀,咽后壁可见一溃疡。
双腮腺区无肿大,颈无抵抗,颈静脉无怒张,气管居中,甲状腺无肿大。
胸廓对称无畸形,胸骨无压痛;双肺呼吸音清晰,未闻及干湿啰音。心率78次/分,律齐;腹平坦,腹壁软,全腹无压痛,无肌紧张及反跳痛,肝脾可触及肿大,约肋下5指,质地中等,有叩击痛,肠鸣音3次/分。
肛门及外生殖器未查,脊柱、四肢无畸形,关节无红肿,无杵状指(趾),双下肢轻度水肿。
肌力正常,肌张力正常,生理反射正常,病理反射未引出。
实验室检查
血常规 Hb 66 g/L↓ ,PLT 14 × 109/L ↓ ,WBC 0.41×109/L。
肝功能 ALT 61 U/L,AST 30 U/L,ALP 229 U/L,γ-GT 193 U/L,总胆红素(TBIL) 23.3 μmol/L,乳酸脱氢酶(LDH)554 U/L,ALB 27 g/L。
凝血检查 凝血活酶时间(APPT)34.6 秒,D-二聚体11.94,纤维蛋白(原)降解产物32.1 μg/ml,纤维蛋白原(FIB)2.5 g/L,凝血酶原时间(PT)12.2秒,国际标准化比值1.07。
氨基末端B型利钠肽前体(NT- ProBNP)1114pg/ml。甘油三酯(TG)1.97mmol/L。
肾功能、电解质、血糖、心肌酶谱、心肌标志物及尿便常规基本正常。
感染相关检查 人类免疫缺陷病毒(HIV)检测、快速梅毒血清反应素试验(RPR)、乙肝三对半、血结核感染T细胞斑点试验(T-SPOT.TB)、血隐球菌乳胶凝集试验均无明显异常。CRP 71.5 mg/L↑,ESR 24 mm/h,降钙素原2.11 ng/ml。G 试验388.18 pg/ml↑。
肿瘤标志物 CA125 35.29 U/ml ↑ ,CA199 4.75 ng/ml↑,神经元特异性烯醇化酶(NSE)24.29 ng/ml↑。
免疫相关检查 自身抗体、抗可溶性抗原、抗中性粒细胞胞浆抗体、抗心磷脂抗体均阴性。铁蛋白>2000 ng/ml。补体C3 0.724 g/L ↓ ,C4 正常。血免疫球蛋白IgG18.5 g/L↑,IgM 0.35 g/L↓。血λ-轻链2.33 g/L↑,尿-κ-轻链44.1 mg/L↑,尿-λ-轻链36.5 mg/L↑。淋巴细胞亚群六项:自然杀伤细胞(NK)+2.84%↓,余正常。血免疫固定电泳无特殊。
辅助检查
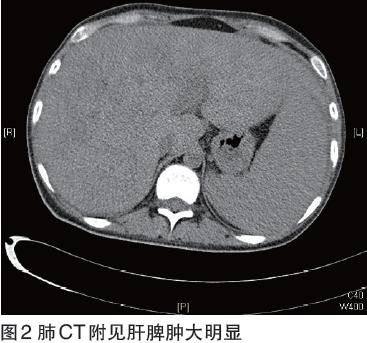
肺CT双肺少许炎症伴双侧胸腔积液,心包积液,建议随访;附见肝脾肿大,结合临床及其它检查(图2)。
B 超肝脾肿大。盆腔少量积液。胆囊为餐后表现。胰腺、脾脏、双肾、双侧输尿管、膀胱、后腹膜未见明显异常。左侧颈中部部分淋巴结形态较饱满。右侧颈部、双侧锁骨上、双侧腋下、双侧腹股沟区未见明显异常肿大淋巴结。
临床关键问题及处理
问题1患者发热伴三系进行性下降,噬血细胞综合征诊断是否成立?考虑由什么原因引起?
噬血细胞性淋巴组织细胞增生症概念及分类
噬血细胞性淋巴组织细胞增生症(HLH)简称噬血细胞综合征,是由失控的免疫反应过度激活引起的疾病,临床上相对少见,但死亡率较高。
根据引起HLH 的原因不同可分为原发性和继发性两种类型。
原发性HLH 多在出生后1 年内出现,部分可有相应的家族史,常常由NK 和T 细胞脱颗粒介导的细胞毒作用相关的基因突变引起。
继发性HLH 是指在无已知基因突变的情况下出现的HLH,多在合并EB病毒感染或其他类型感染,成人斯蒂尔(Still)病、系统性红斑狼疮等风湿性疾病,恶性肿瘤包括淋巴瘤和急性白血病等情况下发生。
HLH的特点及诊断标准
HLH 患者的临床表现和实验室检查以极端的炎症反应为特点,主要表现为高热、肝脾肿大、显著的全血细胞减少、高LDH水平、高铁蛋白以及高甘油三酯。
目前公认的HLH 诊断标准由国际组织细胞协会制定,符合两条标准中任何一条时,HLH的诊断即可成立(表1)。

本患者HLH诊断是否成立?考虑由什么原因引起?
本患者病程中持续高热、肝脾肿大明显,血常规三系下降明显,铁蛋白>2000 ng/ml,外周血淋巴细胞亚群分析NK细胞比例明显降低,基本符合HLH诊断标准。
考虑患者既往体健,为成年发病,继发性HLH可能性大,感染或淋巴瘤引起不能除外。
为此,入院后重复行血培养检查,回报示大肠埃希菌及屎肠球菌。
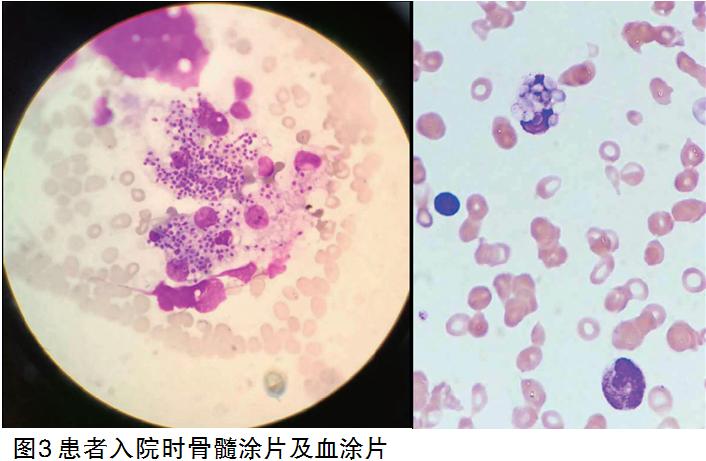
次日再次行骨髓穿刺,完善骨髓涂片、外周血涂片、骨髓流式细胞学、骨髓培养、骨髓二代测序等检查。骨髓穿刺当日追踪涂片结果(图3),提示“骨髓象增生减低,以粒系、巨核系为著。骨巨噬细胞及中性粒细胞均可见吞噬大量病原体,以巨噬细胞最多见”,外周血可见中性粒细胞吞噬病原体。后骨髓流式细胞学检查回报未见明显异常,骨髓活检示“10余个髓腔,造血细胞约占40%,巨核细胞易见,各系造血细胞未见明显异常,请结合临床。网状染色(-)”,均无淋巴瘤及其他血液系统肿瘤依据。
同时,借外院首次骨穿涂片重新阅片,同样可见巨噬细胞吞噬大量类似病原体。
综上,考虑患者噬血细胞综合征为感染诱发的可能性大。
关键问题2 本患者考虑何种病原体感染?需与哪些感染性疾病鉴别?进一步诊疗方案如何制定?
本患者感染何种病原体?
患者骨髓涂片见巨噬细胞内吞噬大量病原体,为卵圆形、直径2~4 μm真菌孢子结构,周围可见清晰荚膜结构;借阅患者外院骨穿涂片,镜下见相同病原体。
结合患者临床病史,符合组织胞浆菌病感染特点。
鉴别诊断
该诊断应与以下可引起发热、肝脾肿大,且骨髓涂片能发现相应病原体的感染性疾病进行鉴别。
疟疾 属于蚊媒传播疾病,由疟原虫属引起,包括间日疟原虫、卵形疟原虫、三日疟原虫和恶性疟原虫。发病前多有明确的疫区旅行史及蚊虫叮咬史。临床特点为周期性发热,有3天或4天的周期,取决于感染的亚种。患者常常畏寒、寒战,继而高热,紧接着出现大汗,伴有关节疼痛,剧烈头痛,严重贫血和反复呕吐。慢性感染者可见脾脏和肝脏扩大。恶性疟原虫可引起脑出血,导致全身抽搐,昏迷和死亡。外周血涂片或骨髓涂片可在红细胞内发现疟原虫。其镜下特点表现为:经吉姆萨或瑞氏染色后疟原虫核染红色、胞质染蓝色;除环状体时期外,在胞质中都有棕褐色的疟色素;被寄生的红细胞出现红色点状物。
黑热病 又称利什曼病,分为内脏利什曼病和皮肤利什曼病两种类型。该病主要流行于印度、东非、南美洲等地区,在我国西北与西南一些省份亦有流行。其中引起内脏利什曼病的病原体为杜氏利什曼原虫,白蛉为其媒介昆虫,主要通过雌性白蛉叮咬传播。感染后患者可出现长期不规则发热伴畏寒、寒战、肝脾肿大、进行性贫血、肤色加深、淋巴结肿大及消耗症状。少部分病例急性起病。骨髓涂片或淋巴结、脾脏穿刺液经吉姆萨染色镜检,可见细胞质呈蓝色,细胞核和动基体呈紫色的无鞭毛体。
球孢子菌病 为地方性流行病,流行于美国西南部、墨西哥、中美洲、南美洲沙漠地区或气候干燥地区。流行区外的散发病例多有流行区旅行生活史或接触过来自流行区的污染物品史。致病菌球孢子菌为双相真菌,感染后多数表现为良性、自限性急性呼吸道感染,少数呈慢性播散型感染,可累及皮肤、肺、骨骼、脾脏、骨髓、脑等器官。临床标本直接涂片镜检可见圆球形、厚壁、直径20~200 μm、不出芽、内含直径2~5 μm孢子的球囊。沙氏葡萄糖琼脂培养基(SDA)25℃培养2~7 天可见有菌丝、白色绒毛状菌落,逐渐变为灰白色,中央有丛状菌丝。培养物涂片可见分枝、分隔的菌丝,有关节菌丝和大量长方形桶状关节孢子,关节孢子间有间隔。
马尔尼菲篮状菌感染 该病为艾滋病患者最常见的机会性真菌感染之一,但近年来也不乏免疫正常者感染的病例报告。其临床表现包括发热、皮疹、体重减轻、皮肤及软组织脓肿、肝脾肿大、淋巴结肿大等。皮肤、骨髓、肺、肝等多个器官可受累。马尔尼菲篮状菌为双相真菌。25℃或室温时SDA培养基菌落生长快速,呈短绒状,随菌龄增长,菌落可变成灰粉色到棕色,而37℃培养则生成粗糙、奶油色的酵母样菌落。人体来源标本镜下检查可见球形或椭圆形酵母样细胞(2~6 μm),呈裂殖而不是芽殖,或形成腊肠细胞或长方形的关节孢子菌,同时可见大量短的菌丝体。血培养涂片可见有隔真菌丝。
进一步完善检查
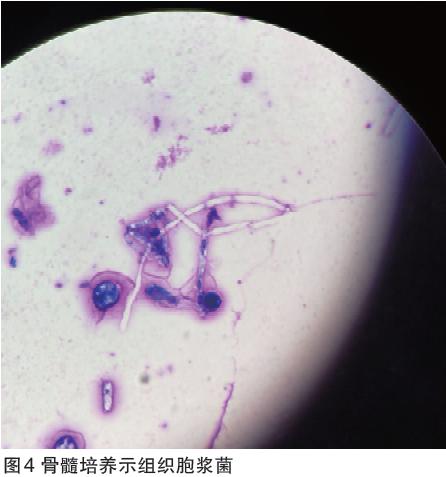
我们进一步完善外周血疟原虫涂片和黑热病血清抗原检测,均为阴性。最为重要的是,对该患者进行血、尿组织胞浆菌抗原检测,结果均回报阳性;骨髓液及血浆二代测序(表2)示荚膜组织胞浆菌,序列数分别为5646条及190条;我院首次骨穿骨髓液培养(真菌瓶)3周后亦回报阳性结果,镜下鉴定为组织胞浆菌(图4)。
最终诊断
至此,患者诊断完全明确,考虑为“组织胞浆菌病;血流感染;噬血细胞综合征”。
治疗方案
基于上述分析,在患者入院后我们立即调整治疗方案:停环孢素,并逐步停用丙种球蛋白,地塞米松予减量,抗感染方案调整为“ 美罗培南(1.0 g q8h)+ 万古霉素(1.0 g q12h)+伊曲康唑(200 mg qd)”静脉使用。即使我们迅速准确地对患者病情做出了综合判断,患者的后续治疗过程仍是一波三折(图5)。
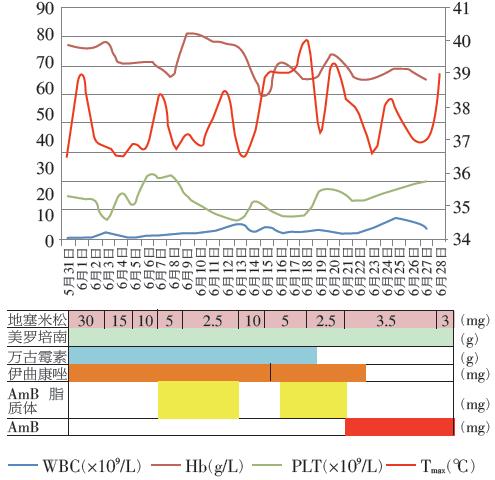 图5我院治疗0~4周患者治疗方案调整及血象、体温变化
图5我院治疗0~4周患者治疗方案调整及血象、体温变化
治疗1 周左右随访,患者血常规无明显改善,在激素继续减量的同时,于6月6日起加予两性霉素B(AmB)脂质体联合抗真菌治疗(6月6日10 mg qd,6月7日20 mg qd,6月8日起30 mg qd)。
6 月11 日复查血常规,血小板仍进行性下降,仅为9×109/L,且肝功能损害较前加重,ALP 428 U/L↑ ,γ-GT 267 U/L ↑ ,TBIL 39.5 μmol/L↑,直接胆红素20.4 μmol/L ↑ 。
考虑到两性霉素B脂质体的肝毒性及骨髓抑制作用,6 月12 日起暂予停用。同时患者D-二聚体升高明显,并出现皮肤瘀点瘀斑,存在噬血综合征基础上合并慢性弥散性血管内凝血(DIC)可能,故加予低分子肝素抗凝,地塞米松每日剂量再次加量至10 mg。
后续2天随访肝功能及D-二聚体较前好转,但血常规血小板下降无明显改善,且患者发热症状一度好转后再次反跳。
考虑患者原发病未控制,故于6月15日起再予两性霉素B脂质体抗真菌治疗,并于6月19日换为两性霉素B 脱氧胆酸盐(25 mg qd)静滴治疗,同时停用伊曲康唑。血流感染方面,万古霉素及美罗培南治疗后患者血培养迅速转阴,因患者出现全身皮疹,考虑与万古霉素相关,故于6月17日停用。
然而令人失望的是,经过上述综合治疗20 余日,患者血小板仍维持在(10~15)×109/L无好转,发热症状仍反反复复。不仅患者和家属开始焦虑不安,治疗组里每一位医生也都陷入了沉思。
关键问题3 感染诱发噬血细胞综合征,血象缓解不明显,如何应对?
抗真菌治疗后血象缓解不明显,如何应对?
噬血细胞综合征的治疗目标除原发病的治疗外,应尽快抑制危及生命的过度炎症反应。根据国际公认的HLH-2004治疗方案,往往需糖皮质激素、依托泊苷(VP-16)、环孢素A等多种免疫抑制剂与丙种球蛋白的联合使用。该患者噬血细胞综合征虽由组织胞浆菌感染诱发,但经过充分抗真菌治疗,血象缓解极为缓慢,此时是应启动特异性免疫抑制治疗方案还是继续加强抗真菌治疗呢?
正在我们对患者的抗真菌治疗方案及效果心存疑虑,对下一步治疗一筹莫展时,检验科顾剑飞老师精心制作的一张趋势图让我们重拾信心:患者外周血涂片吞噬病原体的中性粒细胞数比例明显下降(图6)。

此时复查血二代测序结果也显示组织胞浆菌序列数明显下降,由病初的190条降至治疗3周时的8条。
6月28日抗真菌治疗4周时复查骨穿,骨髓涂片吞噬病原体数量明显减少,多以残存空荚膜结构为主。骨髓液二代测序序列数降至100条。
而回归床旁,体格检查时患者肿大的肝脾回缩明显,由病初肋下5指缩至肋下2指。这些证据都在告诉我们,患者抗真菌治疗有效,总体病情正在好转。
下一步治疗方案
因此后续我们继续给予患者两性霉素B抗真菌治疗及美罗培南抗感染治疗,激素亦逐步减量至每日2~4 mg。
治疗7周时,患者体温基本控制,予停用美罗培南。复查骨髓液二代测序转阴,后续单予两性霉素B抗真菌治疗。
随访患者血常规,三系逐步回升,至治疗10周左右,血常规白细胞恢复至(3~4)×109/L,血红蛋白回升至(100~120)g/L,血小板升至80×109/L。患者一般情况恢复良好,于8月底停用两性霉素B,换用伊曲康唑静脉治疗数天,病情无反跳。8月31日出院(图7)。
出院及转归
患者自出院后遵医嘱口服伊曲康唑(200 mg q12h)及甲泼尼龙(8 mg qd)治疗。甲泼尼龙逐渐减量,服用至2018年10月底停药。伊曲康唑口服3月,11月下旬因恶心呕吐等不良反应自行停用。
2018年9月底及11月底分别入院复查,血常规除PLT略低(80×109/L)外其余基本恢复正常,骨穿涂片偶可见吞噬空荚膜巨噬细胞。患者自停用伊曲康唑后未再服用抗真菌药物,于当地定期监测血常规,已逐步恢复正常。电话随访,目前病情稳定,无复发。
文献回顾及诊疗体会
2015 年, 汤森(Townsend) 等报告了2003-2013年间收治的11例组织胞浆菌病诱发的HLH 病例,其中6 例为免疫低下患者(5 例HIV 感染及1 例肾移植)。在11例患者中,播散性感染占9 例,另外2 例为肺部感染,其中9 例患者接受了两性霉素B脂质体序贯伊曲康唑的抗真菌治疗,1例使用伊曲康唑抗真菌治疗,另1 例抗真菌方案不详。应用免疫抑制治疗情况为,在5 例接受了包括丙种球蛋白、糖皮质激素治疗的患者中,4例死亡,而5例未接受免疫抑制治疗的患者仅1例死亡。
同时该文章总结了既往报告的类似病例27例,在14例接受抗真菌治疗而无额外免疫抑制治疗的患者中,13例生存,1例死亡;6 例接受抗真菌治疗及糖皮质激素或丙种球蛋白治疗的患者中4例死亡;5例未接受抗真菌治疗的患者均死亡;另有2例治疗方案及预后不详。
上述研究提示,对于此类疾病,额外的免疫抑制治疗似乎并不能使患者获益。
2019年4月,《成人噬血细胞性淋巴组织细胞增生症管理建议》发布。该建议特别指出,由胞内病原体例如结核杆菌、利什曼原虫、立克次体等感染引起的HLH往往不需要过强的免疫抑制治疗,其对于特异性抗感染治疗应答良好。
此例患者的成功救治,也恰好印证了这一点,对于组织胞浆菌感染导致的骨髓抑制甚至噬血现象,及时有效的抗真菌才是治疗的重中之重。
背景知识介绍
组织胞浆菌病概述
组织胞浆菌病(Histoplasmosis)是由荚膜组织胞浆菌引起的真菌感染。该菌系土壤腐生菌,鸟粪和蝙蝠粪是重要的病菌载体。通过吸入真菌孢子污染的土壤而引起感染,也可经皮肤、胃肠黏膜感染。人群普遍易感,尤以免疫缺陷者、幼儿、老年患者最为常见。
该病分布多有一定的地域性,主要集中于北美洲及中美洲,是美国中部及东部地区最常见的地方性真菌病。目前在世界许多地区例如欧洲、非洲、东南亚等地都有散发病例存在。我国首例患者系输入性病例,于1955年被发现并报告。后续时有散发病例报告,部分病例为非输入性病例。
组织胞浆菌病临床表现
荚膜组织胞浆菌在免疫正常人群中多引起隐性感染,患者可无任何症状,仅有抗原检测阳性。但对于免疫缺陷或免疫低下患者,可引起单纯急性或慢性肺部感染,甚至出现肺、肝、脾、肾、脑、骨髓、淋巴组织等多器官病变,造成播散性感染。部分病例病情严重,且预后凶险。
组织胞浆菌病的临床诊断
根据流行病学、临床表现及实验室检查等进行综合分析,凡在流行区生活或到过流行区,尤其是近期有密切鸟粪、鸡粪接触史者,出现发热、咳嗽、贫血、肝脾大和全身淋巴结肿大者,须高度怀疑组织胞浆菌病。尤其是有细胞免疫缺陷,例如HIV感染者、免疫抑制剂使用者,应视为高危人群。
疾病确诊主要靠直接镜检、培养及病理检查。
该菌为双相真菌,外周血涂片、骨髓涂片、淋巴结病理或皮损刮取物等经瑞氏染色,在油镜下可见位于单核细胞内或巨噬细胞内圆形或卵圆形、直径2~4 μm孢子,一端较尖、一端较圆,周围有似荚膜的亮圈。
该菌生长缓慢,SDA培养基室温培养2~4周可形成白色或黑褐色绒毛状菌落。37℃时该菌呈酵母样菌落。
血清学检查包括组织胞浆菌素皮肤试验、补体结合试验及抗原检测。其中抗原检测应用较多,可用于流行病学调查、隐性感染人群筛查及治疗反应监测。
组织胞浆菌病的治疗
根据美国感染病学会(IDSA)发布的《组织胞浆菌病患者管理的临床实践指南(2007版)》,对于流行地区高危人群可口服伊曲康唑预防。免疫正常且无症状感染者一般无需治疗。急性或慢性肺部组织胞浆菌病的治疗,首选两性霉素B脂质体或两性霉素B脱氧胆酸盐治疗1~2周,继之以伊曲康唑巩固维持,总疗程12周。对于轻中度播散型组织胞浆菌病,予伊曲康唑治疗1 年;而重度播散型感染患者,应使用两性霉素B脂质体或脱氧胆酸盐治疗1~2 周后,继续予伊曲康唑抗真菌治疗满1年;免疫低下难以纠正的患者可终生维持治疗。个体预后一般与感染严重程度及免疫状态密切相关,在住院患者中该病死亡率约8%左右。
◇翁心华教授点评◇
播散性组织胞浆菌病既可以发生在之前有免疫缺陷的患者中,例如合并HIV感染、移植后状态等,也可以发生在免疫功能正常的人身上。对于重症的播散病例,两性霉素B始终是各个指南的首选推荐,但鉴于两性霉素B的不良反应(血象低和肝肾毒性等),当播散性组织胞浆菌病合并有HLH时,患者既有三系下降,又有明显的出血和继发感染,还有肝功能受损和黄疸,在这种情况下,临床医生可能对于是否继续坚持使用两性霉素B会产生犹豫。但一旦明确了所有症状的源头就是组织胞浆菌感染时,坚持强有力的抗感染治疗辅助以输血制品以及相应支持治疗,才能取得理想的效果。本病例的曲折过程和回顾相关文献似乎都证明了这个观点。
本文来自《中国医学论坛报》华山医院感染病例专版,转载请注明出处
查看更多