查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





阿司匹林(Aspirin),临床应用已超过百年,成为医药史上三大经典药物之一。至今仍是世界上应用最广泛的缓解疼痛、发热和抗炎药。此外,阿司匹林还可以用于预防心脏病、中风甚至某些类型的癌症,因此被誉为“百年神药”。
然而,长期使用阿司匹林常伴随胃肠道副作用,尤其是肠道黏膜损伤,严重时可导致出血或穿孔。数据显示,长期服用者的胃肠道毒性发生率超约60%。尽管质子泵抑制剂等药物可用于减轻胃部损伤,但对肠道损伤的防护效果有限,甚至可能加重肠毒性。
因此,理解阿司匹林肠毒性的深层机制,是预防其毒性的关键。
2025年12月12日,中山大学研究团队在Advanced Science期刊上发表了一篇题为Gut Bacterium Lysinibacillus Sphaericus Exacerbates Aspirin-induced Intestinal Injury by Production of Carboxylesterase EstB的研究论文。
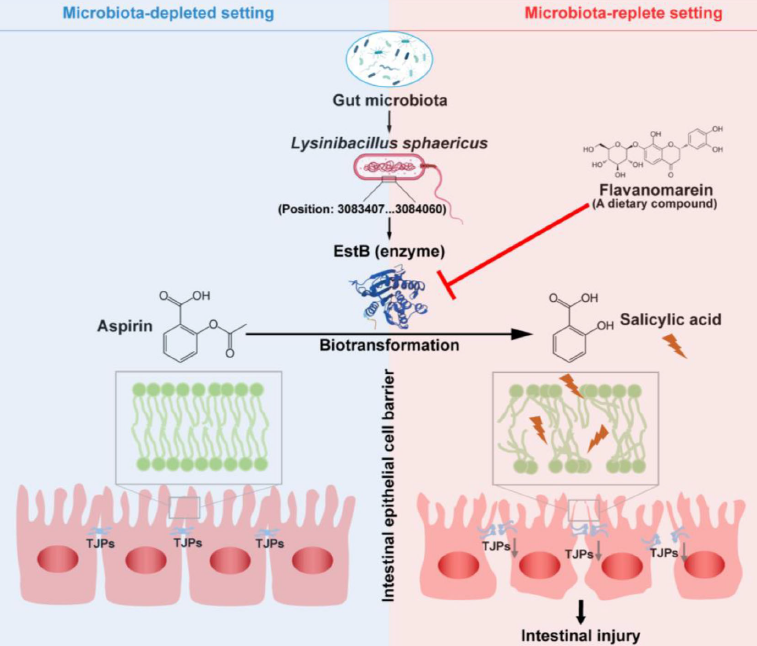
研究结果显示,肠道菌群球形赖氨酸芽孢杆菌(L. sphaericus)通过分泌羧酸酯酶EstB,将阿司匹林水解为毒性更强的水杨酸,从而加剧肠道损伤。
值得注意的是,天然植物黄酮类化合物黄诺马苷(Flavanomarein),可有效抑制EstB酶活性,阻断阿司匹林向水杨酸水解,从而显著减轻肠道损伤。未来,通过调节肠道菌群,有望在保留阿司匹林益处的同时,大幅降低其肠道副作用风险。

图:论文截图
在这项研究中,研究人员通过抗生素清除小鼠菌群,分析了肠道菌群在阿司匹林损伤肠道中的作用,并利用宏基因组筛查进一步确认了关键菌株,在体内外实验中证实了水杨酸毒性,揭示了肠道菌群加剧阿司匹林肠道损伤的新机制。
研究人员发现,与肠道菌群清除的小鼠相比,在肠道菌群完整的小鼠中,阿司匹林引起的肠道损伤更严重,表明肠道菌群在阿司匹林肠毒性中起关键作用。
宏基因组筛查结果显示,球形赖氨酸芽孢杆菌(L. sphaericus)在阿司匹林代谢活跃小鼠中富集,其分泌的EstB酶可高效水解阿司匹林,将阿司匹林水解为毒性更强的水杨酸。
进一步研究结果表明,过表达EstB酶即可重现阿司匹林肠毒性,而敲除或抑制EstB后肠损伤显著减轻。
在体外和动物实验中,与阿司匹林相比,水杨酸对肠道上皮细胞的凋亡诱导、屏障破坏作用更强,证实了水杨酸的毒性更强。
论文机制图(论文截图)
值得一提的是,研究团队还从55万种化合物中筛选出了缓解阿司匹林肠毒性的天然化合物,黄酮类化合物黄诺马苷(Flavanomarein)可有效抑制EstB活性,抑制阿司匹林水解,从而减轻肠道损伤。
在动物实验中,黄诺马苷显著减轻了阿司匹林诱导的肠道组织损伤,提高了上皮细胞活力,增强了肠道屏障功能,并维持了上皮完整性。
研究者指出,传统的观点认为,阿司匹林胃肠道毒性与抑制COX-1相关,但这项最新研究结果揭示了独立于COX-1的全新的机制。未来,通过调节患者肠道菌群或靶向EstB,或可大幅降低阿司匹林肠道副作用风险。
综上,这项研究结果表示,肠道菌群通过分泌羧酸酯酶EstB,将阿司匹林水解为毒性更强的水杨酸,从而加剧肠道损伤。研究人员发现了缓解阿司匹林肠损伤的天然黄酮类化合物,为预防阿司匹林相关肠毒性提供了新策略。

来源:医诺维
查看更多