查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2017年,可谓是细胞免疫治疗年,Novartis的CAR-T产品Kymriah和Kite的Yescarta,分别获批治疗特定类型的急性淋巴细胞瘤和大B细胞淋巴瘤,成为细胞治疗的里程碑事件,极大的促进了细胞免疫治疗的研发热情。
中国医学论坛报社曾有幸邀请了北京大学肿瘤医院淋巴瘤科的应志涛医生、Juno Therapeutics的医学总监Mark J. Gilbert,以及药明巨诺公司的首席执行官James Li,就目前受到广泛关注的CAR-T技术新进展进行了探讨。
先来了解哈,啥叫CAR-T技术?
简单的说,传统CAR-T技术是将自身的T细胞“出口转内销”,将患者自身T细胞取出后,经过体外改造及培养,再把大量靶向性强的效应T细胞回输入患者体内,用来攻击癌细胞。后来又出了一种UCAR-T技术,就是通用CAR-T技术,与传统CAR-T技术不同的是,UCAR-T技术中的T细胞源于健康异体捐献者,通过特有的编辑技术对其进行基因工程改造,同时敲除T细胞的CD52和T细胞受体TCR-α恒定区(TRAC),以免免疫排斥。
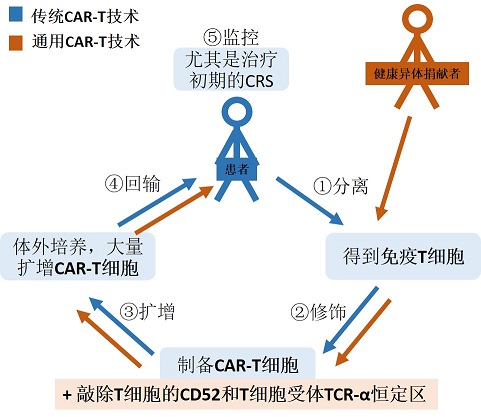
NO.1→ CAR-T技术在实体瘤中的进展,为何不如血液肿瘤“所向披靡”?
作为CAR-T技术的明星靶点,CD19的独特气质,如在B细胞癌症中高表达、是人类正常B细胞发育所必需、不在B细胞谱系之外表达等,将其推上CAR-T治疗的舞台,同时也使得CAR-T技术在B细胞淋巴瘤的治疗中大放异彩。但是在肿瘤的主战场——实体瘤中,CAR-T技术却屡屡受挫。虽然CAR-T技术在实体瘤和血液肿瘤中的原理是一样的,但是因为肿瘤本身特性的限制,效果大相径庭。
以下三个“特性”限制了CAR-T技术“施展拳脚”:
1、靶点问题。一方面,同一肿瘤中可以存在有很多不同的基因型或者亚型的细胞,这样就很难找到一个针对所有肿瘤细胞的免疫靶标,治疗过程中会有“漏网之鱼”,导致预后恶化并增加转移和复发;另一方面,相对特异性的靶标在正常组织也表达,靶向治疗中会有“连坐”反应,引起正常组织损伤。
2、肿瘤微环境。如缺氧、低pH、精氨酸或色氨酸缺乏、肿瘤衍生细胞因子的抑制作用等,还有阻碍CAR-T细胞渗入肿瘤内部的物理屏障,以及通过上调抑制信号发挥免疫抑制作用。
3、归巢效应。如老马识途一般,CAR-T细胞回输后往往都集中到淋巴结中。对于淋巴瘤来说,大部分病灶都在淋巴结,CAR-T细胞的聚集正好有利于和癌变细胞正面抗衡,如果火力足够强,就可以控制局势。但是对于实体瘤来说,病灶主要分布在实质器官而非淋巴结,这时候CAR-T细胞聚集到淋巴结,就仿佛士兵跑错了战场,即使武器再精良,也是鞭长莫及。
2018AACR(美国癌症研究协会年会)也有很多关于免疫治疗技术的最新进展,想了解具体情况,戳链接观看→肿瘤免疫学与免疫治疗
NO.2→ CAR-T技术联合PD-1/PD-L1抑制剂已经有了部分临床数据,由此延伸来看,通过敲除T细胞抑制信号分子PD-1来进一步增强CAR-T细胞的功能,会不会“一劳永逸”?
作为人体免疫系统的免疫检查点,PD-1因为癌症免疫治疗的神奇功效而广为人知。而CAR-T技术与PD-1/PD-L1抑制剂的联合疗法,也取得了不俗的成绩。那么仿佛顺理成章,在CAR-T细胞中敲除PD1等免疫检查点抑制基因,或许可以达到或超过CAR-T+免疫检查点药物的效果呢?
想法看似可行,但现实却很骨感:至少目前对于敲除PD-1的CAR-T试验,还没有非常好的结果报道。并且PD-1作为T细胞的“脚刹”,如果完全拆除这个装置,那么会不会出现“无法降速而车毁人亡”的后果,还需要仔细斟酌。
同时,近期有报道称,PD-1除了阻断肿瘤细胞屏蔽T细胞的PD-1/PDL-1通路以恢复免疫系统对肿瘤细胞的敏感性外,在T细胞中也是控制其自身繁殖的“开关”(见参考文献)。也就是说,PD-1可以在早期阶段关闭缺陷的T细胞,从而防止它们成为肿瘤细胞,比如T细胞非霍奇金淋巴瘤,而这种侵袭性淋巴瘤的治愈率很低。针对这类病人,或许可以通过药物帮助来刺激PD-1信号释放,达到抑制肿瘤细胞的功效。
NO.3→ CAR-T技术在复发性或难治性B细胞淋巴瘤中有良好的结果,那么它是否可以取代淋巴瘤患者的自体干细胞移植呢?
在CAR-T技术推广之前,自体干细胞移植是治疗淋巴瘤的一个较为常用的手段。通常情况下,复发进展的侵袭性非霍奇金淋巴瘤和霍奇金淋巴瘤患者,如再次治疗有效,要尽早考虑大剂量化疗联合自体干细胞移植。但对于自体移植的患者要求较为苛刻,一般要小于60岁且能耐受大剂量化疗。即便如此,由于疾病晚期、原发耐药、移植前肿瘤负荷大等,移植后仍有一定的复发率或其他风险。如果选择异体干细胞移植,那筛选条件更为苛刻,除了要求患者年轻外,找到配型成功的供者也不容易。
自CAR-T技术面世以来,在淋巴瘤的治疗中已经展示出较强的实力。相比干细胞移植在选择患者时的高要求以及移植前的大剂量化疗而限制了其应用,CAR-T技术的适用范围更广,并且处理手段也更为柔和(当然也要注意治疗后早期的细胞因子释放综合征)。虽然目前尚不能说CAR-T技术能够完全取代自体干细胞移植,但是CAR-T技术还处在初期,后劲儿很大,相信一定会有更大的进步。
NO.4→ 因为传统CAR-T技术用的是患者自身的T细胞,所以在一定程度上限制了治疗时间,不少患者不得不等待一个月以上的时间。现在有了UCAR-T技术,是不是可以取代传统CAR-T技术从而缩短等待时间?
通用CAR-T技术的优点显而易见,可以扩大供体来源,缩短了传统(个体化)CAR-T技术中必须要取了患者自身的T细胞后经修饰、培养所耗费的等待时间,让患者能够更加及时的接受治疗,并且在成本控制等方面也具有优势。但是,UCAR-T技术也存在着问题,移植物抗宿主反应(GvHR)和宿主抗移植物反应(HvGR)就是UCAR-T技术的主要障碍,虽然目前看来它的确更便捷、更便宜,并且基因编码技术可以敲除TRAC基因以降低GvHR风险,但是这些风险仍存在,并且目前的机制尚不清楚。所以未来要更加小心和细致的进行研究及临床试验,并且在基因敲除技术上也要进行优化。只能说UCAR-T技术前景非常好,但是何时能够取代传统CAR-T技术,还不能很快下定论。
NO.5→ CAR-T技术在应用过程中,都有哪些时刻“谨记在心”的注意事项呢?
CAR-T技术在国内的发展,也是一波三折,下图展示了国内免疫细胞治疗技术的重要政策变更。
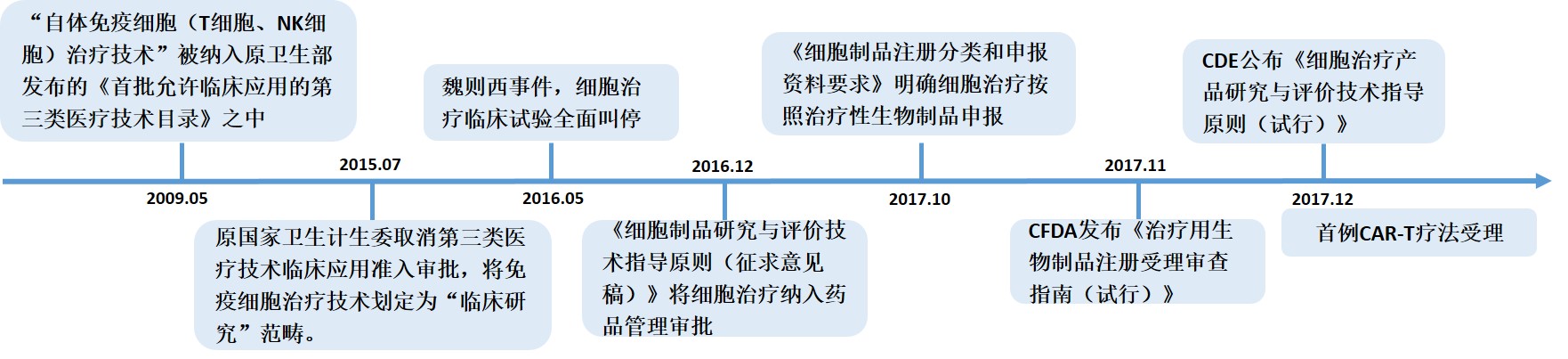
目前而言,医院、企业都可以申请CAR-T的临床研究,但是不论是研究者发起的试验,还是通过CDE申请IND(临床试验研究申请),都应该严格遵守规定,将“CAR-T细胞的生产质量、安全性、临床有效性和风险比重”作为CAR-T技术开发、产品生产以及临床方案设计的基本出发点。最近发布的《细胞治疗产品研究与评价技术指导原则(试行)》,进一步规范了细胞治疗产品的研发,有利于提高CAR-T技术安全性、有效性和质量可控性水平,推动和促进我国细胞治疗领域的健康发展。
拓展阅读:CAR-T试验常见的不良反应有哪些?又该如何应对?
? 细胞因子释放综合征(CRS):是CAR-T治疗最常见的不良反应,反应较为强烈。主要是因为CAR-T在清除肿瘤细胞过程中释放了大量的细胞因子,导致的非特异性的炎症反应。
→ CRS是CAR-T细胞治疗时的常见副反应。临床要求密切观察,及时处理。治疗以对症处理为主,必要时选择输注IL-6R单抗药物阻断免疫系统的激活,严重情况可使用激素(地塞米松等)。也有试验表明,减低剂量的预处理方案可以在不改变原发病治疗效果的前提下降低CAR-T治疗的不良反应。
? 神经系统毒性(NT):是CAR-T细胞治疗另外一个常见的不良反应,机制尚不明确,有研究认为可能与细胞因子的释放相关。
→ 如发生神经系统毒性,可以采用IL-6R单抗药物或者激素处理。
? 脱靶:也是CAR-T技术较为常见的副反应。主要原因是靶标不但在癌细胞表达,在正常细胞也表达。脱靶的后果可能是影响器官的正常功能,严重的可能导致器官功能衰竭。
→ 脱靶暂时没有针对性的应对措施。CAR-T细胞的自杀机制可能是减轻脱靶副作用的方法。比如,正常B细胞和浆细胞都表达CD19抗原,针对CD19抗原的CAR-T细胞治疗后B淋巴细胞缺失就是一种脱靶效应,可以通过补充人免疫球蛋白恢复正常抗感染能力。
感谢北京大学肿瘤医院淋巴瘤科应志涛老师对本文的审阅!
参考文献:
Wartewig T,et al.PD-1 is a haploinsufficient suppressor of T cell lymphomagenesis.Nature. 2017 Nov 15.
查看更多