查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 浙江大学医学院附属第二医院 Lily
免疫化疗时代,DLBCL的治疗现状
一旦难治,预后极差
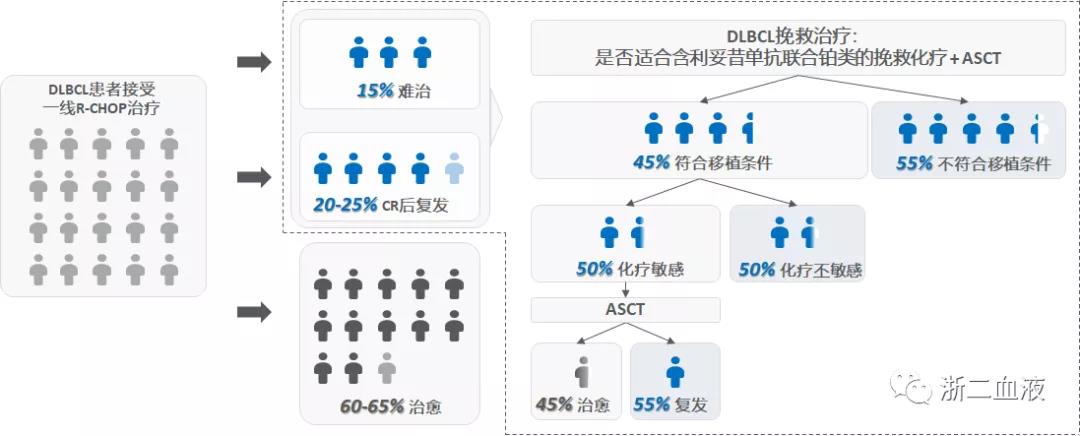
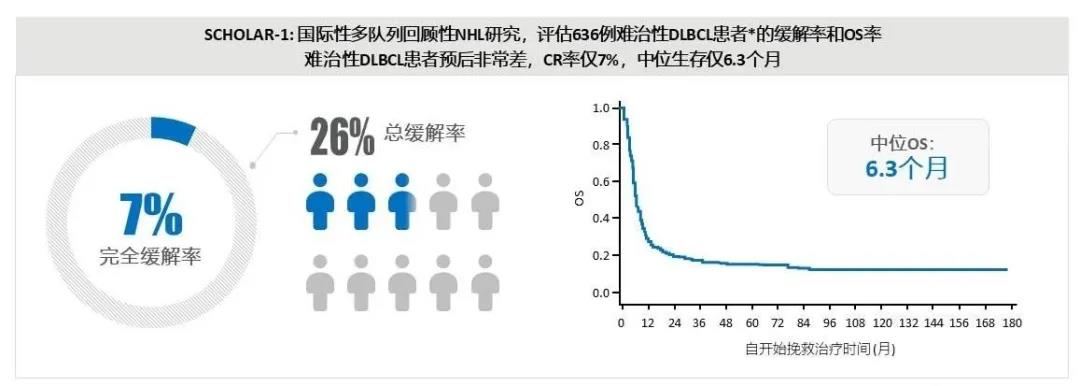
DLBCL 弥漫大B细胞淋巴瘤
免疫化疗治疗失败原因
肿瘤异质性形成了一个含有各种遗传和/或表观遗传修饰的大型肿瘤细胞库,在初始起病时或者在治疗期间均可出现耐药性,从而导致疾病原发难治或者复发。
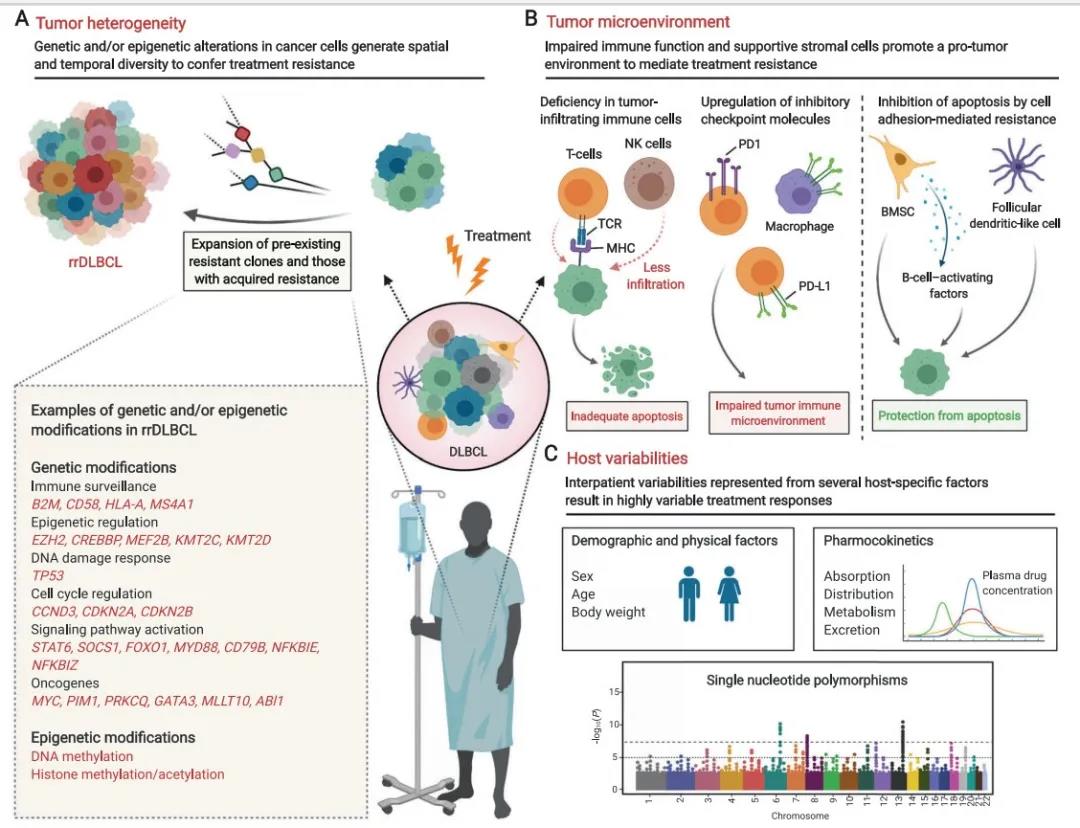
基因修饰
- 免疫监测:B2M , CD58, HLA-A,MS4A1
- 表观遗传调节:EZH2,CREBBP, MEF2B, KMT2C, KMT2D
- DNA损伤:TP53
- 细胞周期:CCND3,CDKN2A, CDKN2B
- 信号通路活化:STAT6,SOCS1,FOXO1,MYD88,CD79B, NFKBIE, NFKBIZ
- 癌基因:MYC, PIM1,PRKCQ, GATA3,MLLT10,ABI1
表观遗传修饰
- DNA甲基化
- 组蛋白甲基化/乙酰化
- 肿瘤浸润导致免疫细胞不足(T细胞和NK细胞),不能充分起到免疫监察作用、而使得凋亡受阻
- 免疫检查点机制
- 肿瘤微环境中的树突状细胞和B细胞活化因子支持肿瘤细胞生长并出现药物抵抗
- 年龄、性别、体能
- 药代动力学因素
- 肿瘤相关基因单核苷酸多态性
DLBCL耐药的分子机制
R-CHOP免疫化疗
R-CHOP是一个非常成功的联合化疗方案,但是很少有详细的药物学研究,对于多药方案耐药的机制仍然未明。Palmer等人采用药理学分析和功能基因组学研究发现方案中的五种药物几乎不存在交叉耐药,提示联合方案的总体疗效是由非重叠耐药机制的活性药物组成。
就单个化疗药物的耐药机制而言,一些研究表明肿瘤micro RNA及其靶点具有潜在作用。例如,下调micro RNA-155可通过上调细胞周期G2/M检查点WEE1导致长春新碱耐药,从而抑制细胞周期蛋白依赖性激酶1活性和有丝分裂。microRNA-34a的高表达与阿霉素的敏感性增加相关,可能是通过下调其靶基因FOXP1实现,这表明microRNA-34a和FOXP1可能在阿霉素耐药机制中发挥作用。
除了肿瘤micro RNA之外,外泌体(exosome)衍生的micro RNA也与化疗耐药有关。在 对116例经R-CHOP治疗的DLBCL患者的血清样本和从经R-CHOP处理的DLBCL细胞上清液中分离的外泌体进行分析时发现,外泌体microRNA-99a-5p和microRNA-125b-5p在耐药组存在上调,其涉及的与耐药相关的靶基因包括:AMP活化蛋白激酶、TGF-β、mTOR和p53信号通路。
通过体外培养R-CHOP耐药DLBCL细胞系发现:干细胞相关转录因子SRY盒2(SOX2)的上调介导了耐药细胞干性增强,同时,在DLBCL复发患者的样本中也观察到SOX2表达增高,进一步机制分析涉及PI3K/AKT信号通路活化阻碍SOX2泛素化降解。
PI3K抑制剂duvelisib与R-CHOP联合使用,可显著抑制异种移植瘤模型小鼠体内耐药肿瘤的增殖。总之,R-CHOP耐药的机制是多种分子和信号通路综合作用的结果。
表观遗传学药物
表观遗传学异常导致的转录调节改变是DLBCL重要发病机制之一,目前研究最多的是翻译后染色体修饰包括DNA/组蛋白甲基化和乙酰化。
甲基转移酶EZH2及乙酰转移酶(CREBBP和EP300)是DLBCL细胞的常见突变,例如,在GCB-DLBCL亚型(~20%)存在的EZH2单个等位基因功能增益(GOF)错义突变(Y641)。组蛋白H3第27位赖氨酸的三甲基化修饰(H3K27me3)高表达导致了增殖抑制(如CDKN1A)或促进分化(如PRDM1)基因沉默。EZH2竞争性抑制剂GSK126和tazemetostat在多种临床前研究中显示出抗增殖和促凋亡作用。
获得性EZH2抑制剂耐药性的产生与胰岛素样生长因子1受体、MEK/PI3K信号通路组成性激活导致FOXO3依赖的促凋亡基因TNFSF10和BAD表达下调相关。
此外,一些研究报道了EZH2获得性新二级突变(如Y111L、Y661D、C663Y和Y726F)通过竞争性与EZH2抑制剂结合,从而恢复DLBCL细胞中甲基化组蛋白的水平导致耐药发生。但是这些耐药细胞对UNC1999(EZH1和EZH2的双重抑制剂)和EED226(一种PRC2抑制剂)仍然保持敏感。
其他表观遗传学药物单药作用有限(如HDACi),有研究提示CDK抑制剂和SRC酪氨酸激酶FGR存在潜在抗HDACi 效应。对于CREBBP突变的DLBCL,HDAC3抑制剂可能有应用前景,有待临床进一步验证。
BTKi
BCR信号传导包括CD79A和CD79B(共同作为BCR信号复合物)、脾酪氨酸激酶(SYK)以及下游PI3K/AKT/mTOR、NF-κB信号通路。
BCR信号通路的持续活化存在于DLBCL,尤其是ABC亚型,促进基因转录及克隆性B细胞存活和增殖。BTKi如伊布替尼可以阻断BCR依赖的NF-κB持续活化,已在ABC亚型的DLBCL,尤其是具有MYD88L265P和CD79B突变的MCD亚型中显示优异的临床疗效。
BTKi在DLBCL中的获得性耐药涉及几种基因突变,例如,伊布替尼结合位点BTK(BTKC481S)481位半胱氨酸-丝氨酸错义突变。这种突变不仅削弱了伊布替尼与BTK形成共价键从而降低药物效力,而且还通过分泌促生存和炎症细胞因子(包括白细胞介素-6(IL-6)和IL-10)重新激活ERK1/2信号,以促进ABC-DLBCL细胞的存活。
KLHL14作为一种肿瘤抑制因子可以增加BCR亚单位泛素化,其缺失通过促进MYD88-Toll样受体9-BCR超复合物形成导致MCD-DLBCL中NF-κB信号通路的持续激活,并对伊布替尼产生耐药性。最近的一项研究进一步揭示,对伊布替尼的获得性耐药与代偿性上调的PI3K/AKT信号和降低的BTK水平有关。
rrDLBCL的临床研究同样发现了几种基因突变导致BTKi耐药的假定机制,包括CARD11的GOF、NFKBIE的LOF、TNFAIP3的LOF和IgH-IRF8易位,这些都可能增强NF-κB信号通路的持续激活。
PI3K/AKT/mTOR通路抑制剂
PI3K/AKT/mTOR信号在控制细胞存活和增殖中起重要作用,DLBCL中同样存在PI3K/AKT/mTOR信号通路的异常激活,SYK或PI3K抑制剂可以抑制AKT活性, 未磷酸化FOXO1核内浓度增加,从而抑制该信号通路。
PI3K/AKT/mTOR信号抑制剂的耐药机制涉及趋化因子CXCR4,当用SYK或PI3K抑制剂处理BCR依赖性DLBCL细胞系时,可以通过激活核FOXO1在转录和蛋白表达水平上调CXCR4,作为SYK/PI3K阻断的代偿信号。
雷帕霉素类似物(依维莫司和替西罗莫司)是mTOR复合物1(mTORC1)抑制剂,在rrDLBCL中总有效率(ORR)为28~30%,中位无进展生存(PFS)期为2.6个月。其耐药机制包括mTORC2诱导的AKT选择性激活、mTORC1下游抑制效应物真核翻译起始因子4E结合蛋白1(IF4E-BP1)的不完全激活、负反馈环路的激活以及细胞旁途径。
双重mTORC1/2抑制被证实可以克服mTORC1抑制的抵抗,发挥强大的体外抗肿瘤作用。但一项II期临床研究表明,双重mTORC1/2抑制剂vistusertib并未显示优效性。
BCL-2抑制剂
导致DLBCL中BCL-2蛋白高表达的机制包括易位(46%的GCB-DLBCL和5%的ABC-DLBCL),拷贝数增加和/或扩增。选择性BCL-2抑制剂venetoclax在临床前研究中被证实有高效的抗淋巴瘤效应,但是真正临床结果却并不满意,单药rrDLBCL的ORR仅为18%,这种药物抵抗可能是由于多种抗凋亡信号激活而导致。
DLBCL存在多个抗凋亡的BCL-2家族成员过度表达,例如:在耐venetoclax的DLBCL细胞系中检测到BCLxL和MCL-1上调;在navitoclax(新BCL-2抑制剂)耐药的细胞株中同样存在抗凋亡BCL-2相关蛋白A1和MCL-1表达上调,联合MCL-1抑制剂可恢复耐药细胞对navitoclax的敏感性。
免疫检查点阻断剂
免疫检查点PD1和PD-L1在DLBCL的发病机制中参与免疫逃逸,但单药疗效不佳。一项Ib期研究显示纳武利尤单抗对rrDLBCL的中位PFS期7周,ORR 36%,II期临床试验ORR更低,这些rrDLBCL患者的PDL1和/或PDL2畸变的频率和幅度较低,可能与低应答率和对PD1药物抵抗相关。KEYNOTE-013试验表明,存在PD-L1(拷贝数增加、扩增和/或易位)的rrDLBCL患者对PD1抗体的ORR显著升高(67% 对 8%)。
CAR-T治疗
CD19-CAR-T治疗rrDLBCL的CR率在40-50%之间,获得CR的患者有望在3年内获得长期缓解。
抗原丢失(CD19和或CD22)和抗原点突变与CAR-T治疗的失效相关。另一方面,当靶抗原可以通过替代机制生存时也可能发生耐药,如抑制MEK、SRC、JAK或钙调神经磷酸酶信号可抵抗CAR-T细胞杀伤作用。CAR-T细胞耗竭的潜在机制包括T细胞抑制因子的升高、干扰素信号通路和循环髓样抑制性细胞的增加,以及CD8+ T细胞耗竭。
原发耐药中起关键作用的是细胞死亡受体基因表达的减少,导致肿瘤细胞抗原持续存在,进而损伤T细胞功能。特别是TNFRSF10B基因,其表达与TP53存在负相关,死亡受体信号的这种异质性可能直接导致了临床治疗中出现CAR-T治疗的原发耐药。
有效管理DLBCL的耐药
逆转DLBCL的治疗耐药关键在于尽可能提升靶向药物/免疫治疗的有效性。
根据DLBCL基因型,将患者进行分层管理,预测患者的治疗获益,选择合适的治疗方案;
对于治疗缓解的定期检测和风险评估(如ctDNA),相应调整患者处理方案,以防止潜在耐药发生;
积极主动出击克服耐药发生,可以参照众多的临床前和临床研究评估靶向治疗、表观遗传治疗、免疫治疗和/或免疫化疗的新组合,以增强治疗缓解和克服耐药;
表观遗传药物的增敏效应和肿瘤微环境的再认识为克服DLBCL治疗耐药提供治疗的新靶点和新途径。
预测性靶标
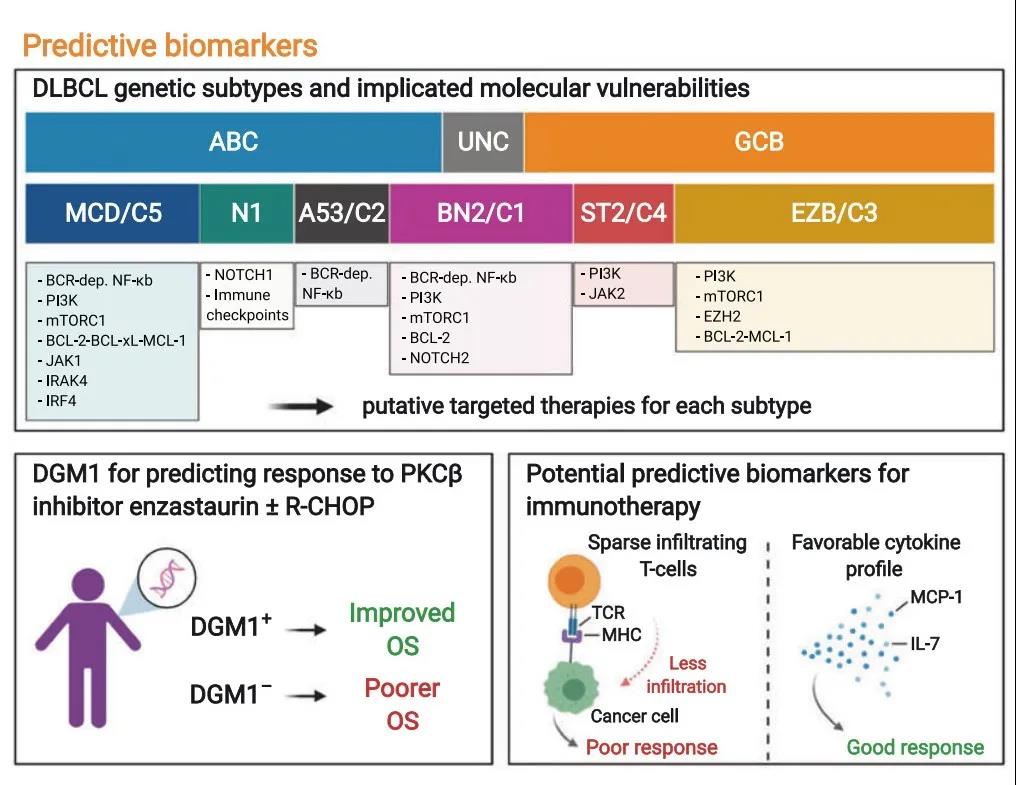
GCB-和ABC-DLBCL的COO亚群已被证实对不同药物具有不同的缓解率,如ABC亚型对BTKi、来那度胺和硼替佐米有较高的应答。rrDLBCL中,伊布替尼单药治疗ABC亚型的ORR为37%,GCB亚型ORR为5%,此外,ABC亚型中存在BCR突变(CD79b突变)患者ORR 56%,合并有MYD88突变患者ORR提升至80%。
种系多态性基因(DGM1)已证实与PKCβ丝氨酸苏氨酸激酶抑制剂Enzastaurin的高缓解率密切相关。一项随机、双盲、安慰剂对照、多中心、Ⅲ期ENGINE研究探索了Enzastaurin联合R-CHOP与单独使用R-CHOP的疗效和安全性,研究结果显示,DGM1阳性患者,R-CHOP联合Enzastaurin具有显著的生存优势。
DLBCL可以招募异质的T细胞亚群形成(肿瘤)免疫微环境,TME中T细胞浸润程度可以预测免疫治疗的疗效。此外,与淋巴细胞耗竭相关的单核细胞趋化蛋白-1(MCP-1)和IL-7也是CAR-T治疗疗效的预测性生物靶标。
动态预后评估
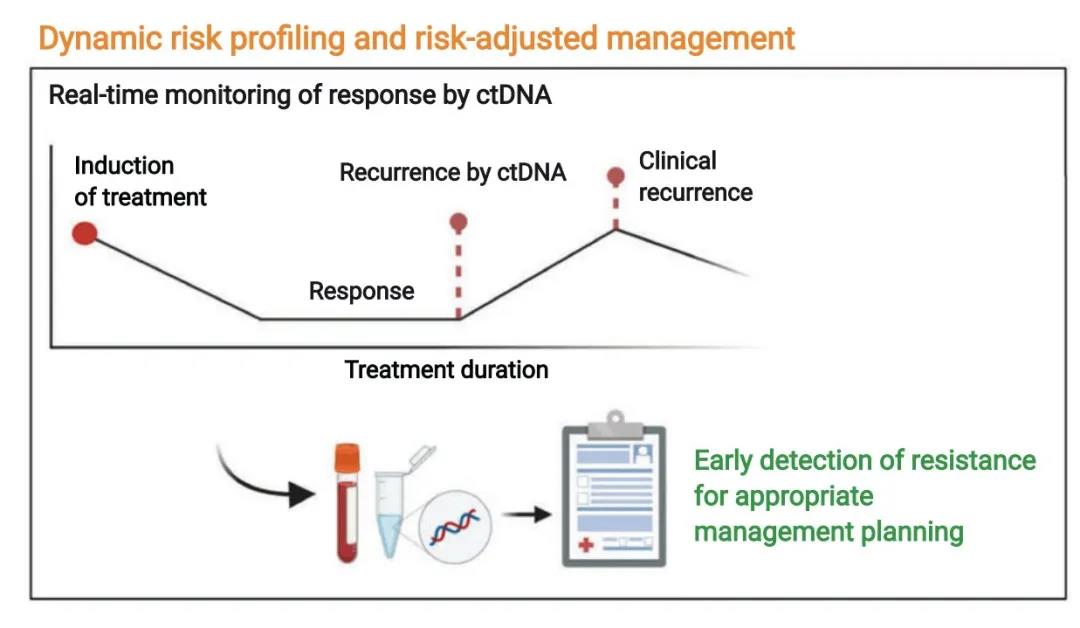
患者对治疗效果的监测对于耐药的早期干预非常重要,传统方式(如影像学测量肿瘤大小和病灶活检)有其滞后性。无创性的液体活检技术(ctDNA)可以尝试用于DLBCLD 动态监测,包括肿瘤异质性、克隆进化和治疗缓解。Kurtz等结果显示,DLBCL患者在初始/挽救性治疗一个周期后ctDNA水平下降2-log具有更好预后。提示在治疗的早期就可以精确地进行预后分层,有助于后续治疗的选择。
新型药物联合的治疗策略
合理的联合治疗是克服DLBCL治疗耐药的重要策略。
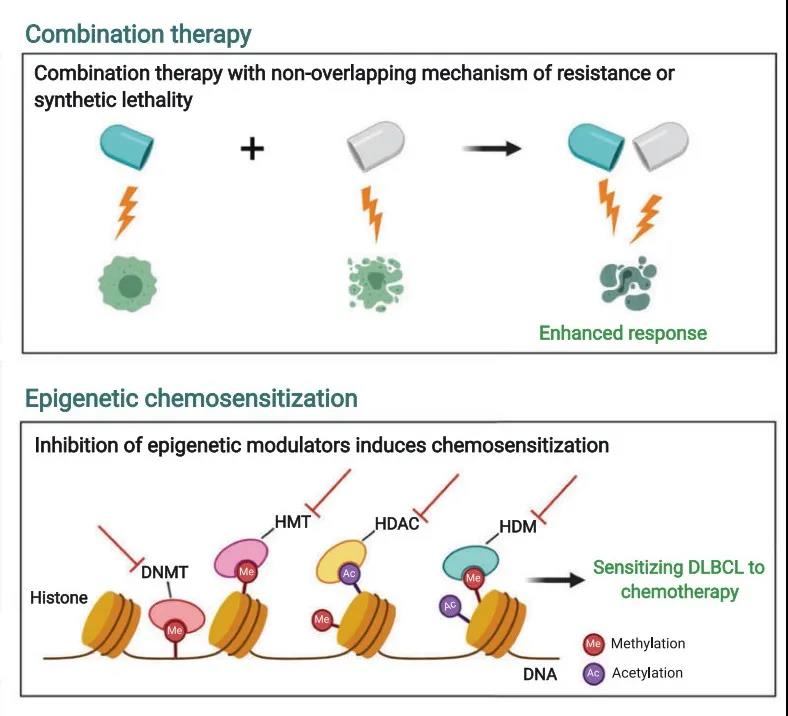
表观遗传药物被证实有化疗增敏效应。DNA甲基转移酶(DNMT)抑制剂地西他滨在体外可以抑制DLBCL细胞的生长并且可以增强阿霉素对化疗敏感株的抗肿瘤效应。在化疗耐药细胞系及异种移植小鼠中,地西他滨单药可诱导细胞被动衰老及出现衰老表型并使细胞对阿霉素重获敏感,进一步的机制分析,SMAD1甲基化受抑与地西他滨化疗增敏相关。两个I期试验也证实:R-CHOP之前应用阿扎胞苷诱导后具有化疗增敏作用。
此外,KDM6B可以导致组蛋白H3上的三甲基赖氨酸27(H3K27)去甲基,诱导BCR依赖性BCL-6下调,增强DLBCL细胞系对化疗药物(长春新碱和阿霉素)的敏感性。HDAC/组蛋白甲基转移酶抑制剂,可以与利妥昔单抗和阿霉素协同干扰DNA修复、细胞周期和诱导凋亡。
重塑肿瘤微环境
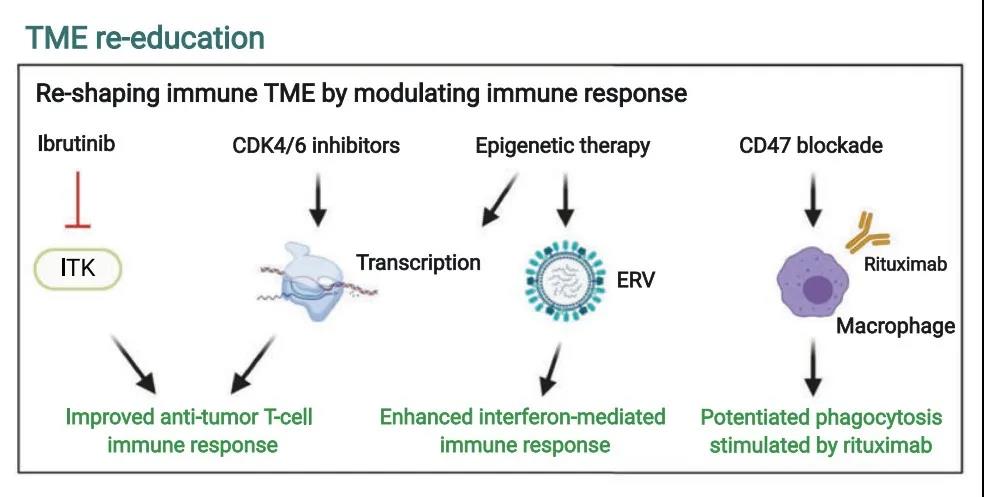
由于TME中浸润的免疫细胞和基质细胞在遗传学上相对稳定,不易受到典型耐药机制(突变)影响,同时遗传稳定性所导致的低异质性、靶向TME在DLBCL治疗策略中的地位越来越受到重视,近年来通过免疫调节重塑TME成为肿瘤治疗的热点。
BTKi(伊布替尼)除了直接的抗淋巴瘤作用外,也是一种ITK抑制剂,具有免疫调节作用。ITK是非受体性蛋白酪氨酸激酶Tec家族成员之一,是辅助性T细胞2(TH2)生存的一种必需酶,伊布替尼可以调节TME中TH1–TH2细胞的平衡,在淋巴瘤动物模型中可以增强TH1介导的抗肿瘤免疫反应。伊布替尼联合PD-L1阻断剂可提高淋巴瘤异种移植瘤小鼠的存活率,其机制与增强抗肿瘤T细胞免疫反应有关。相类似,CDK4/6抑制剂也可以增加PD1阻断剂的T细胞活性,在转录水平增强T细胞活化和体内抗肿瘤免疫反应(IL-2和γ干扰素水平升高)。
利妥昔单抗介导的巨噬细胞吞噬作用在 non-GCB亚型的DLBCL细胞株、异种移植瘤小鼠模型和DLBCL患者中可以增强免疫检查点CD47吞噬作用。许多表观遗传药物,例如DNMT、EZH2和HDAC抑制剂,可以通过激活被抑制的内源性逆转录病毒(ERVs)向TME分泌Ⅰ型和Ⅲ型干扰素,通过增强抗肿瘤免疫反应和抗原提呈蛋白(例如MHC Ⅰ类)的表达来提升免疫治疗的疗效。
值得注意的是,这些抑制剂也可能以非ERV依赖的方式发挥作用,例如通过重新激活TH1细胞型细胞因子表达和增加MHC基因表达,将免疫冷TME转变为免疫应答的抗肿瘤状态(例如,EZH2和HDAC3抑制剂分别恢复EZH2突变和CREBBP突变的DLBCL中的MHC Ⅱ类表达),这些研究为表观遗传药物联合免疫治疗提供了理论基础。
总之,新兴的基因组学和表观基因组学研究可以对DLBCL的肿瘤异质性、克隆进化和治疗缓解进行系统分类,分子机制的详尽研究揭示了个体化的耐药机制,并确定新的治疗突破口来增强抗肿瘤效应。这使我们能够探索预防和克服抵抗的潜在战略。随着DLBCL治疗进入了后R-CHOP时代,需要不断探索预防和克服药物抵抗的治疗策略。
浙二血液 平台发布
查看更多