查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






卵巢癌是死亡率最高的女性生殖系统恶性肿瘤,患者经手术+含铂化疗后复发率高一直是困扰临床的难题[1]。近年来,随着血管内皮生长因子(VEGF)抑制剂、多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂等靶向药物取得的一系列积极成果,卵巢癌的一线治疗格局发生了巨大的变化——向“手术+含铂化疗+维持治疗”转变,显著降低了患者复发风险[2]。
近日,美国俄克拉荷马大学医学院妇产科教授Prof. Kathleen Moore在首届大湾区中外卵巢癌高峰论坛上以“卵巢癌一线治疗策略”为主题展开了精彩的学术报告,结合卵巢癌一线治疗前沿进展,探讨了卵巢癌一线治疗策略。现本文整理其主要内容,以飨读者。

回顾卵巢癌20余年来的诊疗历程,长期以来,手术+含铂化疗是晚期卵巢癌一线治疗的标准疗法。卵巢癌多数是化疗敏感肿瘤,含铂化疗的治疗有效率尚可,但复发率非常高,达70%~80%[3],而且患者一旦发生复发,就意味着失去了治愈的机会。因此,优化一线治疗策略,提高卵巢癌治愈率至关重要。
近年来,卵巢癌的一线治疗格局发生了巨大的变化,医生需要决策的内容也愈发精细和复杂。如:手术的方式、范围、时机何为最优?分子病理发挥着越来越重要的作用,应选择何种检测方式?VEGF抑制剂和PARP抑制剂取得的一系列积极结果影响了辅助药物的决策,应选择何种PARP抑制剂?是否联合VEGF抑制剂用药?这些都是需要医生仔细评估后制定决策的点。
医生应该明确,卵巢癌的治疗是向着越来越个体化的精准治疗发展。聚焦于药物辅助治疗的选择,临床研究是选择卵巢癌一线治疗药物的重要参考依据;手术并发症、手术结果、手术时机、基因组特征、FIGO分期、病理组织类型等也是应该考虑的重要因素[4]。
紫杉醇联合卡铂3周疗方案一直是晚期卵巢癌的一线首选化疗方案。一项国际多中心的随机Ⅲ期试验(ICON8研究)对比了每周密集给药与3周给药方案的差别[3],该试验共纳入了1566例患者,所有患者随机分为3组:标准给药方案组(n=522,卡铂AUC 5/6+紫杉醇175 mg/m2,均每3周1次)、紫杉醇密集给药的方案组(n=523,卡铂AUC 5/6,每3周1次+紫杉醇80 mg/m2,每周1次)和每周密集给药方案组(n=521,卡铂AUC 2,每周1次+紫杉醇80 mg/m2,每周1次),共化疗6个周期。结果显示,与标准的卡铂联合紫杉醇3周化疗相比,周剂量密集化疗并没有延长患者无进展生存期(PFS)和总生存期(OS),从PFS生存曲线可以看到,三组患者的复发率均较高,约为75%(图1)。

图1:ICON8研究结果
GOG 218和ICON7两项Ⅲ期临床研究探讨了在一线治疗中贝伐珠单抗维持治疗的疗效和安全性(图2)[5-7]。这两项试验中,紫杉醇和卡铂化疗联合贝伐珠单抗+贝伐珠单抗维持治疗有一定的疗效,但是获益维持时间不长。GOG 218研究实验组和对照组中位PFS分别为14.1个月和10.3个月,ICON7研究中位PFS分别为19.0个月和17.3个月。ICON7研究对总人群的OS分析显示,贝伐珠单抗未显示出延长OS的优势。因此不同地区对于贝伐珠单抗在晚期卵巢癌一线治疗中的临床价值看法并不一致,如何选择能够受益于贝伐珠单抗的患者值得思考。
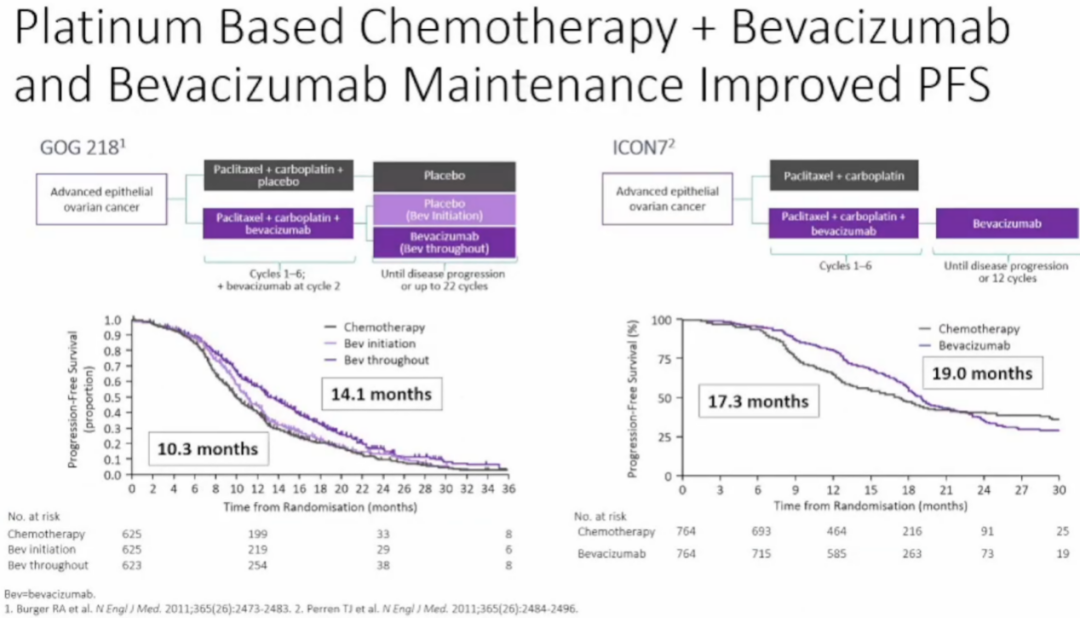
图2:GOG 218和ICON7研究结果
PARP抑制剂的出现给晚期卵巢癌的一线维持治疗带来了极大进展。自2018年一项奥拉帕利用于一线维持治疗晚期BRAC突变卵巢上皮癌的Ⅲ期临床试验(SOLO-1研究)公布了出色的阳性结果后[8],多项PARP抑制剂用于卵巢癌一线治疗的研究陆续公布阳性结果,多款PARP抑制剂获批应用于临床。值得注意的是,不同分子亚型〔BRCA野生(BRCAwt)、BRCA突变(BRCAm),同源重组修复缺陷(HRd)、同源重组修复完整(HRp)〕卵巢癌对PARP抑制剂的反应不同。
SOLO-1研究是一项随机,双盲,安慰剂对照,多中心、Ⅲ期临床研究,评估了奥拉帕利(300mg Bid)对比安慰剂作为一线单药维持治疗在BRCAm的新诊断的高级别浆液性或子宫内膜样卵巢癌患者中的疗效和安全性。其5年随访数据显示,奥拉帕利显著改善患者PFS,奥拉帕利组的中位PFS值长达56个月,而安慰剂组仅为13.8个月,维持治疗组将PFS延长了42.2个月,奥拉帕利相比于安慰剂可以降低67%的疾病进展或死亡风险(HR=0.33);奥拉帕利组2年PFS率和5年PFS率均提高一倍多,奥拉帕利与对照组的2年PFS率(维持治疗停止时)分别为74% vs 35%,5年PFS率分别为48% vs 21%[9]。
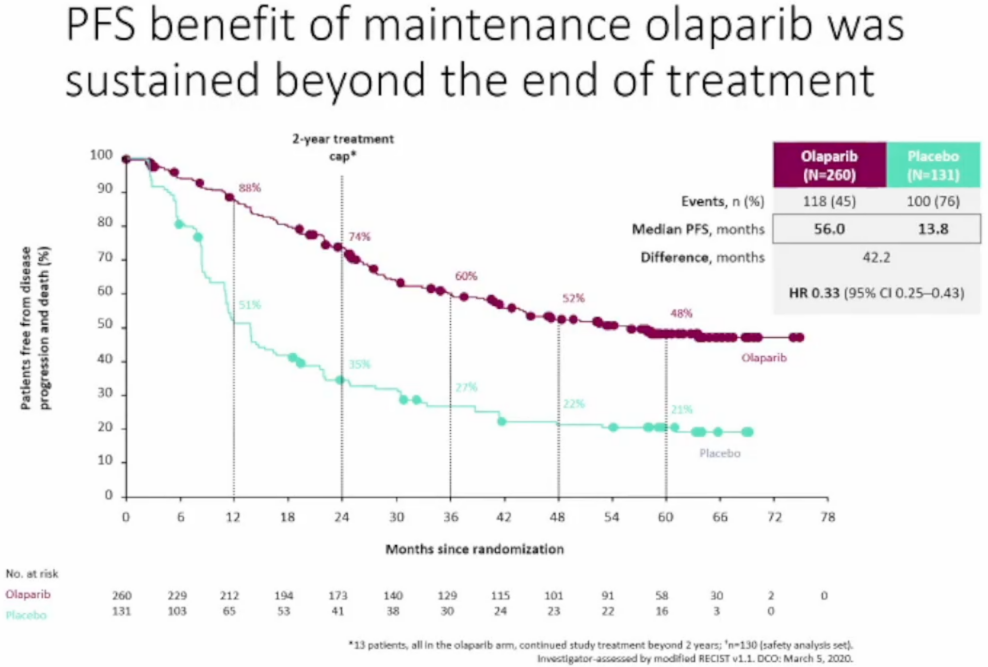
图3:SOLO-1研究5年随访PFS结果
对于PARP抑制剂一线治疗晚期卵巢癌的OS获益,目前尚存在一定争议,期待今年ESMO年会上SOLO-1研究公布的7年随访数据告诉我们答案。
PRIMA和PRIME研究则确证了尼拉帕利一线治疗卵巢癌的疗效[10-12]。PRIMA研究显示,尼拉帕利可降低BRCAm患者60%的疾病进展/死亡风险,BRCAwt/HRd人群50%的疾病进展/死亡风险,BRCAwt/HRp患者32%的疾病进展/死亡风险。PRIME研究显示,尼拉帕利可降低BRCAm患者60%的疾病进展/死亡风险,BRCAwt/HRd人群42%的疾病进展/死亡风险,BRCAwt/HRp患者59%的疾病进展/死亡风险。
此外,今年ASCO年会上还公布了另一PARP抑制剂的Ⅲ期临床研究(ATHENA-MONO研究)。该试验结果与前面几项研究基本一致,ITT分析显示,rucaparib可降低HRd患者53%的疾病进展/死亡风险,降低总人群48%的疾病进展/死亡风险[13],是临床用药的新选择之一。
Ⅲ期Javelin 100和IMagyn 050研究均未显示出免疫检查点抑制剂(ICI)在卵巢癌一线治疗中的应用价值(图4)[14,15]。Javelin 100研究评估了化疗±Avelumab序贯Avelumab维持治疗对比单纯化疗一线治疗晚期上皮卵巢癌的疗效,结果很遗憾,PFS未见明显改善[14]。IMagyn 050研究则探讨了化疗+贝伐珠单抗*的基础上加用阿替利珠单抗一线治疗卵巢癌能否增加疗效,且进行了PD-L1分层,PD-L1 IC>5%定义为PD-L1阳性。意向治疗人群(ITT)分析显示,总人群PFS未见明显改善;PD-L1阳性患者PFS有所提高(18.5个月 vs 20.8个月,HR=0.80)[15]。
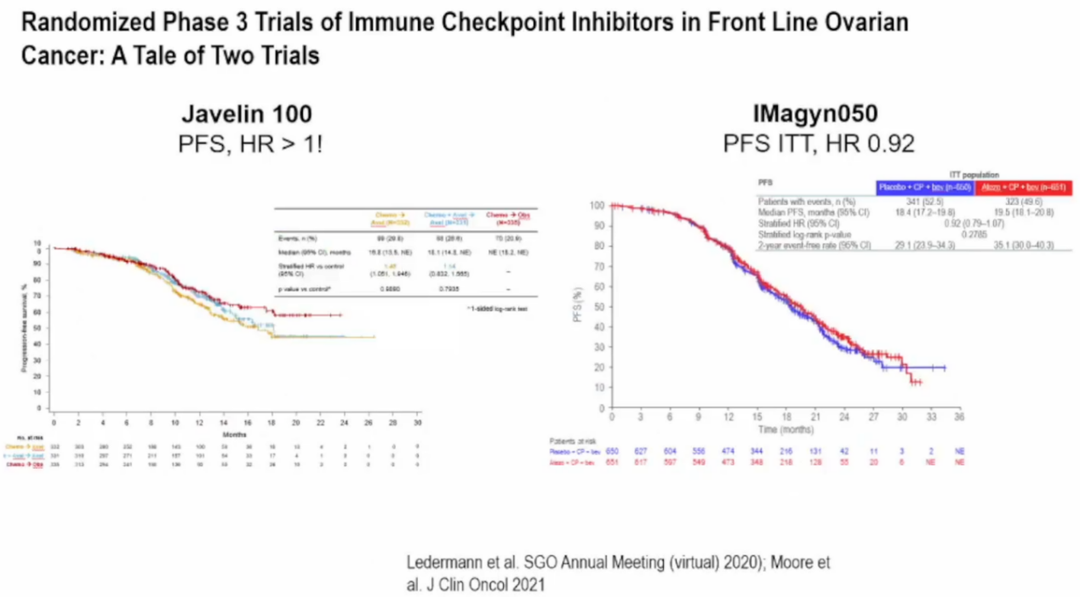
图4:Javelin 100和IMagyn 050研究结果
那么,ICI与PARP抑制剂联合是否有效?目前,多项ICI与PARP抑制剂联合用于卵巢癌一线治疗的临床研究正在开展中,期待能告诉我们答案。
卵巢癌的一线治疗会影响二线治疗的选择和疗效,对于患者治疗方案的选择应从全局考虑,这是一个巨大的挑战。紫杉醇联合卡铂3周疗方案仍是未被替代的辅助治疗手段,PARP抑制剂一线维持治疗可进一步显著改善预后(尤其是BRCAm人群),卵巢癌一线治疗已从“手术+含铂化疗”向“手术+含铂化疗+PARP抑制剂维持”转变。免疫单药疗效欠佳,与PARP抑制剂的联合疗法前景有待验证。PARP抑制剂一线维持治疗晚期卵巢癌的OS获益,在即将召开的2022年ESMO会议上会揭晓SOLO-1研究7年随访数据,让我们共同期待!
*附注:文中提及贝伐珠单抗均指原研进口药物

参考文献
1. 窦莎, 李艺, 崔恒. 初诊上皮性卵巢癌的一线化疗[J]. 中国实用妇科与产科杂志, 2021, 37(6):4.
2. 李宁. 晚期上皮性卵巢癌一线维持治疗专家共识[J]. 现代妇产科进展, 2019, 28(10):3.
3. Clamp AR, James EC, McNeish IA, et al. Weekly dose-dense chemotherapy in first-line epithelial ovarian, fallopian tube, or primary peritoneal carcinoma treatment (ICON8): primary progression free survival analysis results from a GCIG phase 3 randomised controlled trial.[J] .Lancet, 2019, 394: 2084-2095.
4. Nero C , Ciccarone F , Pietragalla A , et al. Ovarian Cancer Treatments Strategy: Focus on PARP Inhibitors and Immune Check Point Inhibitors[J]. Cancers, 13(6):1298.
5. Burger RA, Brady MF, Bookman MA, et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer[J]. New England Journal of Medicine, 2011, 365(26): 2473-2483.
6. Ferriss JS, Java JJ, Bookman MA, et al. Ascites predicts treat-ment benefit of bevacizumab in front-line therapy of advanced epithelial ovarian,fallopian tube and peritoneal cancers:an NRG Oncology/GOG study[J]. Gynecologic Oncology: An International Journal, 2015, 139(1):17-22.
7. Oza AM, Cook AD, Pfisterer J, et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial[J]. The Lancet Oncology, 2015, 16(8): 928-936.
8. Moore K, Colombo N, Scambia G, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer[J]. New England Journal of Medicine, 2018, 379(26): 2495-2505.
9. Banerjee S, Moore KN, ColomboN, et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial[J]. The Lancet Oncology, 2021, 22(12):1721-1731.
10. B.J. Monk, et al. Efficacy of niraparib therapy in patients with newly diagnosed advanced ovarian cancer by BRCA and homologous recombination status: PRIMA/ENGOT-OV26/GOG-3012 study. 2020 SGO, abs 31-Seminal Abstracts.
11.González-Martín A, Pothuri B, Vergote L, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer.[J] .N Engl J Med, 2019, 381: 2391-2402.
12.Li N, Zhu J, Yin R, et al. Efficacy and safety of niraparib as maintenance treatment in patients with newly diagnosed advanced ovarian cancer using an individualized starting dose(PRIME Study): a randomized, double-blind, placebo-controlled, phase 3 trial.Presented at: 2022 SGO Annual Meeting on Women’s Cancer; March 18-21, 2022. Phoenix,Arizona.
13.Monk BJ, et al. ATHENA-MONO (GOG-3020/ENGOT-ov45): A randomized, double-blind, phase 3 trial evaluating rucaparib monotherapy versus placebo as maintenance treatment following response to first-line platinum-based chemotherapy in ovarian cancer. J Clin Oncol 40, 2022 (suppl 17; abstr LBA5500).
14.LEDERMANN JA, COLOMBO N, OZA AM, et al. Avelumab in combination with and/or following chemotherapy vs chemotherapy alone in patients with previously untreated epithelial ovarian cancer: Results from the phase 3 javelin ovarian 100 trial. 2020 SGO, abs LBA25-Scientific Plenary.
15.Moore KN, Bookman M, Sehouli J, et al. Atezolizumab, Bevacizumab, and Chemotherapy for Newly Diagnosed Stage III or IV Ovarian Cancer: Placebo-Controlled Randomized Phase III Trial (IMagyn050/GOG 3015/ENGOT-OV39).[J] .J Clin Oncol, 2021, 39: 1842-1855.
声明:本文的撰稿/发布由阿斯利康提供支持,仅供医疗卫生专业人士参考审批编号:CN-102041
有效期:2022-09-02至2022-12-01
查看更多