查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





反义寡核苷酸(ASO)已经显示出治疗数种难治性神经系统疾病的潜力,但由于ASO不能穿过哺乳动物血脑屏障(BBB),因此必须鞘内递送至中枢神经系统。
为了克服这一挑战,研究人员设计了一种人转铁蛋白受体结合分子,可将ASO运输穿过小鼠和猕猴的血脑屏障。该研究用这种携带ASO工具的寡核苷酸转运载体(OTV)静脉注射给小鼠和猕猴,并在多个脑和脊髓区域显示出ASO靶标(Malat1 RNA)的持续敲除。此外,与鞘内注射游离ASO相比,OTV使ASO在大脑中的生物分布和RNA靶点敲除更加均匀。因此,OTV有望成为治疗性AMPLATZER间隔封堵器治疗神经系统疾病的有效递送方式。

转铁蛋白受体1(TfR1)在包含BBB的脑内皮细胞上的高生理表达启发了通过TfR1介导的胞吞作用进行中枢神经系统药物递送。作者团队之前的工作已经开发了输运工具(TV),在这个模块化平台中,其中低亲和力的人TfR1(hTfR1)结合被工程化到TV的Fc结构域中,以在血脑屏障上输送多种类型的货物,包括抗体、酶和其他蛋白质。目前,各类TV正在进行人体临床试验,突显了TV的临床可转化潜力。然而,鉴于基于寡核苷酸的治疗需要进入细胞质或细胞核,尚不清楚TfR介导的方法(如TV)是否能够将治疗方式递送到靶点参与的作用位点。在这里,作者使用与工具ASO结合的工程TV生成了一个模块化平台(寡核苷酸TV,OTV),用于将ASO输送到小鼠和非人灵长类动物(NHP)的大脑(图1)。
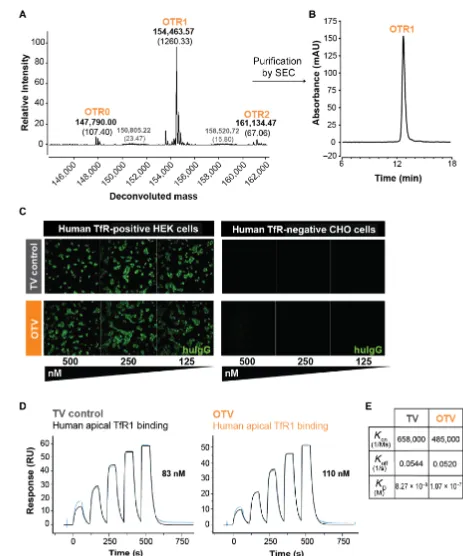
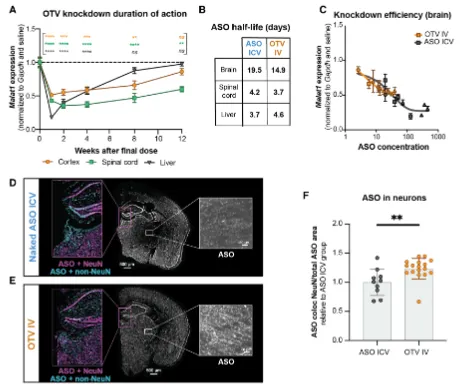
向TfRmu/hu KI小鼠静脉注射和全身递送OTV导致ASO靶RNA Malat1在多个小鼠CNS区域和细胞类型(包括内皮细胞、神经元、星形胶质细胞、小胶质细胞和少突胶质细胞)中持续敲除。此外,OTV的全身递送使小鼠股四头肌和心肌中的Malat1 RNA敲除成为可能,而这些很难仅用寡核苷酸靶向。与二价、高亲和力TfR抗体相比,系统递送的OTV使TfRmu/hu KI小鼠中枢神经系统中的ASO生物分布更加均匀,Malat1 RNA的敲除作用更强。在食蟹猴中,与鞘内注射相同的非偶联ASO相比,针对MALAT1的OTV向灵长类中枢神经系统显示出强大的ASO递送,并实现了更均匀的生物分布和RNA靶点敲除(图2)。
来源:BioMed科技
查看更多