查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





首都医科大学宣武医院神经内科笪宇威教授、郝峻巍教授团队联合山东第一医科大学第一附属医院李晓丽教授在重症肌无力(MG)发病机制研究领域取得重大突破,研究成果——Platelet activation plays a pro-inflammatory role in myasthenia gravis于2025年10月正式发表于国际期刊Nature Communications。
该研究首次系统揭示了血小板通过“血小板-中性粒细胞-CD4+T细胞”轴驱动MG免疫炎症的机制,深入阐明了血小板活化在MG免疫失调中的关键作用及其调控机制,为MG的免疫治疗提供了新的理论依据和潜在靶点。

MG是一种由自身抗体介导的神经肌肉接头传递障碍的自身免疫性疾病,其中约80%~85%的患者为乙酰胆碱受体抗体阳性。尽管其病理机制已较为明确,但驱动自身免疫反应的具体机制尚未完全阐明。近年来,血小板作为连接天然免疫与适应性免疫的关键角色,在自身免疫疾病中的作用日益受到关注。研究表明,血小板可通过表面分子及可溶性因子调节T细胞反应,促进炎症进程。然而,血小板在MG发病中的具体作用及其机制尚不明确。
本研究整合了单细胞转录组测序、批量核糖核酸(RNA)测序、流式细胞术、透射电镜及体外共培养等多种技术,系统分析了来自209例初治MG患者、119例达最小临床表现状态(MMS)患者及114例健康对照者的外周血样本。
通过单细胞测序揭示MG患者血小板比例及脱颗粒相关基因表达上调;通过批量RNA测序识别血小板中免疫激活与代谢重编程相关通路;进一步通过流式细胞术检测血小板活化标志物P-选择素(CD62P)及可溶性CD40配体(sCD40L)水平,评估血小板-白细胞聚集体的形成;并通过体外共培养实验探究血小板与中性粒细胞、CD4+T细胞的相互作用及其机制。
研究发现,MG患者外周血中血小板比例显著升高,且血小板表现出明显的活化表型,包括CD62P表达上调、sCD40L水平升高、形态改变及血小板源性微粒增多。此外,MG患者血小板与中性粒细胞形成的聚集体显著增加,并与疾病严重程度相关。
体外实验进一步揭示,MG来源的血小板可促进中性粒细胞外诱捕网形成,而中性粒细胞及其中性粒细胞胞外诱捕网(NETs)又可反馈增强血小板活化,形成双向激活环路。在适应性免疫方面,MG血小板通过释放调节活化正常T细胞表达与分泌的趋化因子(RANTES)等因子,促进CD4+T细胞增殖及辅助性T细胞1(Th1)分化,同时抑制调节性T细胞(Treg)分化。中和RANTES可显著逆转上述促炎效应。
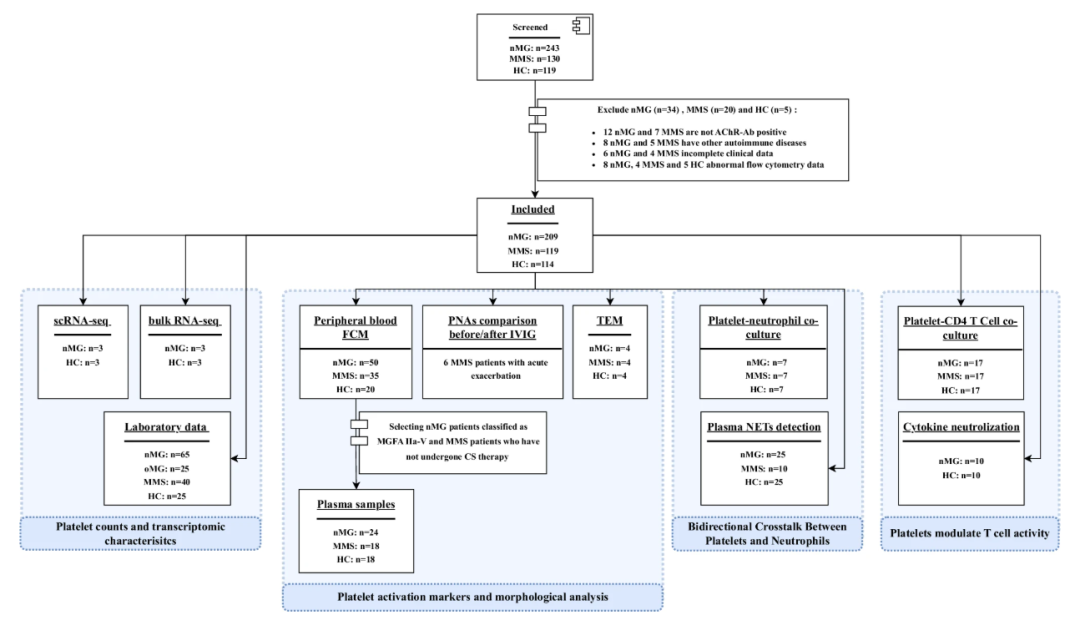
图1 研究设计流程图
图2 MG患者血小板-白细胞相互作用增强
本研究首次系统揭示了血小板在MG发病中的关键作用,明确了血小板通过促进中性粒细胞NETs形成及调节Th1/Treg平衡,参与并放大MG的免疫炎症反应。血小板活化标志物及血小板-中性粒细胞聚集体有望成为评估MG疾病活动及治疗反应的新型生物标志物。针对血小板活化及其介导的免疫调节通路的干预策略,可能为MG的治疗提供新的靶点。
来源 首都医科大学宣武医院
查看更多