查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





随机对照试验(randomized controlled trial, RCT)是临床研究的重要组成部分,合理设计、良好实施并规范报道的RCT临床研究通常可以为疾病的干预和治疗提供最高等级的循证医学证据[1]。然而,许多作者在撰写文章时常常会忽略对RCT临床研究关键信息清晰、完整的描述[2-4]。究其原因,可能是既往对随机对照试验报告统一标准(Consolidated Standards of Reporting Trials, CONSORT)知之甚少,以及不能理解其中具体的要求。这就造成,很多作者在投稿时才注意到杂志有关“上传CONSORT声明”的要求,从而导致文章的大幅修改或是投稿推迟等等。针对以上“虐心”的情景,作者们能不能未雨绸缪,化被动为主动呢?本篇内容我们就来聊一聊如何运用CONSORT 指导RCT论文的撰写。
说到CONSORT的历史,可以追溯到20世纪90年代。1996年,为规范RCT的结果报告,降低RCT研究的偏倚,David Moher和Drummond Rennie教授起草了第1版CONSORT声明[5],该声明在问世后很大程度上规范了RCT研究结果发表,提高了研究论文的质量[6]。近年来,随着临床研究方法学的进展和临床研究实践经验的积累,CONSORT声明不断更新,先是于2001年发表了修订版[7],后又经反复修改确定了2010版[8],这也是目前最新的版本,为进一步提升RCT研究报告的质量奠定了基础。
首先,我们一起来了解下CONSORT声明的整体内容。2010版CONSORT声明包括了含有25项条目的检查表(图1),涉及文题和摘要、背景和目的、方法、结果、讨论和其他信息 6 个部分;该检查表详细阐述了RCT报告撰写时需要遵从的规范,包括对研究原理、试验设计、数据分析、结果陈述和结果解释等的关键说明。此外,CONSORT推荐使用流程图(图2)来展示受试者参与RCT的经过,包括纳入、干预、随机分配、随访和分析信息等不同阶段[9]。
接下来,对照CONSORT检查表,让我们一起在文章撰写过程中“沉浸式”体会CONSORT的核心内容。
在启动论文撰写时,我们通常会先开始主体部分的撰写,也就是研究方法及结果部分。RCT由于其研究设计的特点,方法部分包含的信息较多,如果不对比CONSORT规范,可能会造成信息的遗漏。CONSORT对方法部分的规范项目也是最多的,其中有几点在撰写时需要特别的注意。
首先是有关受试者,需要说明受试者的入排标准。一般来说,典型的入排标准是根据研究疾病的性质和阶段来确定,排除的受试者一般是那些容易受到研究干预伤害的人。此外,还应报告研究地点的数量、类型以及参与研究的医护人员,尤其应清楚报告研究是单中心还是多中心,以便读者能够判断该研究的结果是否对其有用。
其次,方法部分还需注意对随机化方法和统计方法的描述。既然是随机对照实验,清晰描述随机方法有助于读者评估生成随机分配序列中产生偏倚的可能性。可以用来随机分配的方法有很多,如采用随机数字表或计算机随机生成程序。统计方法同样是RCT论文中重要的组成部分,在撰写中需使用专业的统计学术语进行描述,包括用于比较各组主要和次要结局指标的统计学方法及附加分析的方法,诸如亚组分析和校正分析等。
进入到结果部分的撰写时, 第一段一般是描述基线数据,CONSORT推荐用表格的形式展示每一组受试者的基线人口学特征和临床表现。接着,需要详细撰写研究中每个组别的主要疗效指标和次要疗效指标的分析结果,以及不同组别疗效比较的差异值大小(如风险比)和精度(如95%置信区间)。需要注意的是,CONSORT建议报告结果时要完整报告安全性结局,需要阐述不良事件、严重不良事件等,如果整个研究未发生任何不良事件,也应当予以说明;与有效性结果一样,安全性信息的报告会帮助读者判断、理解一项研究的临床意义。
在对研究结果充分报告的基础上,会紧接着进入到讨论部分的撰写。不少作者对该部分的撰写还是很“头疼”的,讨论部分需要作者放眼于整个研究领域的最新进展,来客观审视、评价自己的RCT结果和结论,这对作者自身文献与专业知识的积累要求较高。CONSORT建议,作者可以结合其他相关研究的证据,对结果做出合理的解释和解读;还应讨论研究存在的局限性、潜在偏倚和不精确的原因,以及干预措施的优缺点、适用的对象和临床实践中的可行性。
完成了方法、结果与讨论部分的撰写,至此阶段,文章主体已基本完成,此时带着对整体结果的充分理解及对最新文献的总结与梳理,再进行文章开篇引言部分的构思会事半功倍。
有不少RCT研究报告对于研究的背景及目的的表述是模糊甚至是缺少的。 CONSORT建议在引言部分,重点需要清晰的交待进行此研究的科学背景,充分说明研究的必要性(或提到目前尚缺乏类似研究)和科学意义;需要阐述本研究的科学假说,或者指出本研究的研究目标。清晰的引言部分能够让读者快速、准确的了解该研究的意义。
最后,需要完成标题、摘要的撰写及其他必须披露的信息。在拟定标题时,需使用“随机试验”字眼,以便读者判定研究的属性;对于RCT研究的摘要,CONSORT推荐作者运用结构式摘要的写法,即在文章摘要部分体现出“临床试验研究设计”、“方法”、“结果”和“结论”。
一篇完整的RCT研究论文,别忘了还需在文章中清楚描述本临床试验研究的注册登记号和注册登记的名称;透明的披露所获得的 “经费支持”及其他支持(如药物)的来源,经费提供方在本研究中的角色,及其是否存在利益冲突等情况。
CONSORT声明的主要目的是用于指导临床研究报告和论文的规范性撰写,但“强烈推荐”研究者在设计研究阶段,就可以参考声明中的细节内容,特别是方法学和随机化方案部分,规范和完善RCT临床研究的设计和过程实施,确保在临床试验中避免遗漏关键步骤。
工欲善其事必先利其器,深刻理解与运用CONSORT声明,必将助力科研能力的提升,促进临床试验报告的质量,为科学成果的交流、医疗政策的制定提供坚实证据,奠定牢固基础。
在后续推文中,我们会陆续为大家介绍更多研究类型的撰写规范,敬请关注!

图1 CONSORT 2010 中文检查表
注:与本清单有关的各种扩展版及最新参考资料,请见www.consort-statement.org。
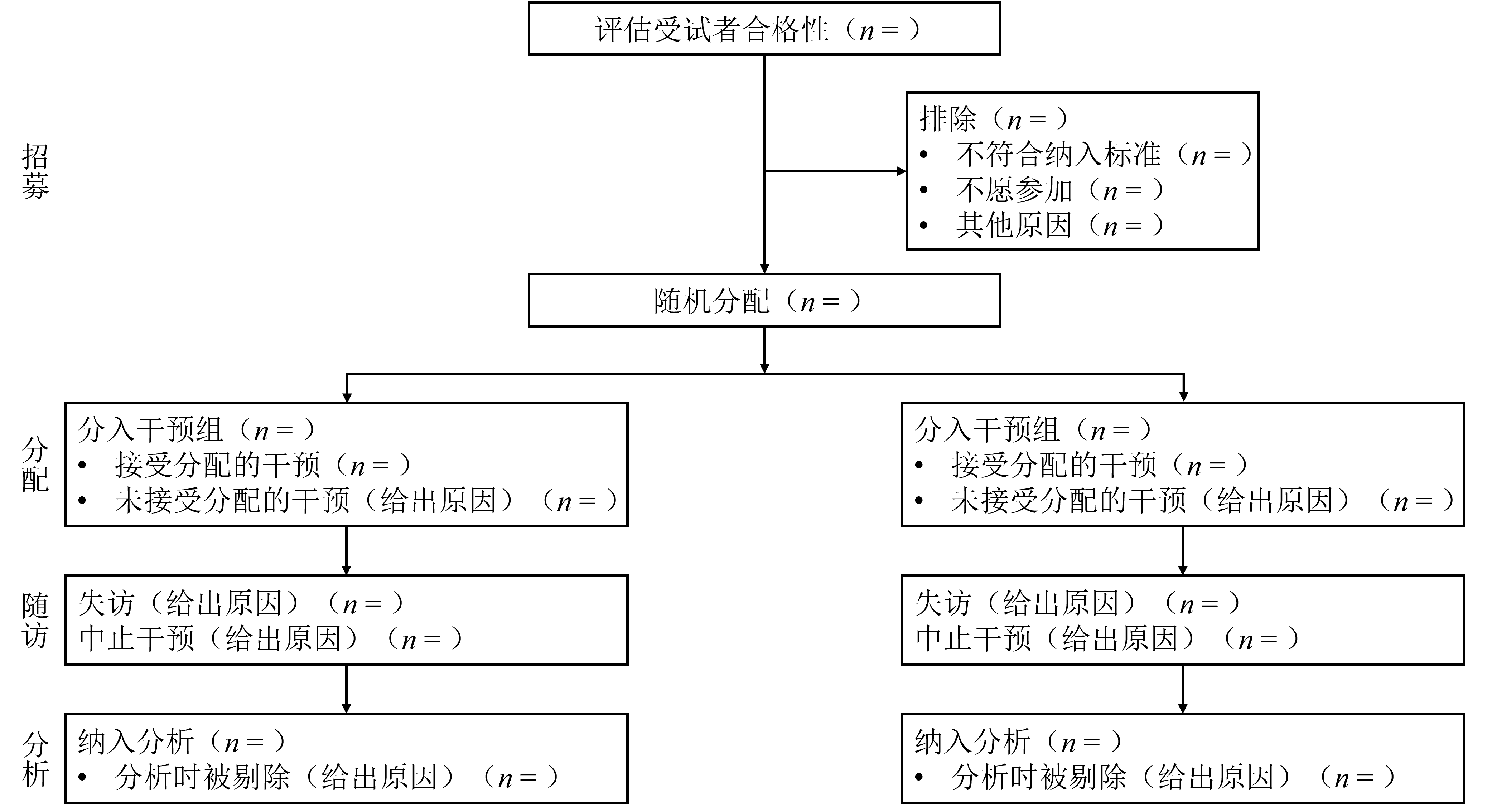
图2 两组平行对照随机临床试验各阶段(招募受试者、分配干预措施、随访和数据分析)进程的流程图
参考文献
[1]Rennie D. CONSORT revised--improving the reporting of randomized trials. JAMA. 2001. 285(15): 2006-7.
[2]Chan AW, Altman DG. Epidemiology and reporting of randomised trials published in PubMed journals. Lancet. 2005. 365(9465): 1159-62.
[3]Glasziou P, Meats E, Heneghan C, Shepperd S. What is missing from descriptions of treatment in trials and reviews. BMJ. 2008. 336(7659): 1472-4.
[4]Dwan K, Altman DG, Arnaiz JA, et al. Systematic review of the empirical evidence of study publication bias and outcome reporting bias. PLoS One. 2008. 3(8): e3081.
[5]Begg C, Cho M, Eastwood S, et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement. JAMA. 1996. 276(8): 637-9.
[6]Jüni P, Altman DG, Egger M. Systematic reviews in health care: Assessing the quality of controlled clinical trials. BMJ. 2001. 323(7303): 42-6.
[7]Moher D, Schulz KF, Altman DG. The CONSORT statement: revised recommendations for improving the quality of reports of parallel-group randomised trials. Lancet. 2001. 357(9263): 1191-4.
[8]Saint-Raymond A, Hill S, Martines J, Bahl R, Fontaine O, Bero L. CONSORT 2010. Lancet. 2010. 376(9737): 229-30.
[9]Schulz KF, Altman DG, Moher D. CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials. BMJ. 2010. 340: c332.
↓↓↓
查看更多