查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





中国医学论坛报记者 张二娟 发自西班牙马德里
在本次EULAR年会的最新临床试验摘要专场(Late Breaking Abstract Session),共有12项研究公布,在这其中,多数与生物制剂的应用相关,这也体现了近年来,生物制剂在风湿病领域的重要地位及受关注度。以下将会大家整理这些研究的主要结果,如果想了解研究更加细节的详情,可点击链接进一步查看。
点击EULAR 2019 Late Breaking研究速递(一),浏览更多大会精彩内容
LB0007 tanezumab 5 mg可改善中重度OA患者的疼痛、机体功能及患者整体评价
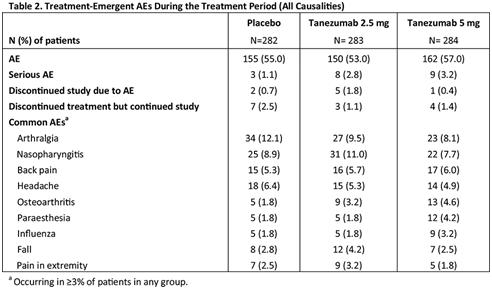
该项随机、双盲、安慰剂对照Ⅲ期研究(n=849,24周治疗,24周随访)主要评估了抗神经生长因子单克隆抗体tanezumab用于治疗中重度骨关节炎(OA)疼痛的疗效与安全性,这些患者对标准的镇痛治疗无应答或不耐受。患者于基线、第8周和第16周接受皮下注射tanezumab(2.5 mg或5 mg)或安慰剂治疗。
研究结果如图所示,tanezumab 5 mg组达到了所有的复合主要研究终点,tanezumab 2.5 mg则在PGA-OA方面表现略差。在安全性方面(表),尽管相对于安慰剂组,严重AE在tanezumab组中发生率更高,但AE发生率及由AE引起的治疗中断率两组相似。安慰剂组、tanezumab 2.5 mg组和tanezumab 5 mg组患者的总关节置换率(TJR)分别为6.7%、7.8%和7.0%。
既往研究表明,包括共有表位(SE)的HLA-DRB1等位基因与RA强烈相关,存在于85%抗环瓜氨酸蛋白2(CCP2)阳性RA患者,一项回顾性探索性分析显示,相对于SE阴性患者,abatacept(ABA)在SE阳性患者中更有效。本项单臂研究则在生物制剂初治早期活动性RA患者中,头对头比较了HLA-DRB1 SE与ABA或阿达木单抗(ADA)的临床疗效之间的关系 。
研究入选早期(症状发作时间= 12个月)、抗CCP2(> 3x ULN)和RF血清反应阳性的中重度RA成人患者,随机1:1至SC ABA 125 mg wkly或SC ADA每2周一次40mg(两组都同时应用稳定剂量的MTX),持续24周。根据患者HLA-DRB1 SE状态(+/-)对患者进行分层 。
研究共纳入80例患者: ABA组40例(9 SE-、30 SE +、1 SE未知)、ADA组40例(9 SE-,31 SE +),两组基线特征平衡。研究没有发现新的安全信号,两组相关的AE和严重AE发生率相似。在有效性方面,24周时,与ADA相比, ABA组观察到数值上更高的疗效反应(表1),对于DAS28(CRP)、SDAI和CDAI也观察到类似的结果。对于SE +患者也同样如此,两组ACR20 / 50/70应答和DAS28(CRP)缓解的估计治疗差异95%CI未超过0(图)。
LB0009:难治性RA患者,或许可以试试新型的微型神经刺激器
本研究主要在双盲设计的前提下评估了一种新型的微型神经刺激器——“MicroRegulator”(MR)用于活动性RA患者的安全性和有效性。
研究共纳入14名活动性RA患者,这些患者先前对2种bDMARDS或具有2种不同作用模式的JAK抑制剂治疗应答不佳。在稳定MTX治疗的基础上,所有患者置入MR,植入后3周,前3例受试者每天(QD)被刺激1分钟,在安全审查委员会批准后,其余11例患者置入MR后随机分配至1分钟的假刺激、QD或QID刺激12周。
患者对MR置入及其刺激耐受良好,未发生装置或治疗相关的SAE,有2例手术相关的不良事件(左侧声带麻痹、Horner综合征),但在没有临床显著后遗症的情况下消退。12周时,DAS28-CRP的变化为(平均值±SEM):开放标签QD = -1.44±0.64、QD = -1.24±0.88、QID=0.38±0.71,假手术组=0.16±0.21。在QD刺激的6例患者中,4个具有良好或中度反应(EULAR标准)。刺激12周后,患者滑膜炎或骨炎的MRI测量值没有变化。RAMRIS侵蚀评分与EULAR反应相关。
LB0010 RA患者:利妥昔单抗治疗剂量或可更低
该项荷兰研究者开展的研究对比了利妥昔单抗(RTX)超低剂量(1×500mg或1×200mg)与标准低剂量(1×1000mg)的有效性,旨在评估哪一种治疗剂量更具安全性及经济性。
研究纳入双盲、随机对照、非劣效性试验REDO研究中对RTX反应良好的RA患者(基于DAS28-CRP <2.9或临床判断),根据1:2:2比例,将患者随机分配至1×1000mg,1×500mg或1×200mg RTX组。
研究组纳入142例患者,在两个超低剂量组中,均有2例患者因复发(flare)而接受额外剂量的1000 mg RTX治疗。3个月时,500 mg剂量组非劣效于1000 mg,但6个月时, 200 mg剂量组在上述两个时间点均非劣效于1000 mg组。在整个研究中所有组的平均DAS28-CRP评分均保持低水平,在3个月时,B细胞计数的下降幅度也类似(图)。与1000mg组相比,200mg组中更多的患者接受肌内注射糖皮质激素治疗。
LB0011:Tocilizumab用于JIA相关性葡萄膜炎的初步探索
患有严重葡萄膜炎的儿童或对抗TNF药物和MTX无反应的儿童视力丧失的风险很高,英国的一项多中心、开放标签、单臂研究评估了tocilizumab联合MTX治疗儿童(2~18岁)青少年特发性关节炎(JIA)相关性葡萄膜炎的临床疗效。
研究纳入21例患者,在MTX治疗基础上,体重≤30kg者每2周应用162 mg tocilizumab治疗,<30 kg者,每3周一次。研究结果显示,共有7例患者获得治疗应答(从基线至12周,患者根据SUN标准定义为炎症水平降低2级或降至0),中位无偏估计的比例为34%(P=0.11)。基线时出现黄斑水肿的4例患者,3例得到缓解。事后分析显示,4例(19%)患者虽然被归类为无治疗反应,但其在3个月时至少有一级改善。另有10例(48%)没有反应,基线时的平均类固醇滴数为4.48(3.11),12周时降至4.33(2.29)。安全性结果与tocilizumab的已知安全性特征一致。
LB0012:Belimumab用于SLE的安全性评估
目前,belimumab(BEL)已被批准用于自身抗体阳性的活动性SLE成人患者,本项研究旨在评估SLE患者接受静脉注射(IV)BEL对比安慰剂(PBO)治疗52周的全因死亡率和AESI,这也是迄今为止最大型的SLE相关临床研究。
研究共纳入4003例患者,1:1随机分配为两组,在标准治疗基础上分别接受每月BEL 10 mg/kg IV或安慰剂治疗,持续48周。
两组的基线人口统计学和疾病特征相似。患者的治疗死亡率和预先指定的AESI发生率如下表所示。除严重抑郁症和严重输注/过敏反应外,各组间治疗中AESI的总体发生率相似。
感染是最常引发患者治疗过程中死亡的原因,安慰剂组和BEL组分别有3例(0.15%)和9例(0.45%)。在整个研究期,两组分别有22例(1.10%)和13例(0.65%)患者死亡。此外,在治疗期间,安慰剂和BEL组分别有5例(0.25%)和15例(0.75%)患者被报告有严重自杀意念/行为和发生自我伤害事件[差异(95%CI):0.50(0.06,0.94)],而研究期间,两组分别有39例(1.96%)和48例(2.43%)患者发生自杀意念/行为(C-SSRS)[差异(95%CI):0.47 (-0.44,1.38)]。研究没有报告与自杀有关的死亡事件。
中国医学论坛报发布,转载请联系我们~
查看更多