查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





药源性胰腺损害主要是指(急性)药物性胰腺炎(DIP),其他胰腺损害包括胰腺纤维化、慢性胰腺炎、自身免疫性胰腺炎、胰腺外分泌功能不全、糖尿病等。
药物性胰腺炎或药物性急性胰腺炎(DIAP)是指由于药物本身或其代谢产物,或机体特异质反应引起的超敏反应导致的胰腺损伤。DIP常表现为急性胰腺炎,极少表现为慢性胰腺炎,因其缺乏特异的临床表现和检测指标,往往很难与其他疾病导致的胰腺炎相鉴别,部分DIP可误认为是特发性胰腺炎,忽视了对相关药物的警惕,致使患者DIP反复发作。
既往认为DIP发病率低,为少见病。近年来研究表明,随着药物的广泛应用,DIP发病率增加至0.3%~5.3%,约占急性胰腺炎病因的2%。
自1955年首次报道糖皮质激素引起急性胰腺炎后,不断有国外文献报道原本未发现引起胰腺炎的药物可引起DIP。而我国关于DIP病例报道较少,多为个案报道,表明DIP尚未引起国内医生的普遍重视。
一项涵盖了1981—2018年期间在中国期刊全文数据库中报道的药源性胰腺炎个案病例文献的研究显示,门冬酰胺酶、替加环素、利福平及泼尼松等易诱发药源性胰腺炎,临床应用以上药物时须密切关注患者症状。
儿童、老年人、女性、人类免疫缺陷病毒(HIV)感染、炎症性肠病(IBD)患者、免疫抑制剂治疗及复合用药患者是DIP的高患病人群。
目前,DIP的发病机制尚不清楚,可能与药物性肝损伤(DILI)的发病机制近似。与肝脏相似,影响药物代谢的酶存在于所有外分泌和内分泌胰腺细胞成分中,如细胞色素P450-催化的混合功能氧化酶和NADPH还原酶。因此,哺乳动物的胰腺也可转化药物和外源性物质,会受到药物活性代谢产物的直接毒性损伤。该反应常与药物过量有关,对乙酰氨基酚、红霉素和卡马西平可直接导致DIP发生。
而多数药物引起的胰腺炎与药物剂量无关,因而一般认为大多数DIP是由特异质反应所致,即在药物正常剂量内出现的不可预测的反应。按照可能的发生机制,特异质反应可分为以下几种:① 免疫介导的过敏反应;② 罕见非免疫介导的个体易感性,与药物代谢的遗传差异有关;③ 脱靶的药理学作用,即药物直接与靶器官外的其他系统相作用。此外,有些药物副作用可引起高钙血症、高脂血症、增加胰液黏度,这些与急性胰腺炎发病机制相同。
目前,已经明确可以引起药物性胰腺炎的药物包括抗生素、抗HIV药物、利尿剂、消化道及胆胰疾病用药、心脏疾病用药、免疫制剂或化疗药物、神经精神性药物、解热镇痛抗炎药、减脂及内分泌药物和其他常用药物等10类(表1)。
表1 引起DIP的常见药物(已经明确)

值得强调的是,应重视新型化疗药物、靶向治疗药物、免疫治疗药物对胰腺的损害。
引起胰腺损伤的化疗药物主要是奥沙利铂和卡培他滨。国外一项病例报道显示,用奥沙利铂与卡培他滨后引起胰腺纤维化,卡培他滨用药后血清脂肪酶升高,停药后恢复正常。
新型分子靶向药物伊马替尼、舒尼替尼及瑞戈非尼均有文献报道导致胰腺损伤的不良事件,如急性胰腺炎或慢性胰腺炎,影像检查显示胰腺肿大或萎缩;美国食品与药物管理局(FDA)不良事件报告系统数据库显示有116例与使用贝伐珠单抗相关的胰腺炎。
在免疫检查点抑制剂(ICI)治疗过程中有5%~8.5%的患者导致AP或胰腺内分泌外分泌功能不足。《癌症免疫疗法杂志》(J Immunother Cancer)2019年发表一项Meta分析显示,在2279例接受ICI治疗并随后检查血清脂肪酶的患者中82例(4%)出现ICI诱导的急性胰腺炎。其中65%的患者接受了PD-1或其配体的抑制剂。
DIP诊断较困难,目前国内外均无统一的诊断标准,临床医师对DIP的认识不足,导致急性胰腺炎的药物数量众多,且从首次用药到胰腺炎出现的时间不同,也增加了该疾病诊断的困难性。
与DILI诊断类似,DIP诊断标准包括:① 满足急性胰腺炎的诊断标准;② 排除其他可能导致急性胰腺炎的病因;③ 用药史;④ 服药导致发病的时间是否与多数文献报告的潜伏期一致;⑤ 停药后胰腺炎症状及胰酶下降情况;⑥ 再次服药后临床表现及胰酶升高(激发试验阳性),但激发试验涉及伦理问题,需征得患者同意,并在利大于弊的情况下方可谨慎使用。
一个完整的诊断应包括AP诊断、分类诊断、病因诊断和并发症诊断。《中国急性胰腺炎诊治指南(2019,沈阳)》(以下简称《2019版指南》)将急性胰腺炎临床上分为轻症AP、中度重症AP和重症AP三类,此外,伴有感染的危重急性胰腺炎是一种新分类,值得临床关注,可参照该指南对AP进行分类诊断。
大量文献调研显示,在严重的DIAP病例中,由皮质类固醇类药物、抗原虫药物和抗反转录病毒药物诱发的DIAP 患者死亡率最高,由抗生素诱发的DIAP患者死亡率相对较小。目前观点认为,大部分DIAP患者为轻症,然而,在部分重症患者中,其病情恢复缓慢乃至不幸死亡的具体原因,尚难以明确区分是原发疾病直接所致,还是药物性急性胰腺炎的并发症所引发。DIAP真正的严重程度尚不清楚,需进行系统研究去证实。
在考虑患者服用可能引发胰腺炎的药物时,应在病情允许的情况下暂时停药;如不能停用,优先选择其他类别的药物代替,否则选择同类别的其他药物。停服可疑药物后如症状缓解,诊断DIP较合理。
再次使用该药物须谨慎,仅在收益大于风险并考虑风险可能为重症胰腺炎时,经患者同意后方能使用。如再次使用药物后胰腺炎再次发作,该药物即为明确引起胰腺炎的药物,应停用。
DIP后续治疗措施与胰腺炎诊治指南相同,可参考《2019版指南》。对轻、中度急性胰腺炎,予禁食水、补液、抑酸和抑制胰酶分泌,纠正水、电解质紊乱等支持治疗,防止局部及全身并发症;重度急性胰腺炎,应收入重症监护病房密切监测生命体征,进行液体复苏,维护脏器功能,营养支持,处理并发症。
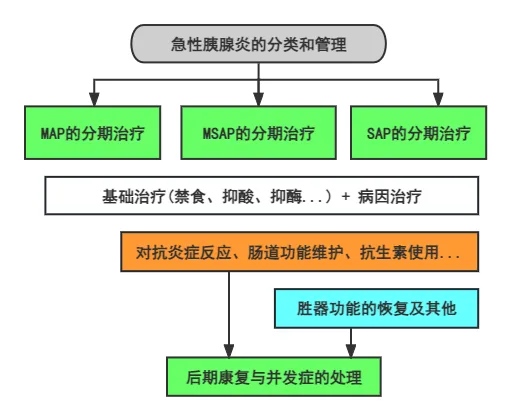
图1 DIP的诊断流程
预防DIP需要从以下两个方面入手。首先,识别引起 DIP的相关药物,特别警惕证据水平高的Ⅰ类药物;其次,识别DIP的高危人群,如使用免疫抑制剂巯唑嘌呤/6-巯基嘌呤治疗的IBD患者,使用明确引起DIP的药物须谨慎,对既往发生过DIP的患者,避免使用引起DIP的药物及同类的药物。
综上所述,DIP相对少见,但早期识别DIP有利于早期发现DIP患者,及时停药,防止DIP复发。DIP的发病机制可能类似DILI,临床处理在于及时停药,按指南正确治疗急性胰腺炎,尤其是重症患者。DIP重在预防。首先要识别引起 DIP的相关药物;其次识别DIP的高危人群;使用明确引起DIP的药物须谨慎,对既往发生过DIP的患者,避免使用引起DIP的药物及同类的药物。应特别关注新型化疗药物、靶向治疗药物、免疫治疗药物对胰腺的损害。
本文整理自中山大学孙逸仙纪念医院消化内科陈其奎教授在中华医学会第二十三次全国消化系病学术会议所做报告《药源性胰腺损害及其防治对策》。
查看更多