查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击进入专题:
作者:复旦大学附属华山医院神经内科 血管组 李思源 柳叶
血管内取栓治疗是目前急性缺血性卒中伴大血管闭塞最有效的治疗手段[1, 2],但既往临床试验对入组将基线梗死核心较大的患者,即平扫CT广泛低密度(通常指ASPECTS<6分)或灌注影像大梗死核心(通常指梗死核心体积≥70 ml)均排除。背后的担忧主要是广泛再灌注损伤所导致的出血、水肿甚至死亡风险。由于循证证据的相对缺乏,在这类患者中取栓治疗的有效性和安全性尚未得到很好的证实,成为近年来国内外研究者聚焦的热点。2022年公布的RESCUE Japan LIMIT研究首次证实取栓治疗在基线ASPECTS 3~5分的大梗死核心患者中同样安全有效[3]。在今年ISC上,ANGEL-ASPECT研究和SELECT2研究同时公布阳性结果,并双双发表于国际顶级医学期刊《新英格兰医学杂志》,为大梗死核心的血管内治疗增添了高级别循证证据[4, 5]。
ANGEL-ASPECT

ANGEL-ASPECT是由首都医科大学附属北京天坛医院牵头的多中心、开放标签、盲法终点的随机对照临床试验,在中国46家卒中中心完成,旨在进一步验证血管内治疗在急性前循环大血管闭塞导致大梗死核心的人群中的有效性和安全性。
研究的临床纳入标准:
(1)年龄18 ~ 80岁;
(2)24 h内发生急性缺血性卒中;
(3)经CTA或MRA证实大脑中动脉M1段或颈内动脉颅内段大血管闭塞(或两者兼有);
(4)基线NIHSS评分6~30分;
(5)基线改良Rankin量表(modified Rankin scale,mRS)0或1分。
研究的影像学纳入标准:
(1)发病24小时内CT平扫ASPECTS 3~5分,CTP或DWI任意梗死核心体积;
(2)发病24小时内CT平扫ASPECTS 0~2分,CTP或DWI梗死核心体积70~100 ml;
(3)发病6~24小时CT平扫ASPECTS >5分,CTP或DWI梗死核心体积70~100 ml。
研究的排除标准:
中线偏移或临床脑疝征象、占位效应、高出血风险、急性双侧梗死或多发颅内动脉闭塞。
符合以上标准的患者被1:1分配至血管内治疗联合药物治疗(血管内治疗组)或单纯药物治疗(药物治疗组)。其中,血管内治疗首选支架取栓或血栓抽吸,必要时可联合球囊扩张、支架植入等血管成型技术和动脉内溶栓);两组均允许符合条件的患者行标准阿替普酶(0.9 mg/kg)或尿激酶(1.0~1.5万单位)静脉溶栓。
研究终点
主要有效性终点:
90天mRS评分位移。
次要有效性终点:
(1)90天mRS 0~2;
(2)90天mRS 0~3;
(3)随机后36小时NIHSS 0~1分或较基线改善≥10分;
(4)基线至随机后36小时DWI或7天/出院时CT所示梗死核心体积变化值;
(5)随机后36小时CTA或MRA所示责任血管再通(定义为改良动脉闭塞评分2或3分)。
安全性终点:
(1)随机后48小时内的症状性颅内出血转化(Heidelberg分型)
(2)48小时任何颅内出血、发病90天内死亡
(3)住院期间行去骨瓣减压术。
研究采用意向性治疗(intention-to-treat,ITT)分析,并采用符合方案集(per-protocol,PP)分析进行敏感性分析。
研究因血管内治疗组获益达到预期而提前终止入组。最终入组456名患者,血管内治疗组231任,单纯药物治疗225人。所有患者的中位年龄68(60~73)岁,女性占38.7%;发病至随机时间中位数456(302~760)分钟,基线NIHSS评分中位数16分,ASPECTS中位数3分,梗死灶体积中位数62 ml。两组患者的基线资料均衡可比(表1),每组中有约28%的患者接受静脉溶栓,血管内治疗组中有64.3%的患者于发病6~24小时就诊,在单纯药物治疗组这一比例为62.2%。
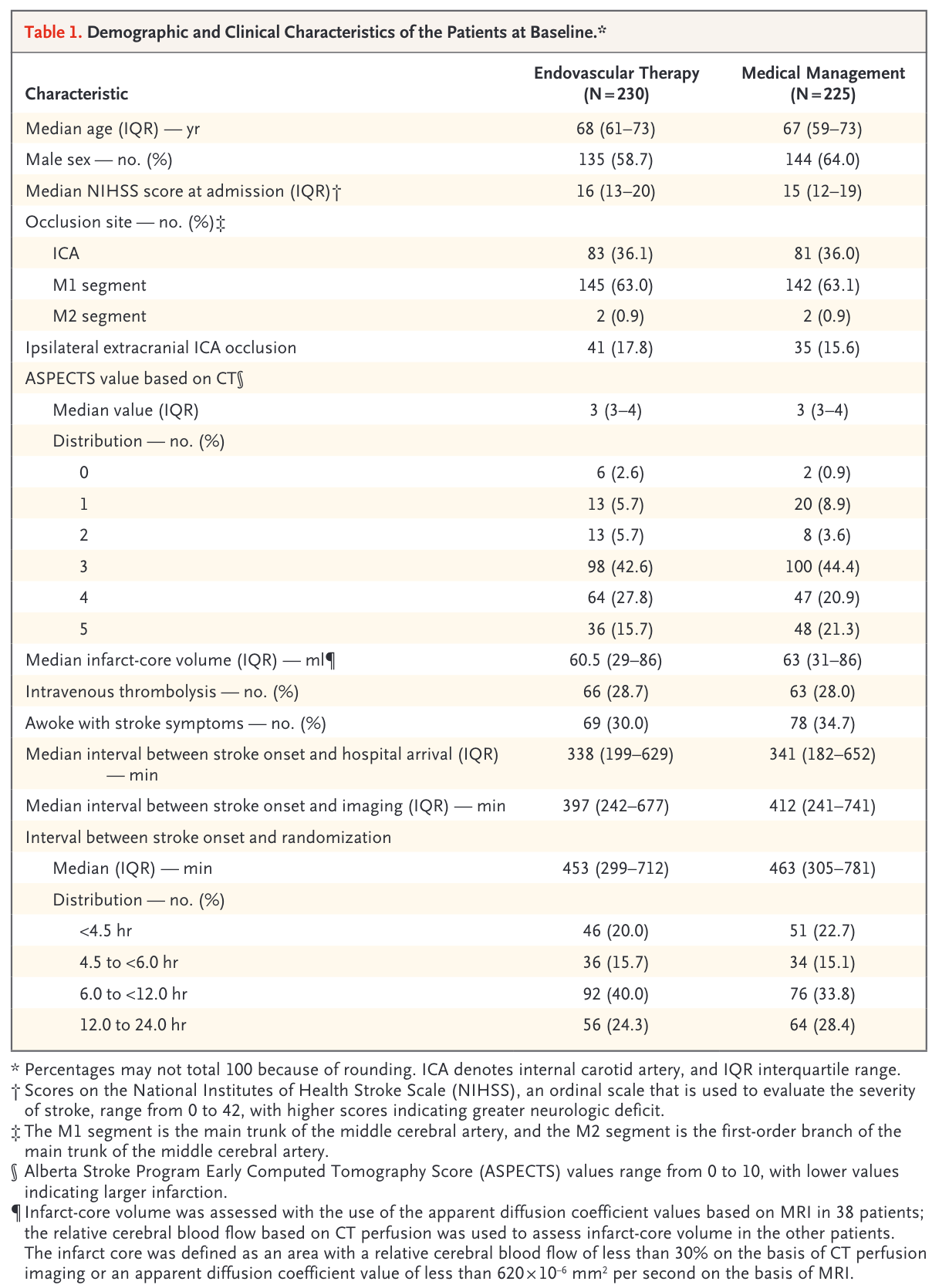
研究主要有效性终点的ITT分析显示,接受血管内治疗的患者90天mRS评分显著优于单纯药物治疗组(generalized OR 1.37;95% CI 1.11~1.69,P=0.004)。血管内治疗的有效性在以年龄、发病时间、NIHSS评分、ASPECTS评分、梗死核心体积、是否静脉溶栓、血管闭塞部位及病因分型分组的各预设亚组间基本相似。在各次要终点上,血管内治疗组30.0%的患者预后良好(90天 mRS 0~2分),药物治疗组仅11.6%(RR 2.62,95% CI 1.69~4.06);血管内治疗组90天mRS 0~3分的患者比例亦显著高于药物治疗组(RR 1.50,95% CI 1.17~1.91)。血管内治疗组有更多的患者在随机后36小时神经功能显著改善(5.7% vs 1.8%,RR 4.29,95% CI 1.28~14.46),且血管再通的患者比例为单纯药物治疗组的两倍有余(85.8%vs 36.4%,RR 2.46,95% CI 1.96~3.08)。敏感性分析中,PP分析结果与ITT分析结果一致。
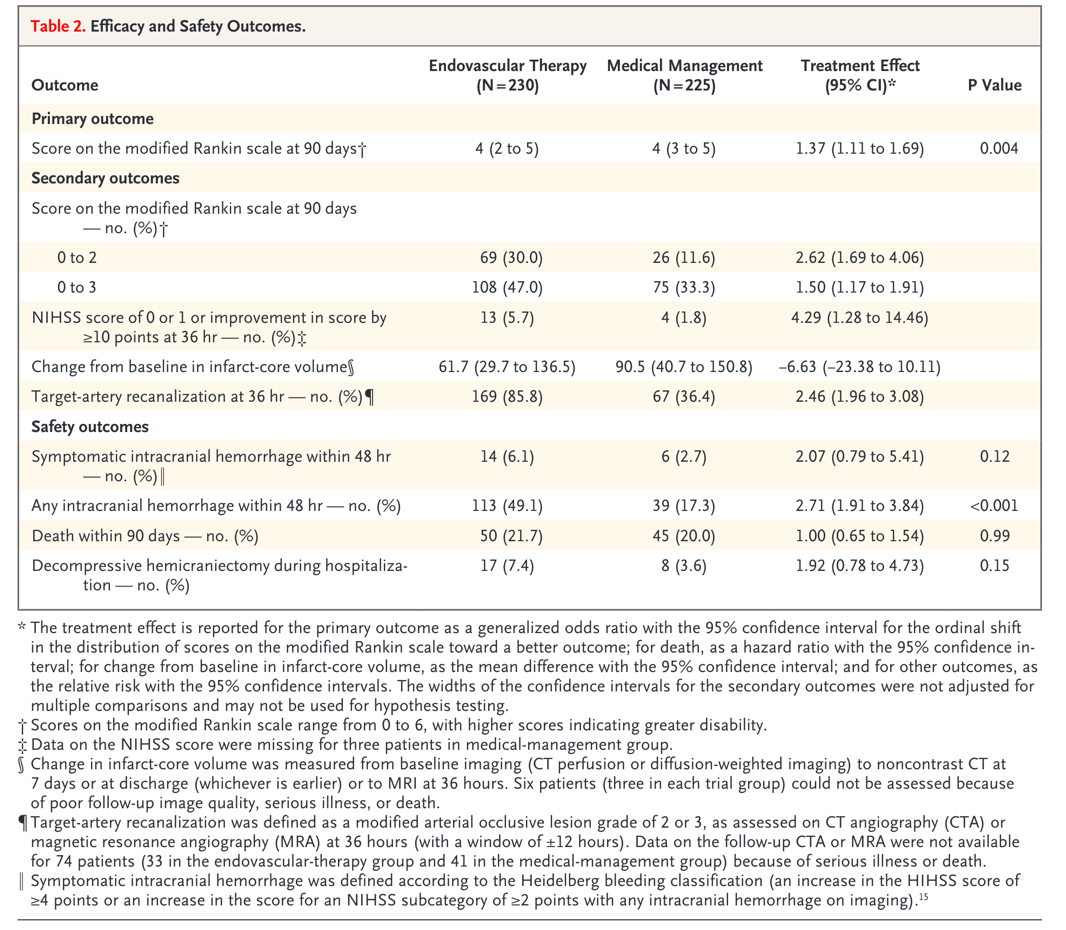
在安全性终点方面,血管内治疗组较药物治疗组患者发生更多症状性颅内出血转化(14/6.1% vs 6/2.7%),无显著统计学差异。但血管内治疗的患者发生任何颅内出血的比例高于单纯药物治疗组(49.1% vs 17.3%,RR 2.71,95% CI 1.91~3.84,P<0.001)。两组患者的90天死亡率相似,血管内治疗组中行去骨瓣减压术的患者在数量上更多,但无统计学差异。
综上,ANGEL-ASPECT研究结果表明,在急性前循环大血管闭塞所致大梗死核心患者中,在发病24小时内行急诊血管内治疗能有效改善患者功能预后,且不增加致命性出血风险。

SELECT2研究是一项国际多中心、开放标签、盲法终点的适应性富集设计Ⅲ期随机对照临床试验,由克利夫兰医学中心牵头,在北美、欧洲及大洋洲共31家中心开展,目的在于评估发病24小时内的血管内治疗在大梗死核心的大血管闭塞患者中是否安全有效。
研究的临床纳入标准 [6]:
(1) 年龄18 ~ 85岁;
(2) 发病24小时内由大脑中动脉M1段或颈内动脉(包括颅外和颅内段)闭塞或串联病变所致急性缺血性卒中;
(3) 基线NIHSS≥6分;
(4) 基线改良Rankin量表(modified Rankin scale,mRS)0或1分。
研究的影像纳入标准:
(1) CT平扫ASPECTS 3~5分;
(2) CT灌注所示梗死核心体积≥50 ml(采用RAPID软件后处理);
(3) DWI所示梗死核心体积≥50 ml(采用RAPID软件后处理)。

符合以上标准的患者被1:1分配至血管内治疗联合药物治疗(血管内治疗组)或单纯药物治疗(药物治疗组)。其中,血管内治疗首选支架取栓或血栓抽吸;两组均允许符合条件的患者行标准阿替普酶或替奈普酶静脉溶栓。
研究终点
主要有效性终点:
90天mRS评分,且将mRS 6分和mRS 5分进行合并以避免将两者之间的差异认定为功能显著改善。
次要有效性终点:
(1) 90天功能独立(mRS 0~2分),
(2) 90天独立下床活动(mRS 0~3分);
(3) 手术并发症;
(4) 血管再通(定义为改良脑梗死溶栓分级[mTICI] 2b-3级);
(5) 早期神经功能改善(定义为24小时NIHSS 0-1分或较基线改善≥8分);
(6) 生活质量评分等。
安全性终点:
(1) 症状性颅内出血转化(SITS-MOST);
(2) 90天死亡率;
(3) 早期神经功能恶化(定义为24小时NIHSS较基线进展≥4分);
(4) 术后并发症;
研究对各个终点采用意向性治疗(intention-to-treat,ITT)分析。
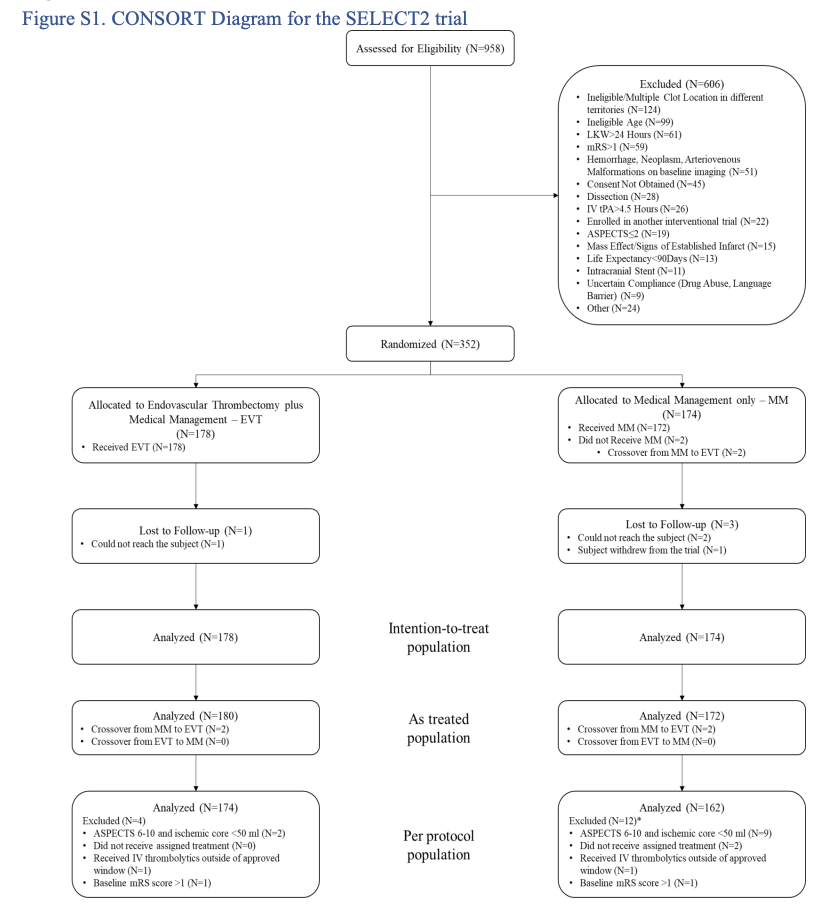
自2019年9月至2022年9月,研究共纳入352例患者,其中178例患者进入血管内治疗组,174例进入药物治疗组(筛选流程见上图)。两组患者的基线人口学、临床和影像特征相似。全部患者年龄中位数为66.5(58~75)岁,女性145例(41.2 %),基线NIHSS评分中位数19(15~23),最后正常至随机时间中位数9.31(5.66~15.33)小时,ASPECTS评分中位数为4(3~5)分,平均梗死核心体积80(60~113.5)ml。血管内治疗组37例(20.8 %)接受静脉溶栓治疗,药物治疗组则为30例(17.3 %)。
随访90天,血管内治疗组mRS评分中位数为4(3~6)分,药物治疗组为5(4~6)分。主要终点的ITT分析显示血管内治疗显著优于药物治疗(generalized OR 1.51;95% CI 1.20~1.89,P < 0.001),平均每治疗4.94例患者将有1人获益(number needed to treat,NNT)。对年龄、NIHSS、ASPECTS评分、闭塞部位、发病时间等进行亚组分析的结果总体上支持血管内治疗的有效性;在对梗死核心体积进一步的亚组分析也显示,对大梗死核心,甚至是梗死核心体积150 ml以上的患者行血管内治疗仍可能是有益。尤其需要指出的是,即使是在ASPECTS<6且梗死核心≥70 ml,也就是被常规血管内治疗临床试验所除外的患者群体中,血管内治疗仍是有效的(generalized OR 1.58;95% CI 1.19~2.09)。在主要终点上,符合方案集分析(per-protocol)(336例)和接受治疗分析(352例)的结果与ITT分析一致。
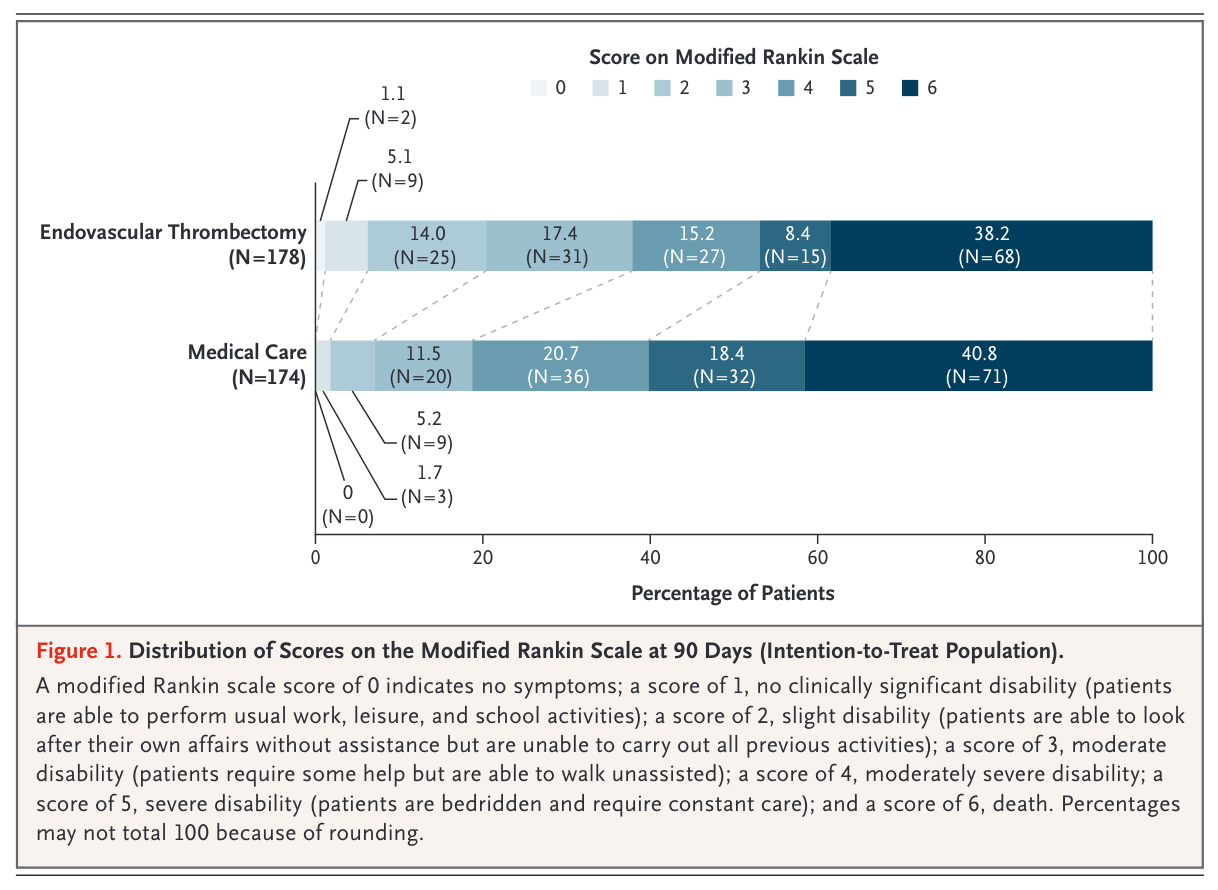
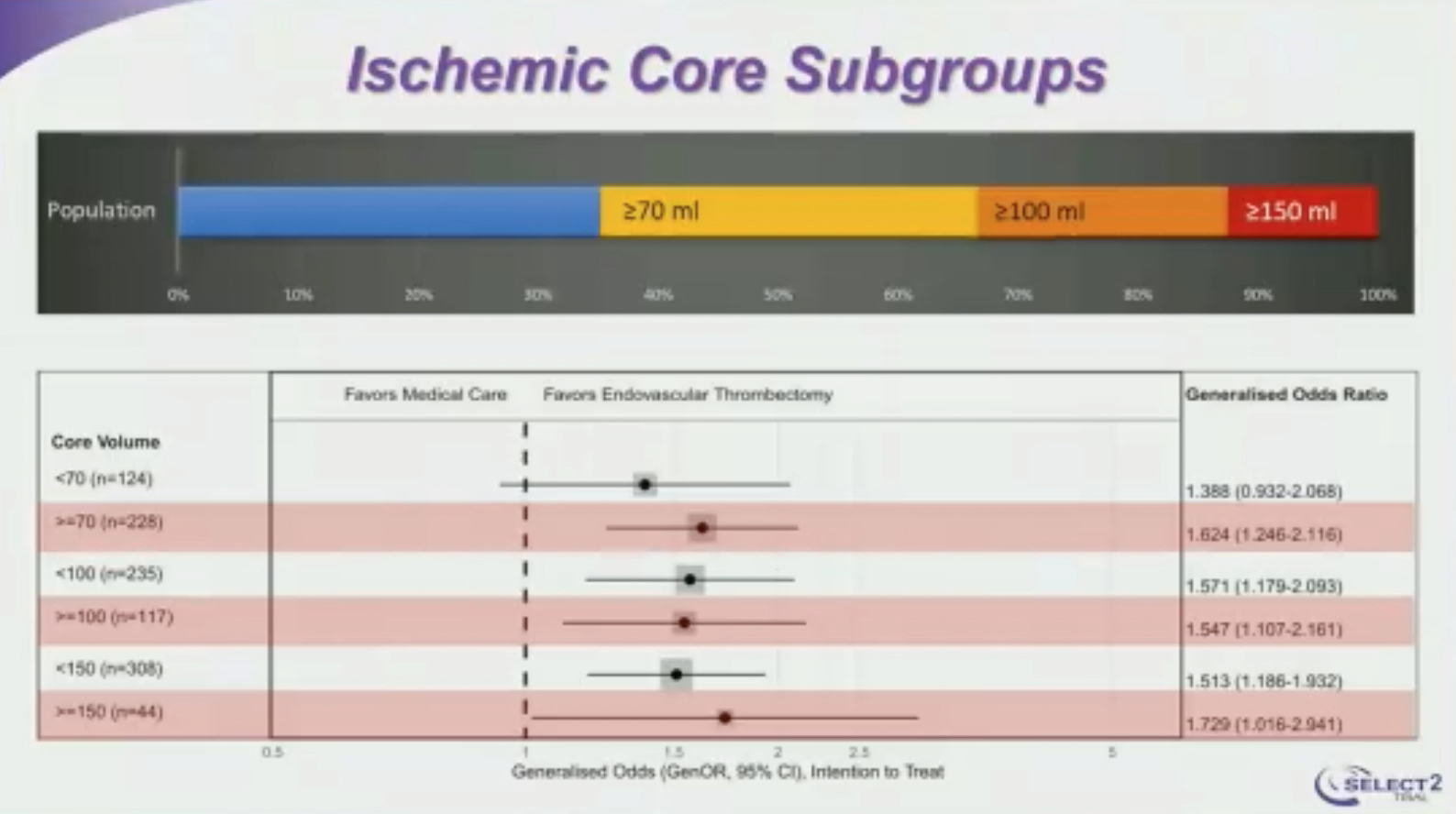
在次要终点中,血管内治疗组有20%的患者获得功能独立(90天mRS 0~2分),较药物治疗组的7%显著增加(RR 2.97,95%CI 1.60~5.51,NNT 7.34);相似地,90天mRS 0~3分的患者比例也在血管内治疗组中更高(38% vs 19%,RR 2.06,95% CI 1.43~2.96,NNT 5.11)。
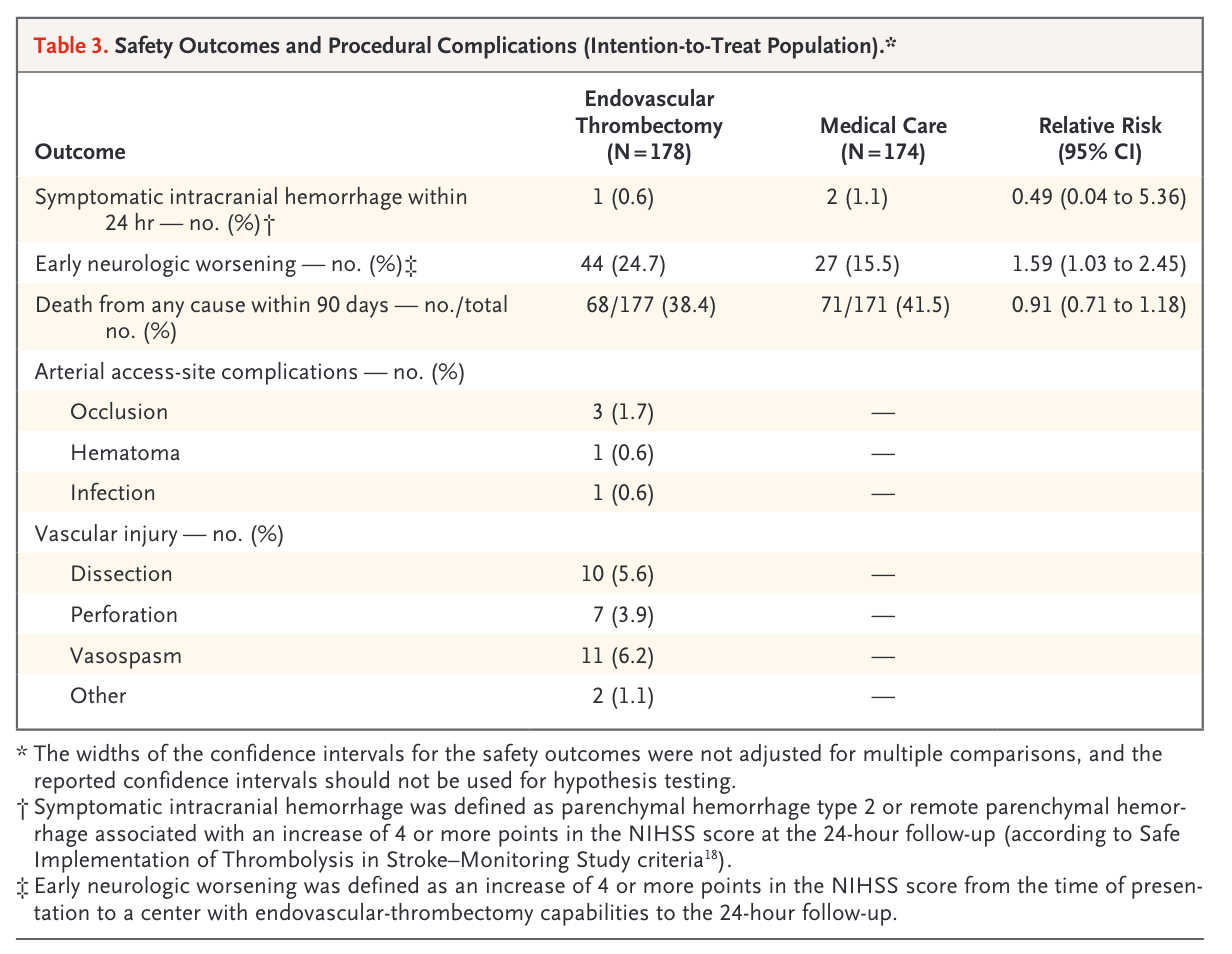
研究中发生症状性颅内出血的患者较少,血管内治疗组仅1例(0.6%),药物治疗组中2例(1.1%),两者差异无统计学意义;血管内治疗组5例(2.8 %)出现脑实质血肿,药物治疗组3例(1.7%)(RR 1.63,95% CI 0.39~6.73。接受血管内治疗的患者更有可能发生早期神经功能恶化(25% vs 16%,RR 1.59,95% CI 1.03~2.45),可能与梗死后水肿有关;但死亡率方面,血管内治疗组在数值上稍低,但与药物治疗组相比无统计学差异(38% vs 42%)。
综上,SELECT2研究结果证实在药物治疗基础上联合血管内治疗在急性前循环大血管闭塞所致大梗死核心患者中同样安全有效。
参考文献:
[1] GOYAL M, MENON B K, VAN ZWAM W H, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials [J]. The Lancet, 2016, 387(10029): 1723-31.
[2] JOVIN T G, NOGUEIRA R G, LANSBERG M G, et al. Thrombectomy for anterior circulation stroke beyond 6 h from time last known well (AURORA): a systematic review and individual patient data meta-analysis [J]. Lancet, 2022, 399(10321): 249-58.
[3] UCHIDA K, SHINDO S, YOSHIMURA S, et al. Association Between Alberta Stroke Program Early Computed Tomography Score and Efficacy and Safety Outcomes With Endovascular Therapy in Patients With Stroke From Large-Vessel Occlusion: A Secondary Analysis of the Recovery by Endovascular Salvage for Cerebral Ultra-acute Embolism-Japan Large Ischemic Core Trial (RESCUE-Japan LIMIT) [J]. JAMA Neurol, 2022, 79(12): 1260-6.
[4] HUO X, MA G, TONG X, et al. Trial of Endovascular Therapy for Acute Ischemic Stroke with Large Infarct [J]. N Engl J Med, 2023.
[5] SARRAJ A, HASSAN A E, ABRAHAM M G, et al. Trial of Endovascular Thrombectomy for Large Ischemic Strokes [J]. N Engl J Med, 2023.
本文为独家原创文章,转载须授权
查看更多