查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





【食管癌规范化诊疗】专栏,意在通过邀请食管癌方向专家学者,分别从食管癌影像学诊断和疗效评估、手术治疗、放化疗、免疫治疗等方面进行梳理,探讨学术前沿,分享实践经验,提高诊疗能力,最终推进我国食管癌规范化诊疗。
手术及放化疗的联合应用已被证明可提高患者的远期生存率,并逐渐演变为食管癌的常规治疗模式;新辅助治疗是目前针对中晚期食管癌的主要治疗方式;免疫治疗在食管癌领域取得了较为长久的治疗效果,目前研究重心也由免疫单药治疗转变为多药联合及新辅助治疗。食管癌理想的治疗方式还在逐渐完善,本报特邀河南省肿瘤医院郑燕教授梳理食管癌的免疫治疗进展。

目前全球范围内食管癌发病率位居第七位,死亡率排第六位,东亚、东非和非洲南部发病率较高,且主要病理类型为鳞癌,欧美国家以腺癌为主。我国食管癌的死亡率占全部恶性肿瘤第四位,因食管癌的临床隐匿性及受累人群的经济水平,同时,食管本身富含血供及淋巴回流,一旦肿瘤侵及黏膜下层,发生淋巴结转移及远处微转移灶的概率便会急剧升高,绝大多数食管癌患者确诊时已进展为中晚期。因此,针对围手术期已有的微转移灶治疗显得尤为关键。
术前新辅助治疗可使食管癌瘤体缩小并清除部分微转移灶,从而使原本失去手术机会的患者行手术治疗。已有的临床研究表明新辅助化疗及新辅助放化疗可降低远处复发风险,并提高患者的总体生存率。但是,仍有近40%的患者对化疗药物相对不敏感,甚至在新辅助治疗期间出现疾病进展;另一方面,术后复发或不可切除的食管癌患者整体生存率仍较低,缺乏二线治疗手段,由此可见,食管癌的治疗模式仍需不断调整。
绝大多数的肿瘤细胞均可表达能被特异性CD8+T淋巴细胞识别的抗原,与相应配体结合后可引起相关肿瘤排斥反应,从而杀灭肿瘤细胞,一旦肿瘤细胞产生可规避免疫识别的受体,即可出现免疫逃逸。免疫治疗可针对这种逃逸机制,人为调整机体的免疫功能以达到治疗目的。
目前,以程序性死亡受体(PD-1)抗体为代表的免疫检查点抑制剂已在晚期食管癌的二线治疗中展现出确切的治疗效果,下文将以现有的免疫检查点抑制剂相关临床试验为基础,概述各阶段食管癌患者的联合治疗进展及未来的发展方向。

CTLA-4是由T细胞独特表达的一种共抑制分子,是针对免疫检查点研究最早的靶点,主要分布于活化CD4+辅助性T细胞表面,竞争性抑制通路信号的下传和随后的T细胞活化,诱导T细胞成为无反应型T细胞,从而抑制细胞免疫的发生。
目前探索CTLA-4抗体在食管癌治疗方面的研究较少,在替西木单抗(tremelimumab)的II期临床试验中,入组了12例食管或食管胃交界部经一线或多线治疗失败后的晚期腺癌患者,1例患者出现部分反应(PR),并获得超过32.7个月的总生存(OS)期,2例疾病平稳(SD),3例OS期超过12个月。CTLA-4抗体在食管腺癌的二线治疗中展现出一定的治疗效果,但疗效不明显,现在研究重点已转为与其他抗体制剂或放化疗联合应用模式,相关临床试验正在进行。

PD-1主要表达于活化的T淋巴细胞、B淋巴细胞和巨噬细胞表面,目前已发现两种配体,即PD-L1和PD-L2,前者多表达于肿瘤细胞表面,也会在部分组织及巨噬细胞中表达,后者在巨噬细胞和树突状细胞中均有表达,但对PD-L2的功能尚不清楚。受体配体结合后将激活PD-1通路,持续传递淋巴细胞抑制性信号,从而导致免疫逃逸的发生。
现有研究表明,超过40%的食管鳞癌患者肿瘤细胞表面表达有PD-L1,并且在亚洲人群中PD-L1阳性表达与总体生存差异显著相关。相应的抗体制剂对PD-1具有高亲和力,可抑制PD-L1、PD-L2与PD-1的结合,同时增加肿瘤抗原的增殖及特异性T细胞、体外细胞因子的分泌。
在多项PD-1抗体单药治疗晚期或一线化疗失败的食管癌临床试验中,帕博利珠单抗、纳武利尤单抗及卡瑞利珠单抗等均展现出较好的疗效及可靠的安全性。其中,对比纳武利尤单抗与化疗二线治疗的临床试验中,前者也展现出较化疗更好的OS期及药物安全性,而且对于应用PD-1抗体制剂生存期大于10个月的患者,出现了较化疗相比更为平稳的生存期。
基于PD-1抗体制剂在晚期食管癌二线治疗的可靠疗效,美国食品和药物管理局(FDA)已批准帕博利珠单抗用于治疗一线或多线系统性治疗后复发、局部晚期或转移性食管鳞癌,且肿瘤表达 PD-L1[阳性联合分数(CPS)≥10]的患者。目前研究重点也逐渐转向术前新辅助应用或与其他治疗方式联合应用,未来,相应的临床试验结果将促进食管癌治疗模式的进一步调整。

新辅助治疗的目标是在术前处理部分未发现的远处转移灶,实现晚期患者的降级,减少手术切除范围,并降低手术切缘阳性的可能性。术前新辅助(化疗及放化疗)治疗改善了食管癌患者的局部复发风险和总体生存率,那么新辅助免疫治疗是否能使患者获益?
免疫制剂发挥疗效首先需要较为完善的免疫识别系统,其次需有效识别已暴露的肿瘤抗原,并诱导足量免疫排斥反应从而消除肿瘤细胞。已有研究指出,PD-1抗体制剂对较为完整保留免疫原性肿瘤的个体更为有效,可能对免疫系统受损的患者效果欠佳。临床前模型的数据显示,在新辅助治疗环境中引发免疫应答可能疗效更好。通过对转移性乳腺癌小鼠模型采取不同的治疗方式,发现在新辅助治疗中应用PD-1抗体可拥有更好的生存时间及免疫应答;而在新辅助免疫治疗的肾透明细胞癌术后标本中,可观察到免疫细胞广泛浸润了肿瘤组织;评价各转移灶的异质性也发现,淋巴结是反应最强应答器官,以上均预示着免疫制剂在食管癌的新辅助应用中有着较好的前景。
新辅助免疫治疗可能会更好地处理食管癌已有的局部转移病变,并产生更可靠的肿瘤排斥反应,同时对接受新辅助免疫治疗的患者,检测其相关血液学指标变化也可能预测疗效及预后情况。未来,我们需要观察并监测新辅助免疫治疗的远期疗效。

放化疗作为食管癌的传统治疗方式,一直是晚期及术后辅助治疗的一线治疗,但总体疗效欠佳。研究发现,放化疗可增强肿瘤抗原提呈功能,从而逆转肿瘤晚期的免疫抑制及肿瘤内微环境的改变, 并在一定程度上减缓肿瘤细胞耐药性的发生,这为免疫制剂与放化疗的联合应用提供了理论基础。
小鼠研究发现,放疗后肿瘤中PD-L1的表达会增加,并且在应用抗PD-L1制剂后可通过细胞毒性T细胞依赖性机制,增强放疗的效果并改变肿瘤免疫微环境。放疗与免疫治疗的联合可能使总体抗肿瘤反应进一步提升。另一方面,在对食管癌化疗后免疫微环境改变的研究中发现,PD-L1在免疫细胞(IC)和CD8+肿瘤浸润淋巴细胞(TIL)上表达增加,且可诱导食管癌患者产生抗肿瘤特异性细胞毒性T淋巴细胞(CTL), 这提示我们放化疗联合免疫治疗可能诱导获得更好的病理缓解率。
针对胃癌及食管胃交界部腺癌的II期KEYNOTE-059研究中,帕博利珠单抗联合顺铂与5-氟尿嘧啶或卡培他滨对比单药治疗已显示出更好的客观反应率(60.0%对25.8%),同时免疫制剂联合铂类化疗、新辅助免疫联合化疗在非小细胞肺癌中可使患者不同程度地获益。目前正在进行的针对晚期食管癌患者的III期临床试验(KEYNOTE-590),将比较化疗与帕博利珠单抗联合化疗的一线应用疗效,其研究结果可能对晚期食管癌患者的一线治疗方式产生影响。表1展示了正在开展的多项新辅助放化疗联合免疫制剂的临床试验。
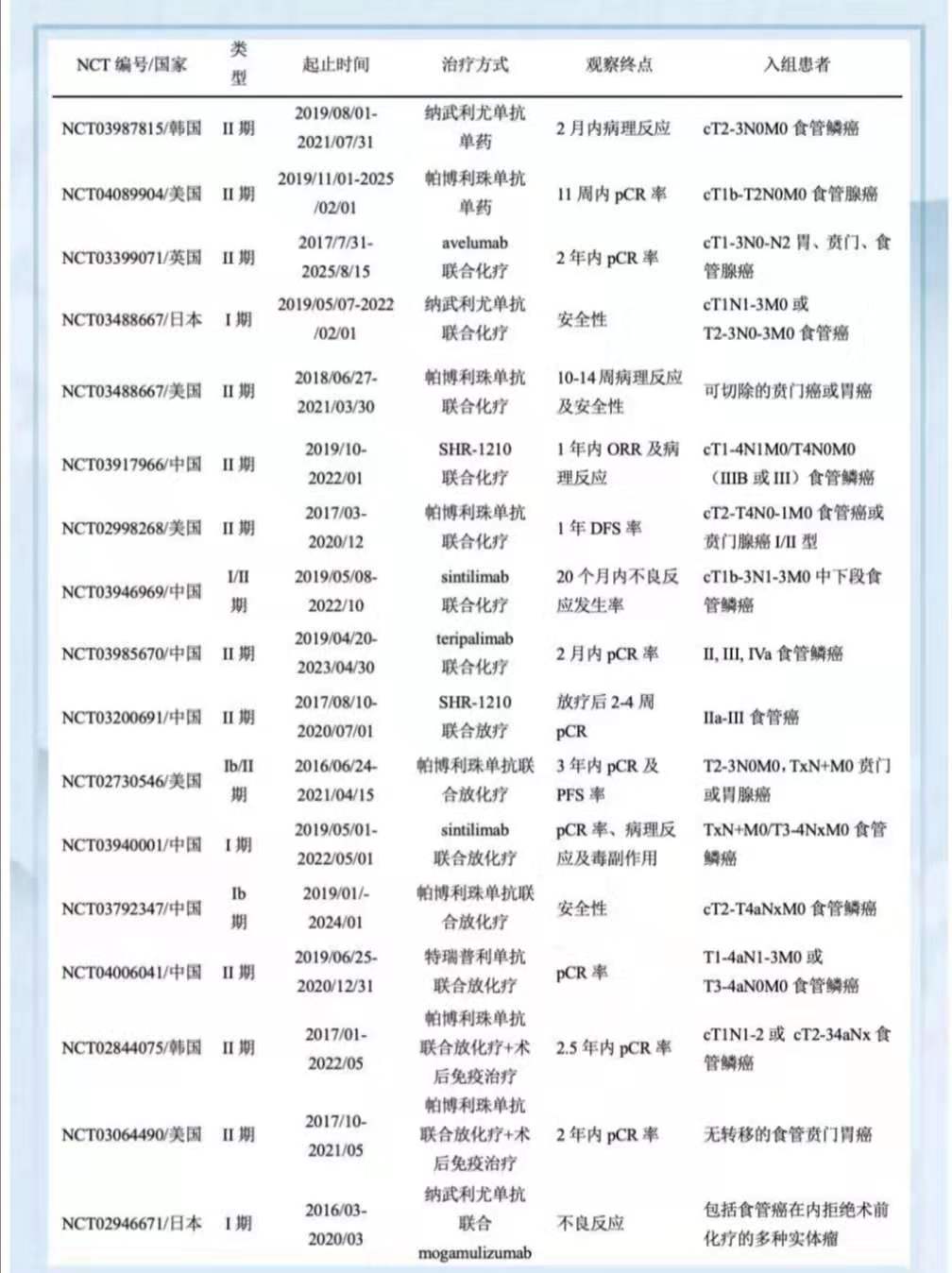
研究黑色素瘤及部分实体瘤发现,抗CTLA-4抗体制剂在与其他如德瓦鲁单抗(durvalumab)及纳武利尤单抗的联合应用,或是新辅助免疫联合应用中可获得更好的病理反应率。这可能与抗CTLA‑4抗体在诱导期激活T细胞,分化为CTL,而抗PD‑1/抗PD‑L1抗体可在效应期增强CTL功能相关。
已完成的针对转移性食管腺癌二线治疗的临床试验中,3组患者接受不同的治疗方案[59例纳武利尤单抗3 mg/kg,49例纳武利尤单抗1 mg/kg+伊匹单抗(ipilimumab)3 mg/kg,52例纳武利尤3 mg/kg+ipilimumab 1 mg/kg)]。其中,第二组获得了最高的ORR(24%)及12个月的无病生存期(PFS率为17%),但总体OS无差异。免疫检查点抑制剂的联合应用提升了ORR,但总体相似的生存期意味着免疫制剂的二线应用可能还存在局限性。因此,目前已开展了多项以tremelimumab及ipilimumab联合免疫制剂的一线及新辅助应用临床试验(表2)。值得注意的是,免疫制剂的联合应用将不可避免地增加不良反应的发生率,且发作时间更早、更严重,需要临床医生在使用时更加谨慎。
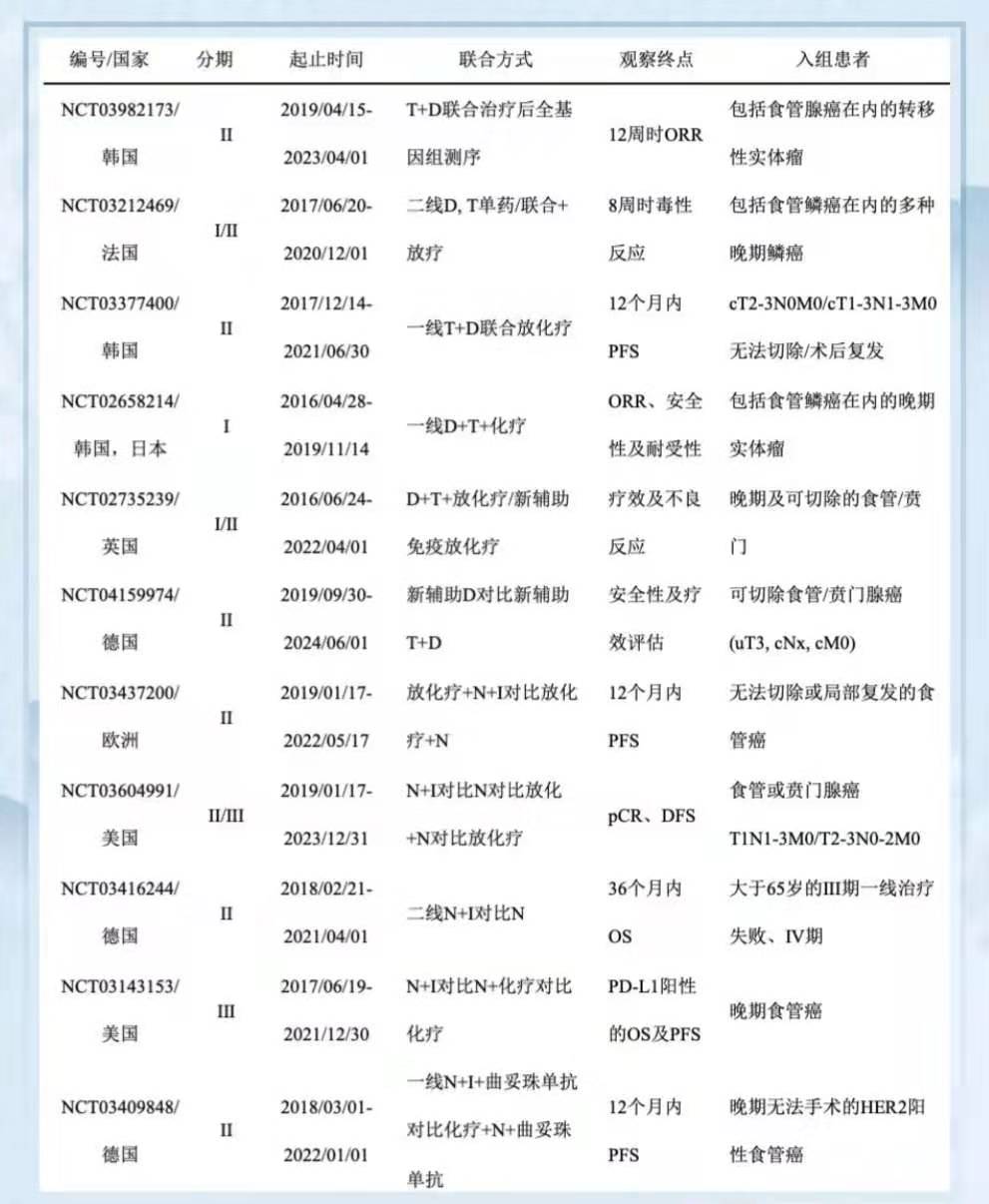

免疫检查点抑制剂的出现为食管癌的治疗带来了新的希望,随着研究的不断深入,将有更多临床研究探索不同治疗方式在不同时机应用的治疗效果。但是,多种治疗方式的联合应用也存在一系列问题,如多种药物的不良反应、过长的治疗周期、更多的治疗费用、患者耐受程度以及联合治疗的生存获益等,都需要严谨细致地评估。我们急需寻找合适的生物标志物对患者进行筛选,制定不同的治疗模式,从而真正实现患者的个体化精准治疗。

作者 | 刘季钊 郑燕(郑州大学附属肿瘤医院/河南省肿瘤医院)

编辑 | 刘婷(中国医学论坛报)
查看更多