查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2019年12月7日,国家卫生健康委员会又正式发布了《原发性肝癌诊疗规范(2019年版)》(以下简称《规范》)。该《规范》在国家卫生健康委员会领导的指导下,由复旦大学附属中山医院樊嘉院士牵头,共有70余名肝癌诊疗领域专家积极参与,历经10月余最终得以发布。新版《规范》更加注重基于临床循证证据来进行更新。为帮助广大临床医生深入理解《规范》相关内容,本报邀请《规范》编写专家委员会各领域专家分别从影像、病理、外科、介入、放射、内科及中医药7方面进行解读。
本期我们邀请影像学组副组长,上海交通大学医学院附属瑞金医院严福华教授,就影像学CT和MR检查部分进行解读。
一、HCC的影像学表现
1、快进快出
影像学对HCC的诊断发挥了重要作用。在HCC的发生发展过程中,动脉血供逐渐增加,门静脉血供逐渐减少,因此在CT和MR的多期动态增强扫描中表现为动脉期病灶有显著强化,门脉期和/或平衡期强化程度下降,密度或信号强度低于周边肝组织,称为“快进快出”强化模式(图1)。
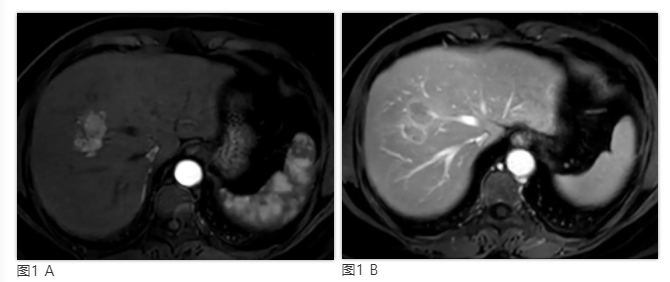
图1 肝脏右前叶 HCC。MR增强动脉期(A)示肝脏S8段不规则形病灶明显不均匀强化呈高信号,门脉期(B)强化程度低于周围肝组织(“快进快出”),并见边缘包膜呈环形强化。
在高危人群中具有这种典型表现者即可明确HCC的诊断[1],而AFP及其他生化指标的作用有限。此外,和其他实体肿瘤不同的是,穿刺活检得到组织病理学证据并非必须,而且穿刺活检有出血、肿瘤种植和假阴性结果的风险[2]。
2、扩散受限
然而,也有一部分HCC并无“快进快出”的强化表现,主要是基于其特殊的病理细胞类型,如纤维板层型、硬化型、透明细胞型等。因此该版《规范》中特别强调了多模态MRI的应用。MRI的应用仅有四十余年的历史,但发展相当迅速,除了无辐射、组织分辨率高、多序列、多方位的成像之外,功能成像方法如如扩散加权成像(DWI)、灌注加权成像(PWI)等越来越成熟,特别是DWI,在小病灶的检出中具有很大价值,是动态增强检查的重要补充手段[3]。
DWI能在体反映水分子活动受限的情况,HCC由于肿瘤细胞增殖造成的细胞密度增加,导致水分子活动受限,因此在DWI上表现为高信号,ADC图上低信号(b值≥400 sec/mm2)。“扩散受限”也成为HCC诊断的一个重要的非血供特征(图2),而且有助于HCC和异形增生结节( DN)的区别。
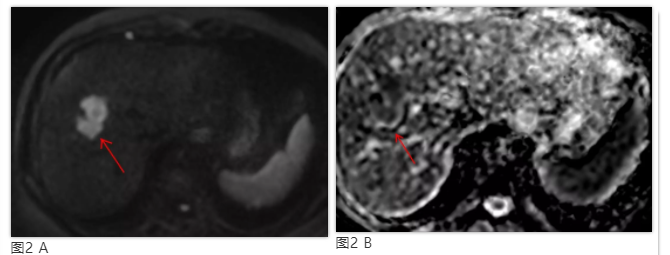
图2 肝脏右前叶 HCC,和图1为同一病例。DWI上(A)示肝脏S8段病灶为明显高信号(箭头),ADC图上(B)呈低信号,边界清楚(箭头)。
由于DN的血供改变比较复杂,可以是动脉期低强化的表现,也可以是门脉期和延迟期持续强化的表现,因此定性诊断较为困难。DWI上的表现有助于两者的鉴别,绝大多数DN表现为等、低信号或略高信号,和HCC的明显高信号有所不同[4]。
此外,DWI的检查也有助于动脉期“假强化”病灶的鉴别,因为血流动力学异常造成的“假强化”在DWI上往往是等信号的[5]。
3、包膜样强化
在高危病人中,“包膜样强化”也被认为是HCC诊断的一个非血供特征。包膜表现为病灶周边光滑的、均匀的环形结构,在增强后门脉期和延迟期或者是移行期(肝胆细胞特异性对比剂增强)有强化表现。真性包膜由纤维组织构成,但HCC常有假包膜出现,由病灶周围受压的肝组织形成。真性包膜和假包膜在影像学上难以鉴别,因此称为“包膜样强化”。包膜的出现在高危病人中对HCC诊断的特异性较大,而且有助于HCC和胆管细胞癌的鉴别,因此仍被看作是HCC诊断的一个主要征象[6](图3)。
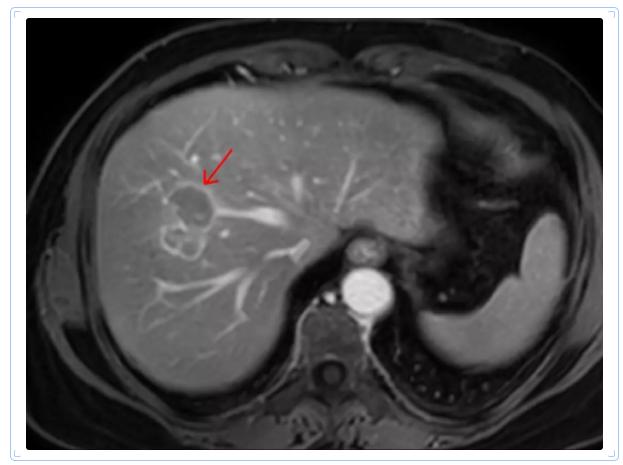
图3 肝脏右前叶 HCC,和图1为同一病例。MR动态增强扫描延迟期显示病灶呈不均匀低信号,边缘可见环形强化的包膜(箭头)。
二、HCC影像检查方法
新版《规范》强调了多期动态增强CT和多模态MRI扫描是肝脏超声和血清AFP筛查异常者的首选影像学检查方法。对于检出的结节,推荐的诊断工具包括US造影(CEUS)、动态增强CT、动态MRI(基于细胞外非特异性钆对比剂Gd-DTPA增强)和EOB-MRI(基于肝胆细胞特异性对比剂钆塞酸二钠的Gd-EOB-DTPA增强)。多期动态增强CT和动态增强MR包括动脉期、门脉期和延迟期,除了对比剂注射方案的严格制定之外,扫描期相的选择至关重要。动脉期往往是指动脉晚期,此时HCC病灶的强化最为明显,和背景肝实质之间的密度或信号差异最大,有利于病灶的检出和定性。延迟期的扫描延迟时间至少是3 min以后,此时可以进一步反映病灶强化廓清(wash-out)的改变,而且包膜的显示会更加清楚。
此外,新版《规范》中增加了“肝胆特异期常呈明显低信号”作为HCC诊断的依据之一。钆塞酸二钠Gd-EOB-DTPA是一种肝胆细胞特异性对比剂,静脉团注后早期可以用于观察病灶的血供信息(类似于常规使用的Gd-DTPA)。它还可以通过肝细胞膜上的有机阴离子转运多肽(OATP 1B3)吸收进入肝细胞(摄取率约50%),因此还可进行肝胆特异期成像(延迟20 min时)。90%的HCC不能摄取Gd-EOB-DTPA,在肝胆特异期呈低信号,因此不仅有助于HCC的诊断,而且在良恶性病灶的鉴别中也具有优势[7](图4)。
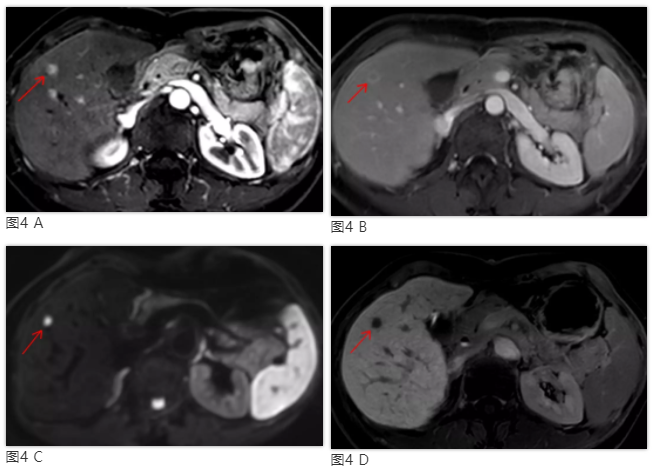
图4 肝脏右前叶 HCC。MR动态增强扫描动脉期(A)显示S5段病灶明显强化呈高信号(箭头)。移行期(B)病灶呈低信号,边缘可见环形强化的包膜(箭头)。DWI上(C)病灶为明显高信号(箭头)。肝胆特异期(D)病灶呈明显低信号,边界清楚(箭头)。
Renzulli等的研究结果显示,肝细胞特异性对比剂Gd-EOB-DTPA增强MRI肝胆特异期低信号、动脉期强化以及扩散受限三个征象联合,对HCC诊断的敏感度达到96%,特异度为91.8%,而且在高级别DN的诊断中,敏感度达94.7%,特异度达99.3%,充分显示了肝细胞特异性对比剂Gd-EOB-DTPA增强MRI在HCC诊断中的优势和潜能[8]。
随着模式识别、机器学习、深度学习等技术的迅速发展,基于影像学信息构建网络模型用于预测HCC的生物学行为、局部治疗疗效评价以及复发风险预测等等成为研究的热点。例如,微血管浸润(MVI)是评估肝癌复发风险和选择治疗方案的重要参考依据,已经作为常规病理检查指标。近年来有文献报道,基于CT或MR图像(包括肝胆特异期图像)结合临床信息建立模型,可预测MVI的情况,将在患者治疗方案的选择和预后预测方面提供补充信息[9-11]。该版《规范》中也特别增加了该方面内容,相信随着临床研究的不断深入和循证依据的不断增加,无创性影像学检查将会发挥更大的作用。
参考文献
1. Forner A, Vilana R, Ayuso C, et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma[J]. Hepatology, 2008, 47(1):97-104.
2. Bruix J, Sherman M. Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5):1208–1236.
3. Xu PJ, Yan FH, Wang JH, et al. Added value of breathhold diffusion-weighted MRI in detection of small hepatocellular carcinoma lesions compared with dynamic contrast-enhanced MRI alone using receiver operating characteristic curve analysis[J]. J Magn Reson Imaging, 2009, 29(2): 341-349
4. Xu PJ, Yan FH, Wang JH, et al. Contribution of diffusion-weighted magnetic resonance imaging in the characterization of hepatocellular carcinomas and dysplastic nodules in cirrhotic liver[J]. J Comput Assist Tomogr, 2010,34(4):506-512.
5. Vandecaveye V, De Keyzer F, Verslype C, et al. Diffusion-weighted MRI provides additional value to conventional dynamic contrast-enhanced MRI for detection of hepatocellular carcinoma[J]. Eur Radiol, 2009,19(10):2456-2466
6. Tang A, Bashir MR, Corwin MT, et al. Evidence supporting LI-RADS major features for CT and MR imaging–based diagnosis of hepatocellular carcinoma: A systematic review[J]. Radiology 2018, 286(1):29-48
7. Choi JY, Lee JM, Sirlin CB. CT and MR imaging diagnosis and staging of hepatocellular carcinoma. Part II. extracellular agents, hepatobiliary agents, and ancillary imaging features[J].
Radiology, 2014, 273(1):30-50
8. Renzulli M, Biselli M, Brocchi S, et al. New hallmark of hepatocellular carcinoma, early hepatocellular carcinoma and high-grade dysplastic nodules on Gd-EOB-DTPA MRI in patients with cirrhosis: a new diagnostic algorithm[J]. Gut, 2018, 67(9): 1674-82.
9. Xu X, Zhang HL, Liu QP, et al. Radiomic analysis of contrast-enhanced CT predicts microvascular invasion and outcome in hepatocellular carcinoma[J]. J Hepatol, 2019, 70(6): 1133-44.
10. Peng J, Zhang J, Zhang QF, Xu YK, Zhou J, Liu L. A radiomics nomogram for preoperative prediction of microvascular invasion risk in hepatitis B virus-related hepatocellular carcinoma[J]. Diagnostic and Interventional Radiology, 2018, 24(3): 121-127.
11. Feng ST, Jia YM, Liao B, et al. Preoperative prediction of microvascular invasion in hepatocellular cancer: a radiomics model using Gd-EOB-DTPA-enhanced MRI[J]. ER, 2019,29(9): 4648-4659
作者 | 严福华(上海交通大学医学院附属瑞金医院放射科)
编辑 | 郝冉(中国医学论坛报)

往期精彩内容
周俭教授 | 精准评估,优化治疗策略——原发性肝癌诊疗规范(2019年版)外科治疗部分解读
陈敏山教授 | 微创高效优势得到进一步认识——原发性肝癌诊疗规范(2019版)局部治疗部分解读
曾昭冲教授 | 与时俱进、注重临床操作性——原发性肝癌诊疗规范(2019年版)放疗部分解读
任正刚教授 | 权威性与实用性并举—— 原发性肝癌诊疗规范(2019版)内科治疗部分解读
查看更多