查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





慢性阻塞性肺疾病(慢阻肺,COPD)是一种常见的可防可治的呼吸系统疾病,以持续性呼吸道症状和气流受限为主要特征,常与有毒颗粒或气体的显著暴露引起气道和(或)肺泡异常有关。由于人口老龄化及持续暴露于慢阻肺危险因素,未来该疾病的发病率将持续增加[1]。了解慢阻肺的主要炎症机制,实现药物精准化治疗将有效降低慢阻肺患者所带来的的社会经济负担。

慢阻肺与哮喘,此炎非彼炎
慢阻肺与哮喘类似,都存在气道炎症浸润,但其气道炎症特点存在较大差异(图1)。慢阻肺患者气道炎症以中性粒细胞、CD8+ T淋巴细胞和巨噬细胞浸润为主,多种炎症细胞共同参与了肺实质的损害[2]。研究发现,CD8+T淋巴细胞的比例与FEV1呈负相关[3]。而哮喘患者主要以嗜酸性粒细胞、肥大细胞和 CD4+ T淋巴细胞浸润为主。组织中嗜酸性粒细胞增生与哮喘关系密切,活化的T辅助(CD4+)淋巴细胞可加剧这种慢性炎症[4]。
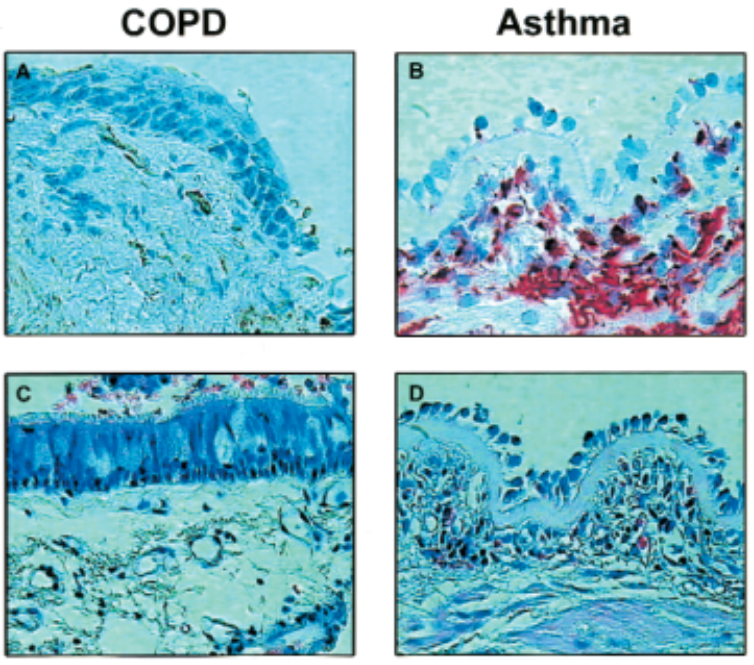
图1 慢阻肺(左)和哮喘(右)气道病理变化对比
除炎症细胞不同外,炎症介质也有所差异。IL-8是在慢阻肺形成中最为重要的介质[5],而哮喘发病的关键炎症因子为IL-1β和IL-4[6]。白细胞三烯(LTs)家族在慢阻肺和哮喘发病过程中均有重要作用,其中与慢阻肺有关的是白三烯B4[7],与哮喘有关的则主要是半胱氨酸白三烯[8]。另外值得一提的炎症介质为γ-干扰素,其在两种疾病中担任截然不同的角色,它可介导慢阻肺患者的炎症反应,而在哮喘患者中,却值得争议,有研究表明γ-干扰素对过敏性哮喘有治疗作用[9]。不同的气道炎症特点决定了慢阻肺和哮喘患者治疗原则也会有所差异。
炎症介质并非慢阻肺首选生物标志物
2001年,慢性阻塞性肺疾病全球倡议(GOLD)文件首次将慢阻肺定义为肺部“异常炎症反应”性疾病,提出慢阻肺主要是指具有不可逆气道阻塞的慢性支气管炎、肺气肿。但随着研究的深入,近年GOLD文件指出慢阻肺主要由于显著暴露于有毒颗粒或气体从而引起气道和(或)肺泡异常。目前慢阻肺公认的发病机制除了慢性炎症以外还包括弹性蛋白酶活性过高、氧化应激、细胞凋亡和自身免疫等,弹性蛋白交联的丧失、弹性纤维的微观断裂和肺泡壁的宏观断裂等肺泡结构性破坏是慢阻肺患者的主要病理表现(图2)[10, 11]。鉴于此,与炎症介质相比,结构成分如异锁链赖氨(DID)更能反映肺内渗透力的动力学,可能是更好的生物标志物。
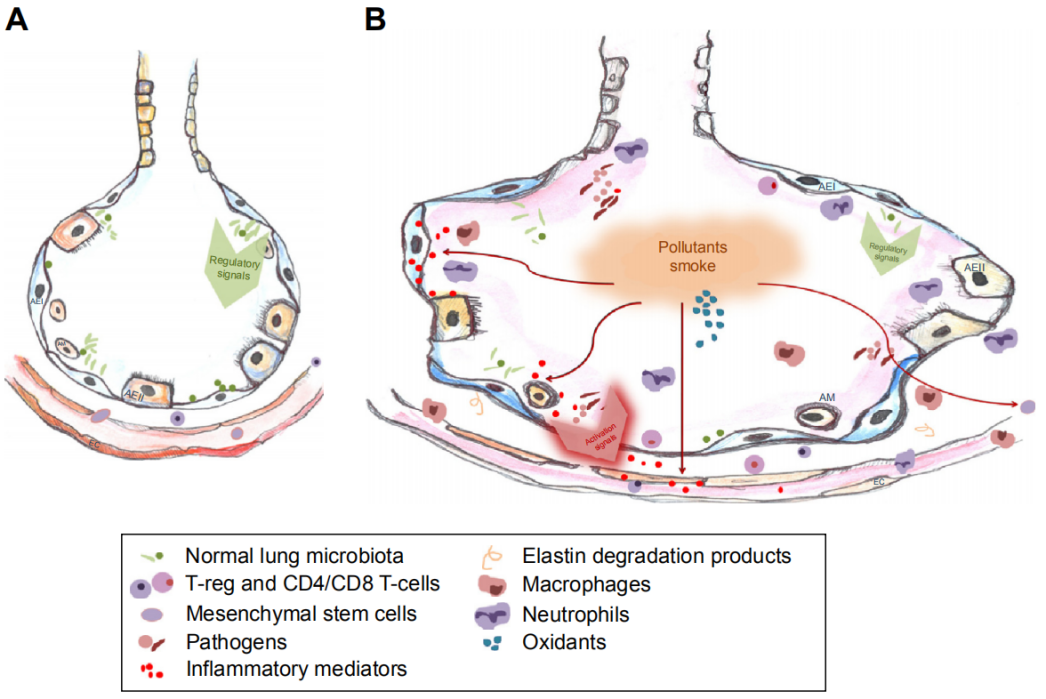
图2 慢阻肺发生发展的内在机制
糖皮质激素抗炎治疗用于慢阻肺和哮喘,获益相差大
如前所述,慢阻肺与哮喘的气道炎症特点存在显著差异,这决定了两者治疗原则必然有所不同。慢阻肺患者最常见的表型为嗜中性粒细胞表型,其主要与炎性小体激活、T1和T17介导的免疫反应有关[12]。少部分患者为嗜酸性粒细胞表型,主要与T2介导的免疫相关,而一些严重的病例可能与自身免疫有关[13]。哮喘患者最常见的表型为嗜酸性粒细胞表型[14]。有研究表明糖皮质激素对嗜酸性粒细胞型炎症疗效甚好[15],因而糖皮质激素是哮喘治疗的基石,而对于大部分慢阻肺患者,虽有研究发现联合吸入糖皮质激素和支气管扩张剂(支扩剂)可减少慢阻肺发作患者急性加重的频[16],但并不推荐单用吸入型糖皮质激素治疗慢阻肺。研究表明吸入大剂量糖皮质激素并不能延缓肺功能恶化,仅对少部分有嗜酸性粒细胞升高的慢阻肺患者有一定治疗效果,此外,长期吸入大剂量糖皮质激素甚至可能增加肺炎风险[13]。因此,抗炎并非慢阻肺患者的一线治疗策略,糖皮质激素在慢阻肺患者中的应用需结合患者是否有嗜酸性粒细胞升高,是否合并哮喘及急性加重频率进行综合评估。对慢阻肺而言,支扩剂才是改善稳定期慢阻肺患者症状的基石药物[18]。
从慢阻肺的发病机理解析支扩剂的基石地位
慢阻肺气流受限的病理机制包括肺实质肺气肿破坏引起的弹性回缩力降低及小气道重塑/破坏或二者共同的作用。其中,肺气肿降低弹性回缩力和小气道附着点破坏能够引起小气道呼气相塌陷;小气道重塑以上皮细胞异常生长、平滑肌肥大及黏膜化生特征,黏液分泌的增加可导致支气管管腔阻塞、上皮层增厚,气道表面张力的改变使其更倾向于呼气相塌陷,最终导致气流阻塞。研究表明,在肺功能尚未出现异常时,小气道管腔狭窄和数目减少已经发生,由此可见小气道管腔狭窄和丢失是慢阻肺患者的早期特征[17]。因此,舒张支气管,阻止气道塌陷是慢阻肺的主要治疗原则。
长效β2受体激动剂(LABA)及胆碱能受体拮抗剂(LAMA)是用于慢阻肺患者的有效支扩剂。LABA/LAMA主要作用于气道平滑肌细胞和神经节后副交感神经细胞,可相互协同促进支气管舒张。2020年GOLD指出,对于慢阻肺患者,在急性加重后出院之前即应尽快开始使用长效支气管扩张剂进行维持治疗[18]。
关于选择双支扩剂还是LABA/LAMA/ICS,亦有相关研究报道。英国一项针对55岁以上的慢阻肺患者队列研究发现,在慢阻肺治疗的真实临床实践中,LABA/LAMA在预防慢阻肺急性加重方面似乎与LABA/LAMA/ICS同样有效,并且能显著降低重症肺炎事件的发生(表1)[19]。
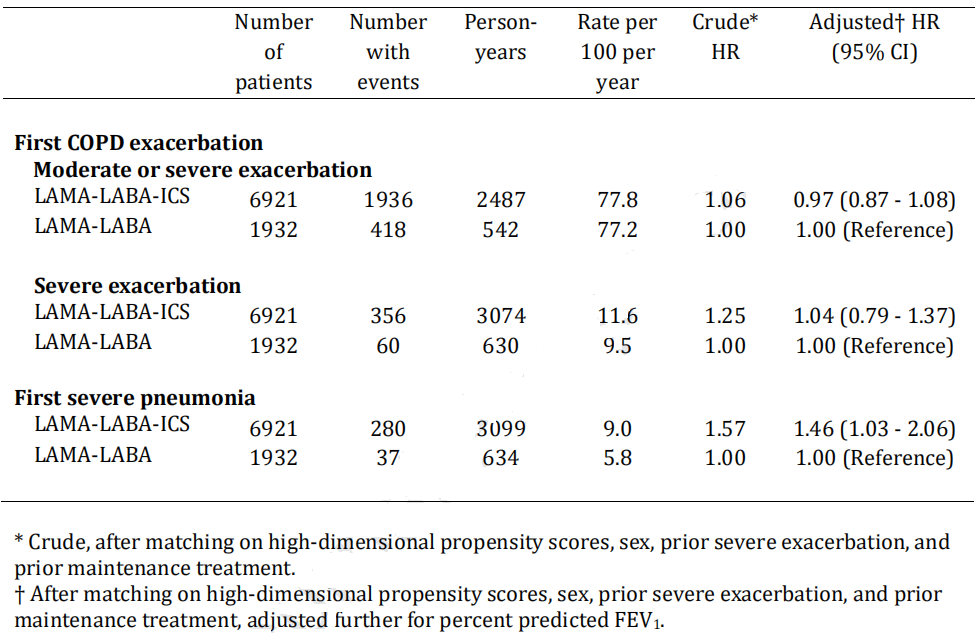
表1 LABA/LAMA/ICS组与LABA/LAMA组发生首次急性加重和首次严重肺炎情况的对比
SHINE研究显示[20],茚达特罗/格隆溴铵较单支扩剂能更快速、持续地改善中重度慢阻肺患者的肺功能。SPARK研究探索了伴有重度-极重度气流速受限的慢阻肺患者的优化治疗策略[21],证实茚达特罗/格隆溴铵较单支扩剂显著减少重度、极重度慢阻肺患者的急性加重、肺功能和健康状况。随机对照临床试验FLAME研究则显示[22],与茚达特罗/ICS相比,茚达特罗/格隆溴铵可更显著降低慢阻肺患者的急性加重,提示在选择联合治疗方案时,与LABA/ICS相比,LABA/LAMA可能是更好的治疗选择,在不降低疗效的同时,还具有更低的肺炎并发症风险。
对于是否需要联合吸入激素治疗,GOLD 2020增加了强烈支持、考虑使用和反对使用吸入激素的指征(图3)。

图3 开始使用ICS治疗时应考虑的因素
对于有长效支气管扩张剂维持治疗下仍有急性加重住院病史或者每年≥2次中度慢阻肺急性加重的患者,以及血嗜酸性粒细胞计数大于300 cells/ul或者有哮喘病史的患者强烈推荐联合使用糖皮质激素。对于每年存在1次中度慢阻肺急性加重或者血嗜酸性粒细胞在100-300 cells/ul之间的患者可考虑使用联合ICS。而对于反复发生肺炎事件和血嗜酸粒细胞小于100 cells/ul以及有分枝杆菌感染史的患者则强烈反对使用糖皮质激素,对于此类患者,可考虑在LAMA/LABA基础上使用罗氟司特等磷酸酯酶抑制剂或者阿奇霉素[18]。
小结:
慢阻肺是一种异质性疾病,气道炎症表型以嗜中性粒细胞表型为主,抗炎并非慢阻肺一线治疗策略,支扩剂才是慢阻肺稳定期维持治疗的基石药物,但若患者嗜酸性粒细胞显著升高或者双支扩剂联合治疗仍频繁急性加重,则可在支扩剂的基础上,联合使用ICS。简言之,了解慢阻肺患者的临床特点及炎症表型,有助于为患者制定个体化治疗方案,实现慢阻肺的精准医疗。
参考文献:
[1]Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006;3(11):e442.
[2]Sutherland ER, Martin RJ. Airway inflammation in chronic obstructive pulmonary disease: comparisons with asthma. J Allergy Clin Immunol 2003;112(5):819-27; quiz 28.
[3]Chen G, Zhou M, Chen L, Meng ZJ, Xiong XZ, Liu HJ, et al. Cigarette Smoke Disturbs the Survival of CD8+ Tc/Tregs Partially through Muscarinic Receptors-Dependent Mechanisms in Chronic Obstructive Pulmonary Disease. PLoS One 2016;11(1):e0147232.
[4]Muehling LM, Lawrence MG, Woodfolk JA. Pathogenic CD4(+) T cells in patients with asthma. J Allergy Clin Immunol 2017;140(6):1523-40.
[5]Di Stefano A, Capelli A, Donner CF. Role of interleukin-8 in the pathogenesis and treatment of COPD. Chest 2004;126(3):676-8.
[6]Barnes PJ. Cytokine modulators as novel therapies for asthma. Annu Rev Pharmacol Toxicol 2002;42:81-98.
[7]Seggev JS, Thornton WH, Jr., Edes TE. Serum leukotriene B4 levels in patients with obstructive pulmonary disease. Chest 1991;99(2):289-91.
[8]Leff AR. Regulation of leukotrienes in the management of asthma: biology and clinical therapy. Annu Rev Med 2001;52:1-14.
[9]Yoshida M, Leigh R, Matsumoto K, Wattie J, Ellis R, O'Byrne PM, et al. Effect of interferon-gamma on allergic airway responses in interferon-gamma-deficient mice. Am J Respir Crit Care Med 2002;166(4):451-6.
[10]MacNee W. Pathogenesis of chronic obstructive pulmonary disease. Proc Am Thorac Soc 2005;2(4):258-66; discussion 90-1.
[11]Bagdonas E, Raudoniute J, Bruzauskaite I, Aldonyte R. Novel aspects of pathogenesis and regeneration mechanisms in COPD. Int J Chron Obstruct Pulmon Dis 2015;10:995-1013.
[12]Hoenderdos K, Condliffe A. The neutrophil in chronic obstructive pulmonary disease. Am J Respir Cell Mol Biol 2013;48(5):531-9.
[13]Kanawati AJ, Narulla R, Lorentzos P, Graham E. Position of the sciatic nerve and effect of gluteus maximus release during hip arthroplasty. J Orthop 2017;14(2):281-6.
[14]Gibson PG. Inflammatory phenotypes in adult asthma: clinical applications. Clin Respir J 2009;3(4):198-206.
[15]Ortega H, Llanos JP, Lafeuille MH, Duh MS, Germain G, Lejeune D, et al. Effects of systemic corticosteroids on blood eosinophil counts in asthma: real-world data. J Asthma 2019;56(8):808-15.
[16]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014(3):CD010115.
[17]McDonough JE, Yuan R, Suzuki M, Seyednejad N, Elliott WM, Sanchez PG, et al. Small-airway obstruction and emphysema in chronic obstructive pulmonary disease. N Engl J Med 2011;365(17):1567-75.
[18]Global Initiative for Chronic Obstructive Lung Disease( GOLD). Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease. (update 2020).
[19]Suissa S, Dell'Aniello S, Ernst P. Comparative Effects of LAMA-LABA-ICS vs LAMA-LABA for COPD: Cohort Study in Real-World Clinical Practice. Chest 2020;157(4):846-55.
[20]Bateman ED, et al. Dual bronchodilation with QVA149 versus single bronchodilator therapy: the SHINE study.Eur Respir J.2013 Dec;42(6):1484-94.
[21]Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 co mpared with glycopyrronium and tiotropium (SPARK): a randomised, double-blind, parallel-group study.Lancet Respir Med. 2013 May;1(3):199-209.
[22]Wedzicha JA, et al. Indacaterol/glycopyrronium versus salmeterol/fluticasone in Asian patients with COPD at a high risk of exacerbations: results from the FLAME study.Int J Chron Obstruct Pulmon Dis.2017 Jan 19;12:339-349.
MCC号OTH20053289有效期2021-05-21,资料过期,视同作废。
查看更多