查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





尽管EGFR-TKI在治疗EGFR突变非小细胞肺癌(NSCLC)患者中表现出优异的疗效,但不可避免会产生耐药性,让后续治疗面临重重困难。
同济大学附属上海市肺科医院团队和上海交通大学附属上海市胸科医院团队联合开展的一项双中心回顾性研究,纳入了2015年1月至2020年12月期间就诊的EGFR突变晚期NSCLC患者,比较了EGFR-酪氨酸激酶抑制剂(TKI)耐药后化疗联合抗血管生成治疗和化疗联合免疫治疗的疗效,评估客观缓解率(ORR)、疾病控制率(DCR)和无进展生存(PFS)期。
文章近期发表在肺癌转化研究专刊Translational Lung Cancer Research(IF=6.498)在线发表,同济大学附属上海市肺科医院肿瘤科俞昕博士、叶伶云医生与上海交通大学附属上海市胸科医院呼吸科李嘉琪硕士为本文的共同第一作者,同济大学附属上海市肺科医院肿瘤科副主任苏春霞教授、上海交通大学附属上海市胸科医院呼吸科储天晴教授为本文的共同通讯作者。


本文邀请两位专家分享研究详情、阐述研究心得,从而为今后我国肺癌诊疗与探索提供新的思路和循证研究证据。
回顾性收集上海市肺科医院和上海市胸科医院接受EGFR-TKI耐药后接受化疗联合抗血管生成治疗或化疗联合免疫治疗的EGFR突变晚期NSCLC患者的病历资料。
将患者分为化疗联合抗血管生成治疗组和化疗联合免疫治疗组,比较两组的客观缓解率(ORR)、疾病控制率(DCR)和无进展生存期(PFS),并利用Cox回归模型对临床参数进行单因素和多因素生存分析。
1)了解真实世界中NSCLC患者的EGFR-TKI疗效和EGFR-TKI耐药后的T790M状态
在144例患者中,131例(91.0%)接受EGFR-TKI作为单一治疗,13例(9.0%)接受了EGFR-TKI联合治疗,包括联合抗血管生成治疗(6,4.2%)、放疗(5,3.5%) 和化疗(2,1.4%);139例患者(96.5%)接受了一代EGFR-TKI治疗,5例患者(3.5%)接受了二代EGFR-TKI治疗。
患者接受EGFR-TKI治疗的ORR和DCR分别为60.2%和93.2%,中位PFS期为10.42个月。这些结果与先前研究中报道的第一和第二代TKI的疗效一致。在EGFR-TKI耐药后,29例患者(20.1%)检测到T790M突变。其中,23例患者(79.3%)接受了三代 EGFR-TKI作为后续治疗。
2)探索EGFR-TKI耐药后接受化疗联合抗血管生成治疗和化疗联合免疫治疗的疗效
在EGFR-TKI治疗进展后,与化疗联合抗血管生成治疗相比,化疗联合免疫治疗患者的ORR更高(29.5%对13.0%,P=0.017);但两者之间的DCR相似(93.0%对88.6%,P=0.585);同时,化疗联合免疫治疗组的中位PFS稍长,但未达到统计学差异(7.59个月对6.90个月,P=0.552,HR=0.875,95% CI:0.565~1.355)。在数据截止时,总生存期(OS)数据尚未成熟。
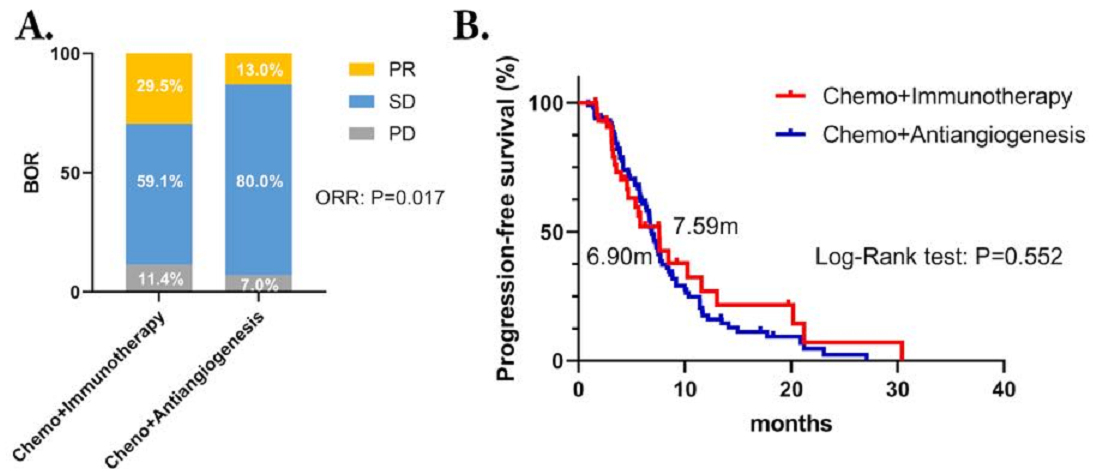
图1 接受化疗联合抗血管生成治疗和化疗联合免疫治疗的患者的BOR 和PFS
在接受化疗联合抗血管生成治疗组中,19del和L858R突变患者的ORR和PFS期没有显著差异(ORR:10.9%对11.8%,P=1.000;中位PFS期:7.74个月对7.30个月),P=0.702,HR=0.920, 95% CI: 0.594~1.426)。此外,该组 TKI耐药后T790M阳性和T790M阴性患者的ORR和PFS也相仿(ORR:9.5%对13.2%,P=0.942;中位PFS期:5.33个月对7.46个月,P=0.202,HR=1.459,95% CI:0.737~2.890)。
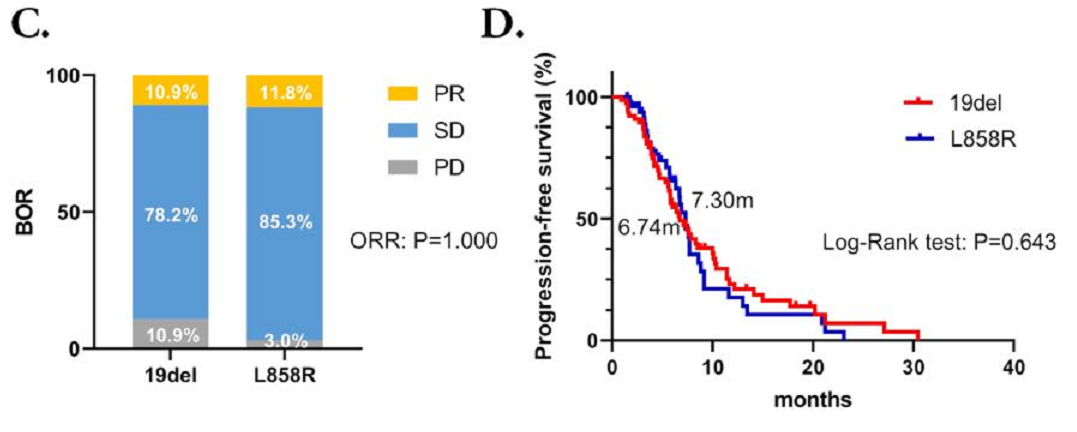
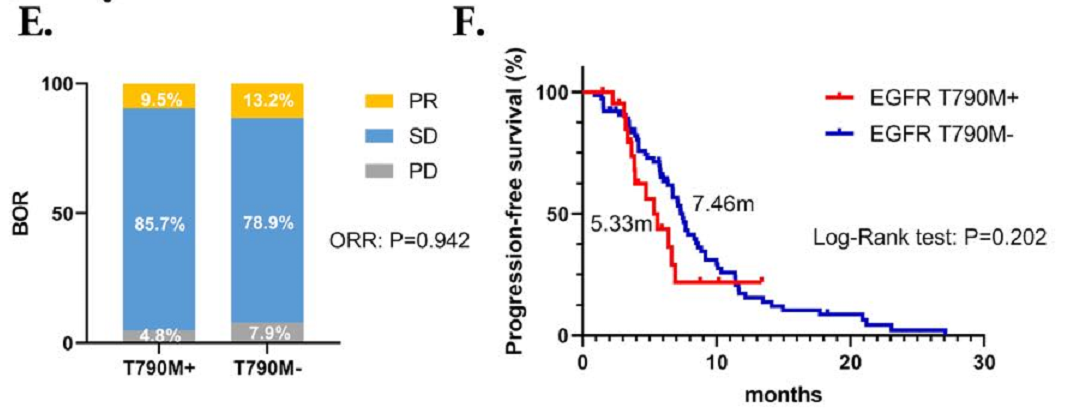
图2 接受化疗联合抗血管生成治疗患者的BOR和PFS情况
(C,D) 接受化疗联合抗血管生成治疗的19del和L858R突变患者的BOR和PFS;(E,F) 接受化疗联合抗血管生成治疗的T790M阳性和阴性患者的BOR和PFS
而对于接受化疗联合免疫治疗的患者,L858R突变患者的ORR和PFS期优于19del突变的患者,但无显著性差异(ORR:33.3%对22.7%,P=0.438;中位PFS期:7.59个月对5.65个月,P=0.798,HR=0.899,95% CI:0.392~2.059)。值得注意的是,对于EGFR-TKI治疗后发生T790M突变的患者,从化疗联合免疫治疗中获益十分有限(ORR:14.3%对32.4%,P=0.608;中位PFS期:3.42个月对7.63个月,P=0.028,HR=3.028,95% CI:0.575~15.94)。
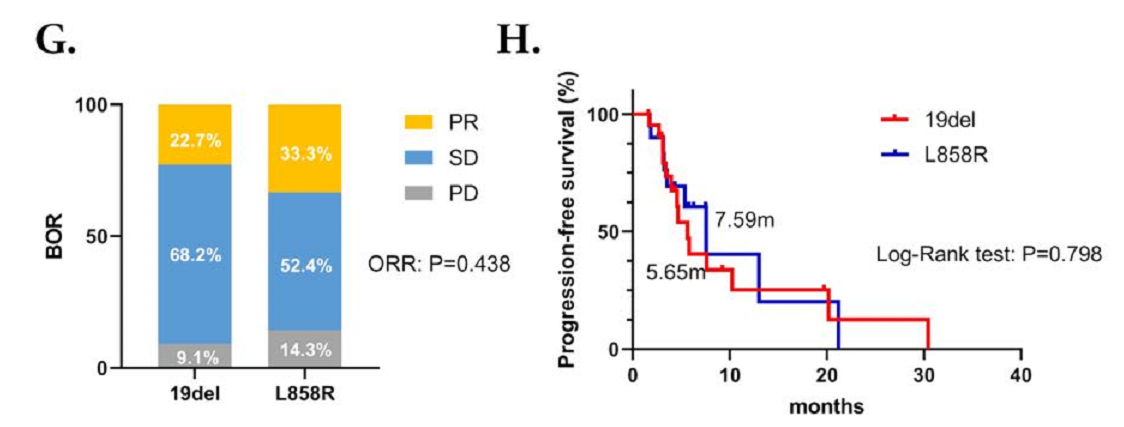
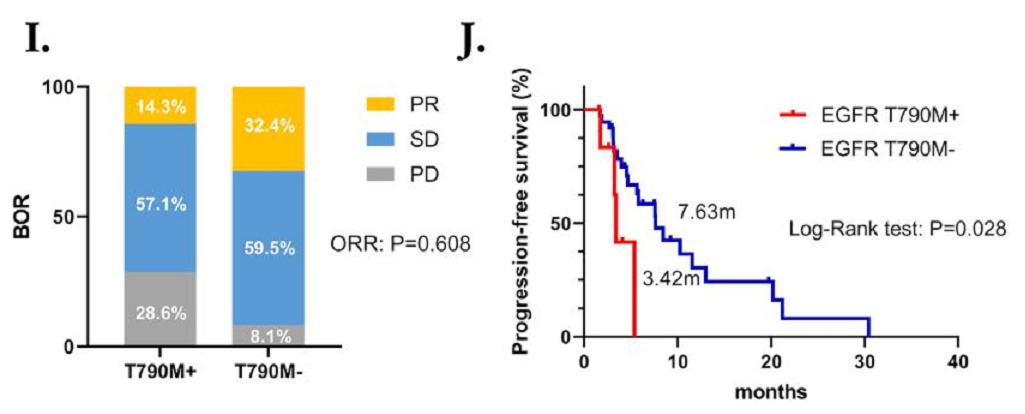
图3 接受化疗联合免疫治疗患者的BOR和PFS情况
(G,H) 接受化疗联合免疫治疗的19del和L858R突变患者的BOR和PFS;(I,J) 接受化疗联合免疫治疗T790M阳性和阴性患者的BOR和PFS
3)EGFR-TKI耐药后患者临床参数的单因素和多因素生存分析
在化疗联合抗血管生成治疗组中,单因素分析显示,年龄、性别、TKI的中位PFS期、淋巴细胞计数、中性粒细胞计数、单核细胞计数、嗜酸性粒细胞计数、血小板计数、血小板与淋巴细胞比值(PLR)均与PFS期有相关性。然而,多因素分析表明,只有血小板计数≤373×109/L是PFS期的独立预后因素(P=0.037,HR=0.334,95% CI:0.119~0.937)。
在化疗联合免疫治疗组中,单因素分析显示,TKI耐药后T790M状态、淋巴细胞计数、中性粒细胞计数、嗜酸性粒细胞计数、血小板计数、中性粒细胞与淋巴细胞比值(NLR)、单核细胞与淋巴细胞比值(MLR)、和PLR均与PFS期有相关性。多因素分析表明血小板计数≤264×109/L与较长的PFS期相关(P=0.028,HR=0.256,95% CI:0.076–0.865),这与化疗联合抗血管生成治疗组的结论类似。
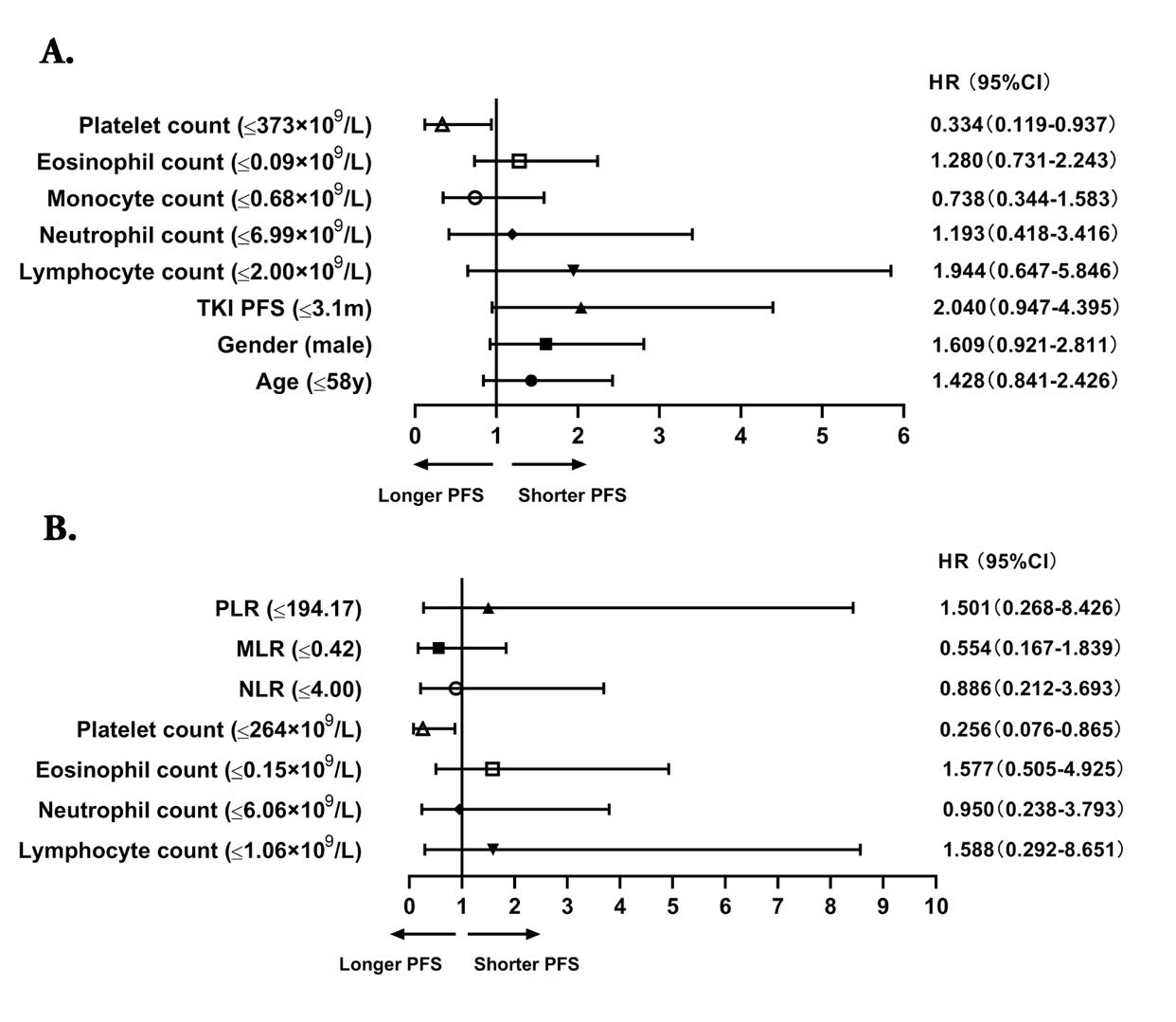
图4 与PFS相关的临床参数的森林图
(A) 化疗联合抗血管生成治疗组中与PFS相关的临床参数的多变量分析森林图; (B) 化疗联合免疫治疗组中与PFS相关的临床参数的多变量分析森林图
这些发现表明,血小板计数可能是EGFR突变的晚期NSCLC患者经EGFR-TKI治疗后疾病进展的潜在预后因素,应在OS期分析中进一步验证。
一线TKI治疗失败后,二线及后线化疗的PFS期显著缩短。
AURA3研究报道了在T790M阳性人群中铂类联合培美曲塞治疗的中位PFS期为4.4个月,IMPRESS研究报道了铂类双药化疗联合或不联合吉非替尼的中位PFS期为5.4个月。本研究结果表明,化疗联合抗血管生成治疗和化疗联合免疫治疗的中位PFS期在所有患者中相似,且优于先前报道的单化疗组,这表明两种方案都可作为EGFR-TKI失败后的治疗手段。此结果也与IMpower150亚组分析结果一致,在先前接受过治疗的EGFR阳性患者中,ACP组与BCP组中位PFS期分别为5.7和6.1个月。本研究也是目前样本量最大的评估化疗联合抗血管生成治疗和化疗联合免疫治疗在TKI治疗失败后晚期NSCLC患者中疗效的研究。
一项日本研究表明,纳武利尤单抗在EGFR-TKI治疗耐药后T790M阴性患者中具有较好的疗效,这可能是由于该组中患者的PD-L1表达水平较高。我们的研究表明,在EGFR-TKI治疗进展后,化疗联合免疫治疗对T790M阴性患者的疗效优于T790M阳性患者。值得注意的是,队列中接受化疗联合免疫治疗的7例T790M阳性患者之前均接受过奥希替尼治疗,这表明对于T790M阳性患者而言,即使在接受奥希替尼治疗后,化疗联合免疫治疗也不是合适的治疗选择。
除了EGFR T790M突变外,有研究观察到EGFR L858R突变患者接受免疫治疗的缓解率和OS优于EGFR 19del突变患者。另一项评估27例EGFR突变患者接受免疫治疗的研究发现,具有罕见EGFR突变(如 G719X和20外显子插入)的患者缓解率最佳。这些现象提示了EGFR等位基因对免疫治疗响应的潜在差异。
在EGFR突变的分子异质性这一因素基础上,其他因素也被认为是影响免疫检查点抑制剂在EGFR突变NSCLC中的疗效的原因。一项日本回顾性研究表明,对EGFR-TKI响应超过10个月的患者对免疫检查点抑制剂的反应差于对EGFR-TKI缓解少于10个月的患者。类似地,对EGFR-TKI反应不佳的患者,肿瘤组织表现为高免疫原性,表明这些患者可能受益于免疫治疗。然而,在本研究中没有发现类似的趋势。
此外,一项来自意大利队列的结果表明,吸烟者与从不吸烟者接受免疫检查点抑制剂治疗的潜在获益可能不同,这可能是由于TMB或 PD-L1 表达的差异所导致的。另有研究表明CD73高表达提示EGFR突变NSCLC患者对ICI治疗的良好反应。因此,需要更深入地了解TME并进一步研究免疫治疗的生物标志物,以优化EGFR突变NSCLC患者的治疗方式。
为EGFR突变NSCLC患者TKI治疗进展选择后线治疗方案是一个巨大的挑战。
化疗联合抗血管生成治疗或免疫治疗是目前有希望的治疗模式,尤其是对于耐药机制未知的患者。对于已知的耐药机制,EGFR-TKI联合其他小分子抑制剂、抗EGFR单克隆抗体和全身治疗可能是更好的发展方向。此外,高效的新一代EGFR-TKI也有望克服耐药,但需要更多的临床试验来评估其有效性和安全性。
本研究另一个有趣的发现是血小板计数可能是TKI耐药后EGFR突变晚期NSCLC 患者的潜在预后因素。
类似地,在一组EGFR阳性NSCLC患者中,发现两周期EGFR-TKI治疗后血小板计数减少与较长的OS期独立相关。副肿瘤性血小板增多症与许多实体瘤相关,并表现出生存率降低。血小板与肿瘤扩增的各个阶段相关,包括局部生长、入血和转移。从机制上说,血小板和肿瘤细胞之间存在反馈回路,肿瘤可以通过各种分子途径刺激血小板的产生和活化,而活化的血小板又可以促进肿瘤生长。因此,血小板计数升高作为有意义的临床参数,可能预示着预后不佳,可用于建立EGFR-TKI治疗进展后NSCLC患者的预后模型。
本项研究表明,对于既往EGFR-TKI治疗失败的患者,化疗联合抗血管生成治疗和化疗联合免疫治疗均可作为有效的后续治疗选择。对于790M阳性患者,化疗联合抗血管生成治疗可能是更好的选择。该研究的局限性包括其为回顾性分析,没有进行随机化,用于化疗、免疫治疗和抗血管生成治疗的药物也缺乏一致性。此外,在数据截止时,两组的OS期数据尚未成熟,需要进一步随访。这些结论需要在更大人群中进行前瞻性研究。


EGFR突变NSCLC患者接受EGFR- TKI后产生耐药是这类患者治疗的难点,既往研究表明这类患者接受免疫单药治疗的疗效不理想。
一项II期的CT18研究展示了免疫联合治疗在EGFR-TKI耐药后的获益,IMPOWER150研究表明化疗联合免疫联合抗血管生成治疗的4药联合或可为这部分患者带来更多获益,抗血管药物在其中扮演了很重要的免疫增敏作用。目前化疗联合抗血管生成治疗与化疗联合免疫治疗在这部分人群中孰优孰劣,尚无头对头的研究证实。
这项回顾性研究独树一帜,观察真实世界中该类患者的临床处理问题,研究结果发现化疗联合抗血管或者免疫治疗并未分出伯仲,均在TKI治疗失败的EGFR突变NSCLC的后线治疗中有生存获益。
2021年世界肺癌大会(WCLC)上的一项II期研究公布了帕博利珠单抗联合卡铂和培美曲塞在既往接受过靶向治疗的EGFR突变NSCLC患者的疗效,ORR为42%,中位PFS期为8.3个月,中位OS期达到22.2个月。目前免疫联合治疗的大型Ⅲ期研究正在推进中,希望为这类患者找到更佳的克服耐药的治疗模式。


对于驱动基因阳性的晚期NSCLC患者来说,EGFR-TKI耐药后如无新的再突变靶点出现,化疗或者化疗加上抗血管药物为其标准治疗方案。然而随着近年免疫治疗的逐步广泛应用,对于这类人群能否使用免疫治疗成为临床研究的焦点。
由于前期EGFR突变患者初治领域免疫治疗的探索,如帕博利珠单抗单药、纳武利尤单抗单药、纳武利尤单抗+化疗,双免疫联合,甚至免疫治疗+TKI等研究结果几乎全军覆没,因此,目前EGFR-TKI依然是这些患者的首选治疗。
然而,幸运的是,在TKI耐药后使用免疫治疗的探索初见成效。从ATLANTIC研究中durvalumab单药靶向后治疗PD-L1≥25%的患者看到曙光,到著名的IMpower 150研究,其中14%的驱动基因阳性患者在TKI耐药后使用四药免疫+抗血管+化疗的方案,获得了PFS期和OS期的延长。这类EGFR-TKI耐药后免疫联合治疗的研究层出不穷。然而真实世界数据尚不足。
我们和苏春霞教授团队合作的这项研究就是想了解EGFR-TKI耐药后患者如果采用免疫联合化疗,那么和传统的抗血管联合化疗相比,会有怎样的临床特征及结果的不同。经过比较,我们的研究不仅得出了非常有趣的上述结果,还引出一些值得进一步探索的新的方向,比如EGFR突变亚型、血小板计数等对于疗效的影响等。这次的合作非常愉快,我们和苏教授团队将会继续一起努力,希望多做一些有意义的探索性工作。
本文由 苏春霞教授 审阅
中国医学论坛报 刘芊 整理
查看更多