查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





11月10日,国家食品药品监管局药品评审中心组织编制的《中国新药注册临床试验现状年度报告(2020 年)》发布。
一个新药的问世,从新药研发伊始的病理、毒理实验,到申报新药注册再到正式上市应用,药物临床试验是整个转化过程中最关键、最重要的环节。为全面掌握中国新药注册临床试验进展,推动中国新药临床试验高质量健康发展,《中国新药注册临床试验现状年度报告(2020 年)》,从申办者类型、药物类型、试验品种、适应证、试验分期、特殊人群试验、临床试验的组长单位、启动耗时和完成情况等角度对临床试验的总体趋势变化、主要特点、突出问题等汇总分析而成。
对中国新药注册临床试验现状进行全面汇总分析,编制发布年度报告,在中国药品监管史上这还是第一次。通过这份年度报告,可以基本完整全面了解到,中国年度新药注册临床试验现状。
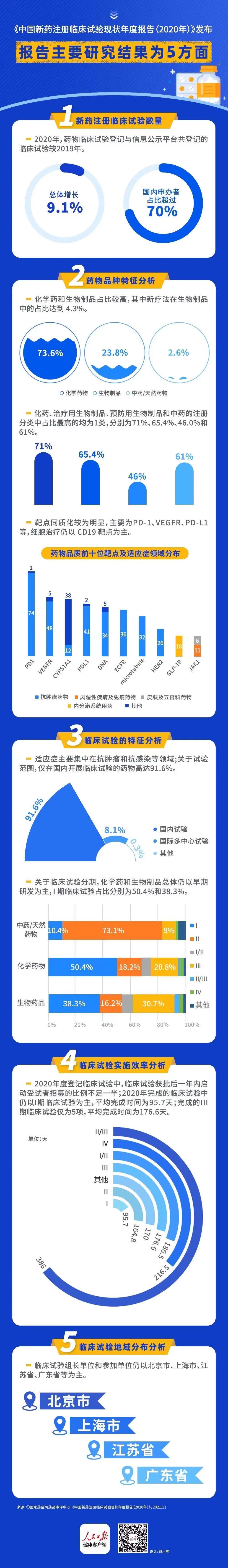
从新药注册临床试验数量上披露,2020 年,药物临床试验登记与信息公示平台共登记的临床试验,较 2019 年总体增长 9.1%,国内申办者占比超过 70%。
从药物品种特征上分析,化学药(约 占73.6%)和生物制品(23.8%)占比较高,其中新疗法在生物制品中的占比达到 4.3%;化药、治疗用生物制品、预防用生物制品和中药的注册分类中占比最高的均为1 类,分别为 71%、65.4%、46.0%和 61%;靶点同质化较为明显,主要为 PD-1、VEGFR、PD-L1 等,细胞治疗仍以 CD19 靶点为主。
从临床试验的特征显示,适应证主要集中在抗肿瘤和抗感染等领域;关于试验范围,仅在国内开展临床试验的药物高达 91.6%;关于临床试验分期,化学药和生物制品总体仍以早期研发为主,I 期临床试验占比分别为 50.4%和 38.3%;受试者人群中,特定人群开展的临床试验相对较少,2020 年在老年人群和儿童人群开展的临床试验分别为 3 项和 33 项,仅占全年试验登记总量的 1.4%。
从临床试验实施效率上表明,2020 年度登记临床试验中,临床试验获批后一年内启动受试者招募的比例不足一半(45.4%);2020 年完成的临床试验中仍以 I 期临床试验为主,平均完成时间为 95.7 天;完成的 Ⅲ 期临床试验仅为 5 项,平均完成时间为 176.6 天。
从临床试验地域分布发现,临床试验组长单位和参加单位仍以北京市、上海市、江苏省、广东省等为主。
2020 年登记的药物临床试验总体上主要由国内申办者发起,试验范围以在国内开展试验为主,试验分期中 I 期试验比例最高。中国新药临床试验的数量和药物品种的数量相较以往都大幅增加,同时 1 类新药占比较高,但药物靶点和适应证领域分布较为集中,显示我国药物临床试验迅速发展的同时存在临床试验同质化的问题。临床试验效率等分析结果显示我国临床试验存在获批后的实施效率不高、儿科药物临床试验占比较低、临床试验地域分布不均匀等挑战。
按年度报告新药注册临床试验情况,以中国新药注册临床试验登记数据为依托,及时对外公开临床试验进展信息,不仅为业界新药研发、资源配置和药品审评审批提供参考,也为聚焦监管创新,探索运用信息化手段提升药品监管效能,推动中国新药临床试验高质量健康发展提质升级。
来源:人民日报健康客户端 作者 赵广泉
查看更多