查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





PD-1/PD-L1抑制剂已经彻底改变了各类型肿瘤的治疗方案,尤其是非小细胞肺癌(NSCLC)。尽管PD-1/PD-L1抑制剂治疗前景乐观,但仍有很大一部分晚期NSCLC患者对该抑制剂耐药。临床前和临床试验证明,放疗可诱导全身抗肿瘤免疫反应,具有使难治性“冷”肿瘤对免疫治疗敏感的巨大潜力。立体定向放射治疗(SBRT)作为一种新型的放射治疗方式,在各种实体瘤中显示出良好的抗肿瘤作用,且可能因为更强大的免疫激活作用而优于常规放疗。因此,PD-1/PD-L1抑制剂联合SBRT可能使NSCLC患者获得更好的生存结局。
对此,于金明教授团队近日在J Hematol Oncology (IF 11.059)发表综述SBRT combined with PD-1/PD-L1 inhibitors in NSCLC treatment: a focus on the mechanisms, advances, and future challenges,向我们阐述了SBRT联合PD-1/PD-L1抑制剂的潜在机制和最新进展,并且介绍了现存的一些挑战和未来值得进一步研究的方向。
SBRT和PD-1/PD-L1抑制剂在抗肿瘤免疫中的潜在机制
SBRT和PD-1/PD-L1抑制剂在抗肿瘤免疫中的免疫调节机制揭示了两者在肿瘤治疗中的潜在协同效应。SBRT和PD-1/PD-L1抑制剂的联合应用不仅可以增强正性免疫调节作用,还可以显著减弱负性免疫抵抗,从而有望获得优越的生存预后(图1)。
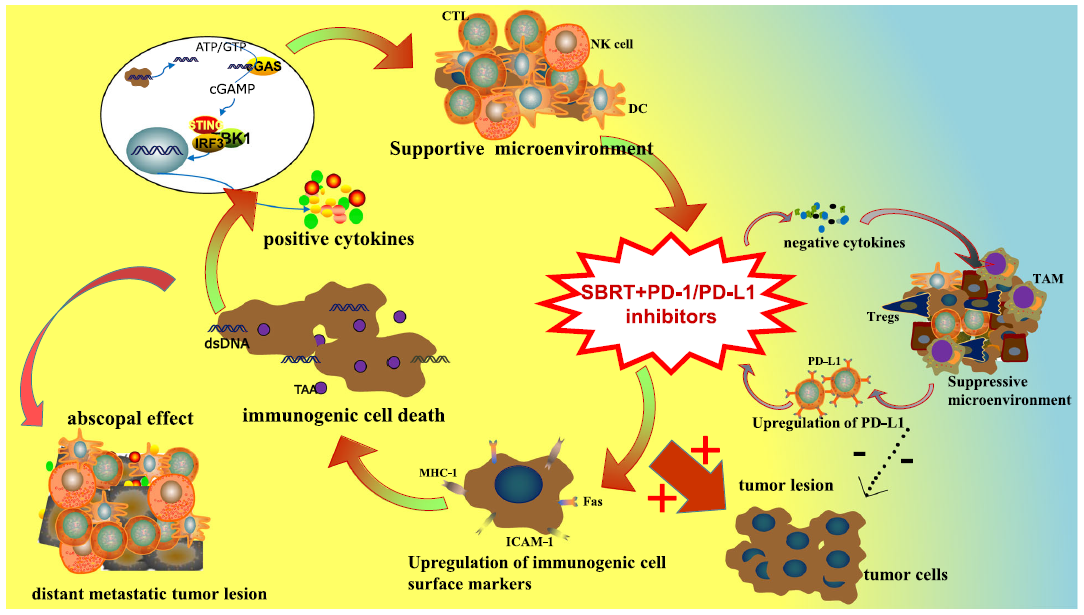
图1 SBRT联合PD-1/PD-L1抑制剂的具体机制。支持性调控机制包括上调免疫原性细胞表面标志物如ICAM-1、MHC-1和Fas,诱导免疫原性细胞死亡,释放肿瘤抗原和细胞因子如IFN、TNF-α、IL-1、IL-6等,增强免疫细胞对肿瘤的归巢。值得注意的是,激活的免疫反应可以进一步作用于远处的非照射转移灶,明显抑制转移灶的进展。此外,SBRT还可以诱导免疫抑制作用,包括增加TGF-β等负性细胞因子的释放,抗放射抑制细胞的积累,以及PD-L1表达的上调。将PD-1/PD-L1抑制剂整合到SBRT中,不仅可以增强正向免疫调节,还可以显著减弱负向免疫抵抗,从而实现强效抗肿瘤免疫。消除剩余的抑制作用存在挑战。
SBRT联合PD-1/PD-L1抑制剂治疗NSCLC的进展
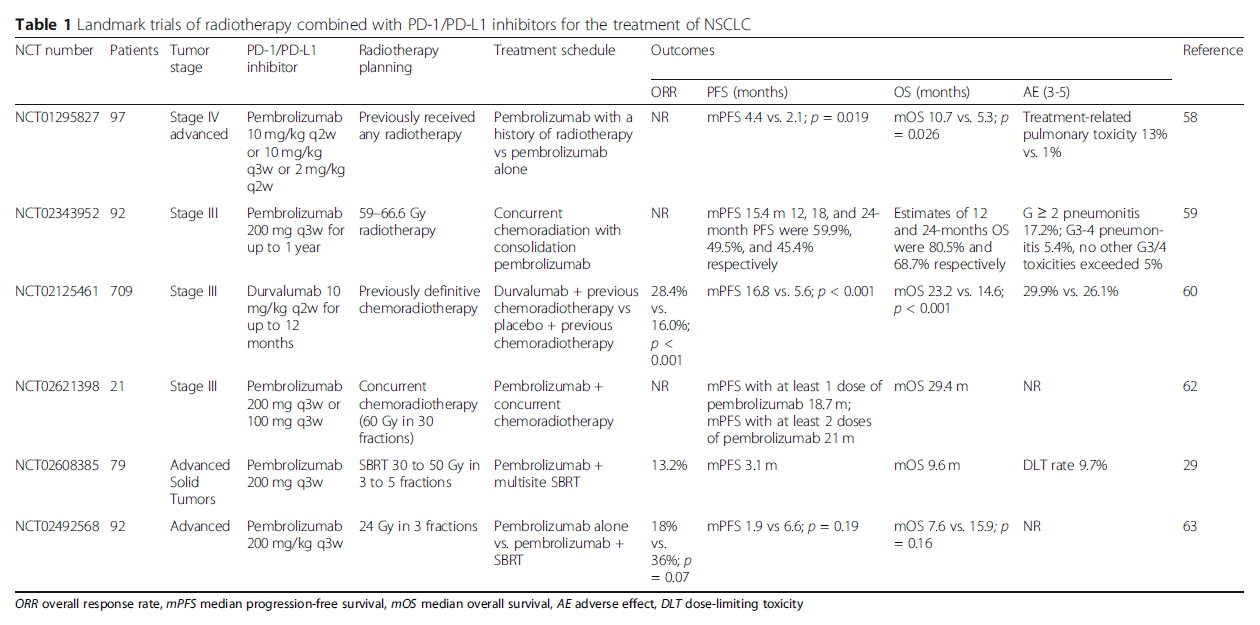
对于传统放疗联合PD-1/PD-L1抑制剂的临床试验,不少研究证实了其可行性,且毒性可控(表1)。在I期研究KEYNOTE-001的二次分析中,PD-1抑制剂帕博利珠单抗在之前接受过任何放疗的患者中,比没有接受过放疗的患者获得更长的PFS和OS(mPFS,4.4 vs. 2.0个月;OS,10.7 vs. 5.3个月;P = 0.034)。III期PACIFIC研究比较了PD-L1抑制剂度伐利尤单抗作为巩固治疗与安慰剂在两个或两个以上周期化放疗后没有疾病进展的晚期NSCLC患者中的作用,与安慰剂相比,度伐利尤单抗治疗可获得更长的mPFS(16.8 vs. 5.6个月)和更高的总反应率(ORR)(28.4% vs. 16.0%;P <0.001)。ETOP NICOLAS试验证明了同时使用纳武利尤单抗联合放化疗对不可切除的III期NSCLC的治疗可行性,且毒性可控。
鉴于越来越多的研究证实SBRT的疗效优于传统放疗,临床试验研究开始探讨SBRT联合PD-1/PD-L1抑制剂是否能获得大幅提高的临床获益。一项I期研究评估了多部位SBRT后再使用帕博利珠单抗治疗包括NSCLC在内的转移性实体瘤,该试验中入组的患者接受标准SBRT治疗2~4个转移灶,剂量为30~50 Gy,分3~5次给药,帕博利珠单抗在最后一次SBRT分量后7天内给药。联合治疗在辐照肿瘤中取得了很高的控制率,而在非辐照转移中同样取得了反应,总体ORR为13.2%,mOS和mPFS分别为9.6个月(95%CI,6.5个月至未达到)和3.1个月(95%CI,2.9个月至3.4个月)。同样,一项多中心、随机II期研究也评估了帕博利珠单抗治疗前对单个肿瘤部位进行SBRT是否能增强转移性NSCLC患者的抗肿瘤免疫反应,在这项研究中,入组患者被随机分配到对照组(n = 40)或实验组(n = 36),治疗安排为单独使用帕博利珠单抗(对照组)或在SBRT(3个剂量8 Gy)后使用(实验组)。结果显示,SBRT联合帕博利珠单抗治疗的患者比单独使用帕博利珠单抗治疗的患者具有更好的mPFS和mOS(分别为6.6个月 vs. 1.9个月,P = 0.19;15.9个月 vs. 7.6个月,P = 0.16)。尤其是PD-L1阴性的NSCLC患者,观察到联合治疗获得的获益最大,mPFS和mOS差异有统计学意义。此外,2019年ASTRO公布了一项针对帕博利珠单抗治疗进展后接受SBRT的转移性NSCLC患者的II期前瞻性试验结果,在该试验入组的56例患者中,有21例患者在接受帕博利珠单抗治疗后出现疾病进展,并接受SBRT治疗。最终结果报道,在PD-1抑制剂进展后加用SBRT可使PFS增加,全身反应率为9.52%,疾病控制率为57.14%。虽然目前完成的研究相对较少,但令人印象深刻的疗效已经引起了人们开发和开展更多临床试验的巨大热情。
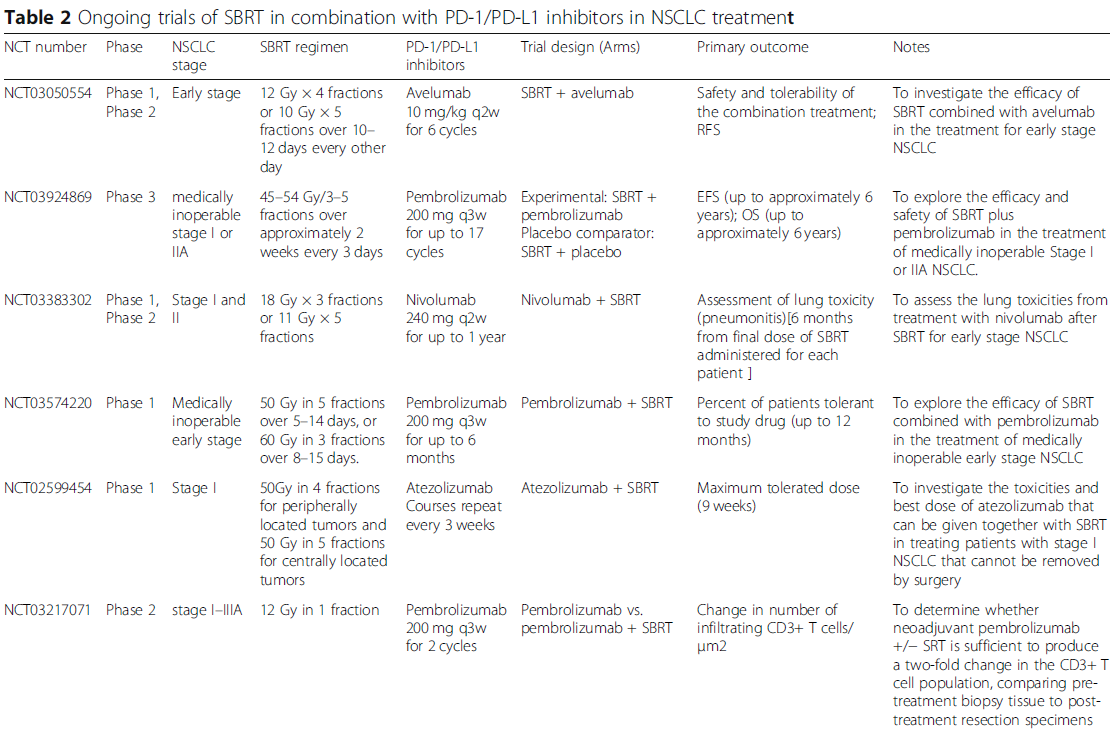
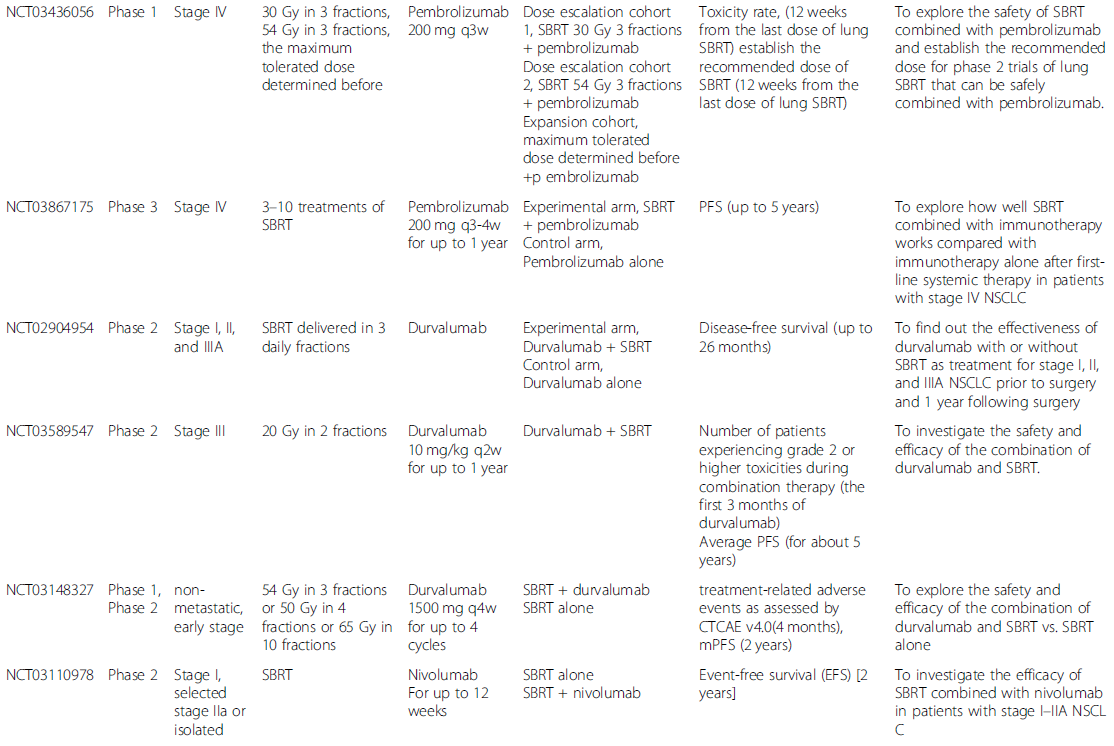
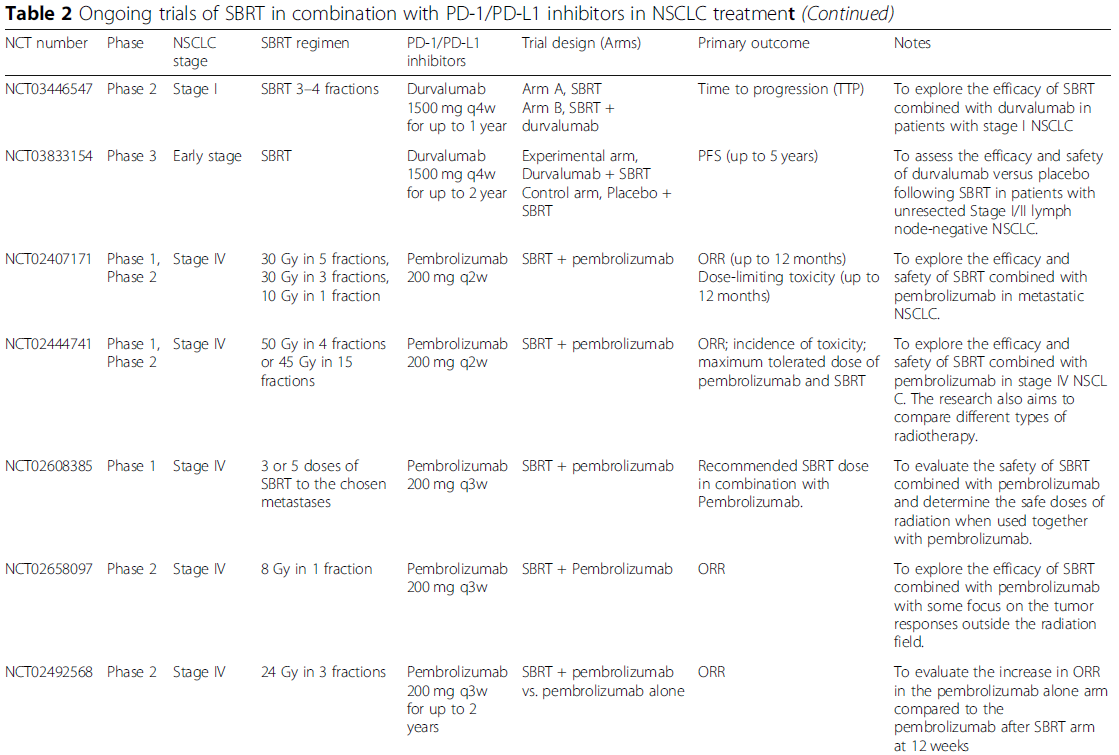
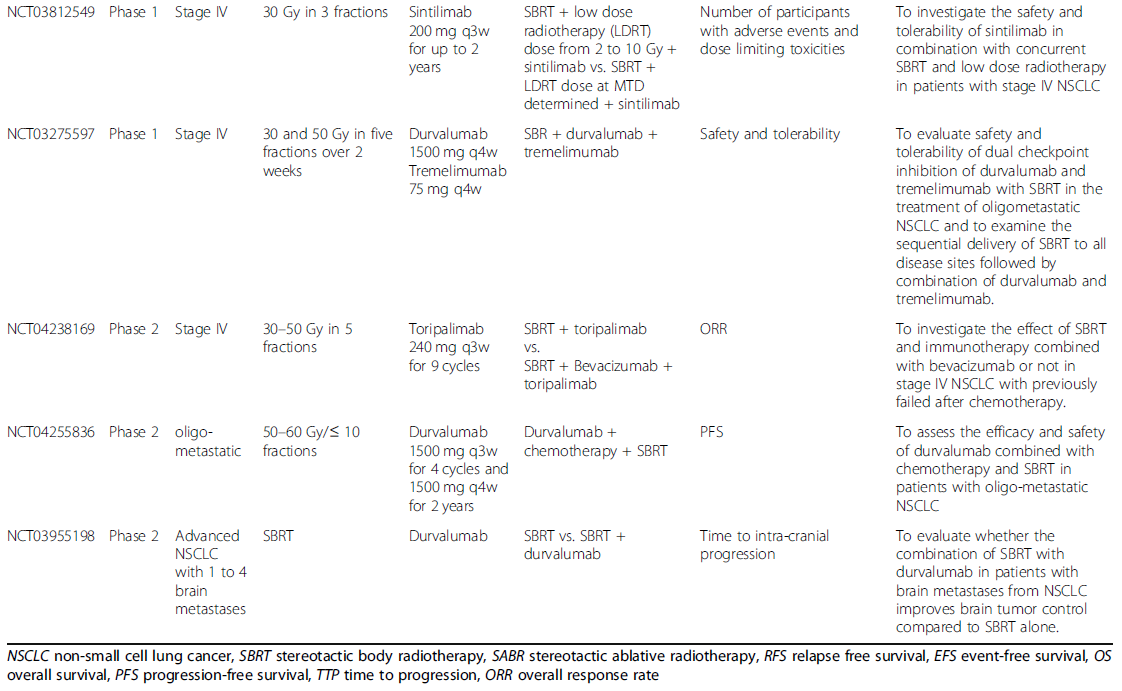
正在进行的探索SBRT联合PD-1/PD-L1抑制剂治疗不同阶段NSCLC患者的临床试验见表2。在这24项试验中,最常见的研究阶段是I期和II期,只有3项III期试验。除IV期NSCLC外,越来越多的试验关注早期NSCLC,试图扩大适应证。对于SBRT方案,目前仍缺乏共识,范围从30 Gy到60 Gy,分3到5次使用。帕博利珠单抗和度伐利尤单抗是正在进行的试验中最常用的两种PD-1/PD-L1抑制剂。正在进行的试验将进一步帮助我们全面了解联合治疗的情况,从而指导临床实践,以获得更优的生存获益。
SBRT与PD-(L)1抑制剂联合应用的未来挑战与方向
1. 最佳辐射剂量和分割
尽管近二十年来SBRT的应用越来越广泛,但在临床实践中对SBRT的推荐标准剂量和分级仍没有明确的共识。早期非小细胞肺癌的SBRT方案包括30–34 Gy×1次、15–20 Gy×3次、12 Gy×4次和10–12 Gy×5次,最常见的是后两种。多项II期研究表明相较于多次照射方案,单次方案肿瘤控制率相当,但3级及以上的不良事件发生率略少。一项回顾性研究表明,54-60 Gy分割3次的SBRT方案(3个部位)的局部失败率(2年时为4.3%)显著低于单次30-34 Gy(21%)、4-5个分割48-50 Gy(15.5%)以及8-10个分割50-60 Gy(13.3%)。
2. SBRT与PD-1/PD-L1抑制剂联合使用的优化方案
对于在PD-1/PD-L1抑制剂启动之前还是之后进行SBRT,目前还没有明确共识。有证据表明SBRT对随后的免疫治疗具有很大的增敏潜力。SBRT后免疫激活和从“冷”肿瘤到“热”肿瘤的转化为后续PD-1/PD-L1抑制剂提供了正向肿瘤微环境。反过来,PD-1/PD-L1抑制剂可使衰竭或静止的CTL恢复活力,这是SBRT诱导抗肿瘤免疫的基础。两项关于ICI联合立体定向放射外科(SRS)治疗晚期转移性黑色素瘤的前瞻性研究的回顾性分析表明,无论是在使用ICI之前、期间还是之后,SRS亚组之间的OS和局部控制没有显著差异。目前的处理组合倾向于优先SBRT而不是PD-1/PD-L1抑制剂。序贯是否影响联合用药的疗效和安全性还有待进一步研究。
为了尽量减少不良反应,临床研究和实践中往往倾向于序贯而不是同时联合用药。最初发表的KEYNOTE-001和PACIFIC试验都证明了序贯放疗联合PD-1/PD-L1抑制剂的可行性和有效性。尽管如此,先前的研究已经证实,同步放化疗和同时使用PD-1/PD-L1抑制剂联合化疗可获得更好的生存效益。令人鼓舞的是,目前SBRT和PD-1/PD-L1抑制剂联用的数据显示,在毒性可控的情况下,PFS和OS得到了大幅改善。此外,对2分割24 Gy的低分割放疗后肿瘤微环境进行了详细的肿瘤浸润淋巴细胞(TIL)动力学评估,观察到在放疗后约5-8天肿瘤特异性CD8+ TIL有短暂增加。但出乎意料,抑制性Treg细胞在10-16天左右占主导地位。这一发现为SBRT和PD-1/PD-L1抑制剂之间的理想时间间隔提出了另一个挑战。
总的来说,最佳的治疗方案应该与增强抗肿瘤免疫相一致。基于有限的可用数据,我们推测联合治疗的顺序对疗效几乎没有影响。尽管存活率显著提高,但是否以增加毒性为代价同时联合应用SBRT和PD-1/PD-L1抑制剂仍有待进一步研究。
3. 选择合适的辐照量和靶区
权衡SBRT治疗的疗效和安全性,最合适的辐照量仍不明确。大剂量SBRT对肿瘤的去瘤作用显著,为PD-1/PD-L1抑制剂的应用奠定了基础。选择较大的辐照量可以更全面地覆盖恶性组织,从而减少原发病灶的复发。另一方面,考虑到安全性,相对较大的辐射量可能会受到附近关键的正常结构的限制。一般认为原发性肿瘤的解剖引流淋巴管需要进行较大剂量的照射,以避免因局部失败和局部淋巴结复发导致的治疗失败。然而,越来越多的证据表明肿瘤相关的引流淋巴结负责CTL的产生和启动,并进一步转移到肿瘤微环境中。因此,相对较小的辐照量可能有助于增强抗肿瘤免疫,提高生存率,尤其是与PD-1/PD-L1抑制剂联合治疗时。
小剂量单靶区照射及多靶区照射在未来的临床应用中具有广阔的前景。多靶区SBRT的“脉冲”方案可能实现增强和持久的免疫激活。此外,前瞻性临床试验将提供更可靠的证据和更具体的标准。
4. 联合治疗中潜在的预测性生物标志物
多个临床试验(包括KEYNOTE-024、IMpower110等)证实,PD-L1高表达的NSCLC患者在使用PD-1/PD-L1抑制剂治疗时往往能获得更好的生存效益。此外,肿瘤突变负荷(TMB)、错配修复(MMR)缺陷和微卫星不稳定性(MSI)、TILs等也显示出了有价值的预测能力。尽管如此,但它们对联合治疗的影响仍然未知。未来的联合治疗优化预测范式的研究应该重视多个生物标志物的结合。
5. 安全性
尽管SBRT与PD-1/PD-L1抑制剂联合应用具有良好的临床疗效,但联合用药可能导致重叠损伤,从而导致致死性irAEs的发生率高于单药治疗。由于致死性irAEs的数据有限,为了全面了解联合治疗的过度毒性,有必要进行更有力的随机前瞻性临床试验,以及更长时间和更严格的随访。
6. 其他
特别值得关注的是,除了上述尚未解决的临床难题外,还有其他未知的实际考虑有待进一步研究。首先,目前对联合治疗的研究主要集中在晚期NSCLC。有证据表明,早期NSCLC患者在最终切除或SBRT后5年生存率在30%到49%之间,仍不理想。因此,对于早期非小细胞肺癌患者,联合治疗是否比单纯SBRT治疗或单纯手术治疗更有效,需要临床试验。第二,关于PD-1/PD-L1抑制剂在联合治疗中,有几个临床问题有待解决,包括在SBRT后PD-1/PD-L1抑制剂治疗的最佳持续时间,以获得持久有效的抗肿瘤反应,是否应在单药给药的基础上调整给药方案,以尽量减少潜在增加的毒性,以及是否有某种PD-1/PD-L1抑制剂与SBRT联合使用时能获得最佳的生存结果。第三,不同的治疗方案有不同的作用机制,可能部分改变机体的生理和病理状态。需要进一步研究以确定患者先前的治疗方案是否影响联合治疗的疗效和安全性。第四,临床试验有助于确定潜在的受益人群。除了临床试验中的研究人群外,对于已有自身免疫性疾病、慢性病毒感染、器官功能障碍或其他潜在疾病的患者,也应给予更多关注,以探索联合治疗的益处是否大于潜在的过量毒性。
PD-1/PD-L1抑制剂的研究进展导致了NSCLC患者治疗模式的转变。然而,免疫逃逸和免疫抵抗限制了它们在大多数患者中的抗肿瘤作用。无创性、耐受性好的SBRT可显著调节肿瘤微环境,使肿瘤对PD-1/PD-L1抑制剂更加敏感,为NSCLC的协同联合治疗提供了一个广阔的前景。据我们所知,已发表的数据虽然有限,但表明联合治疗在未来的非小细胞肺癌治疗中具有相当大的前景。关键的是,在这种联合方案广泛应用于临床实践之前,迫切需要更多的临床前和临床试验来提供明确的证据和解决上述挑战。
李建成教授
福建省肿瘤医院胸部放疗科
福建省肿瘤医院胸部放疗科科主任、教授、博导
福建省医学会肿瘤放疗专业委员会主任委员
福建省抗癌协会放疗专业委员会副主任委员
福建省抗癌协会食管癌专业委员会副主任委员
福建省肿瘤防治联盟食管癌专业委员会副主任委员
福建省抗癌协会放疗专委会青年委员会主任委员
中国抗癌协会肿瘤代谢专业委员会委员
中国抗癌协会热疗专业委员会委员
世界华人医师协会放疗专业委员会副主任委员
世界华人医师协会胸部肿瘤专业委员会副主任委员
世界华人医师协会放疗专委会肺癌工作委员会 副主任
世界华人医师协会肿瘤医生协会常委
中国医师协会立体定向放疗专业委员会常委
吴阶平基金会放疗专业委员会常委
这是一篇非常全面而到位的免疫与放疗联合的综述性文章。本文通过对113篇文献进行综述,分别从SBRT与PD-1/PD-L1阻断剂联合应用的机制、最新研究进展以及未来挑战和方向进行了详细的阐述。在基础研究方面,目前国内外开展了一系列的基础研究,试图阐明SBRT与PD-1/PD-L1阻断剂联合应用的潜在机制;本文通过对既往基础研究结果的综述,揭示了多条可能参与其中的信号通路,为临床实践中将SBRT与PD-1/PD-L1阻断剂联合应用提供了有力的理论依据。临床上,本文通过引证SBRT在早期及寡转移非小细胞肺癌患者治疗中取得的成功,提出将SBRT与PD-1/PD-L1阻断剂进行联合的潜在优势。进一步,本文通过一系列的研究向我们展示了两种治疗方案在非小细胞肺癌患者治疗上取得的成果,同时,也指出了目前SBRT联合PD-1/PD-L1抑制剂的大部分临床研究仍在进行当中,期待更多成熟研究结果的公布。另外本文还对SBRT与PD-1/PD-L1抑制剂联合应用的未来挑战和发展方向进行了综述,对于两种治疗方式联合的最佳方案,包括SBRT的最佳放疗剂量、分割方式、照射靶区,联合的顺序及时机,联合治疗的预测生物标志物等一系列目前尚存争议及困惑的方向进行了详细的文献综述;我们知道联合治疗的毒性是临床应用中的一大难题,SBRT联合PD-1/PD-L1阻断剂同样可能产生毒性的叠加,本文指出对于两种治疗方式的联合需要更多的研究来探索两者的毒性反应,并提出了研究的方向和重点,对于后续的研究开展有一定的指导意义。
总之,本文从基础研究到临床实践为SBRT与PD-1/PD-L1抑制剂的联合应用提供了有力的证据,也指出了我们未来的研究方向。目前一系列基础和临床研究显示了PD-1/PD-L1抑制剂在晚期非小细胞肺癌治疗中的成功,同时我们也可以看到其不足之处:治疗的有效率相对较低以及存在获得耐药的可能。如何解决这些难题,进而提高患者免疫治疗的疗效是目前研究的难点和热点。另外在免疫时代放疗也要应时而变,我们应研究选择有效人群和高毒性反应人群以便使放疗与免疫的联合疗效更上一层楼。
梁军教授
中国医学科学院肿瘤医院深圳医院放疗科
主任医师,硕士生导师,病区主任
中国抗癌协会临床肿瘤学协作专业委员会CSCO食管专家委员会委员
中国肺癌防治联盟肺癌立体定向放射治疗专业委员会委员
中国老年学和老年医学学会肿瘤康复分会食管癌专家委员会副主任委员
中国老年学学会老年肿瘤专业委员会(CGOS)放疗专业委员会常委
中华医学会放射肿瘤治疗学分会免疫放疗学组委员
中国抗癌协会神经肿瘤专业委员会脑转移瘤学组委员
北京医学会放疗分会泛京津冀食管癌多中心协作组常务委员
深圳市医学会胸部肿瘤MDT专业委员会副主任委员
世界华人医师协会胸部肿瘤专委会副秘书长
广东省医学会肺部肿瘤学分会常委
深圳市健康管理协会肿瘤专业委员会常务
广东省医师协会放射治疗医师分会委员
近年来随着免疫治疗的飞速发展,改变了很多肿瘤的治疗模式。在NSCLC治疗中,不论哪个分期都能看到很多有关免疫治疗的研究,但需要注意的是单纯的免疫治疗疗效是有限的。因此联合治疗的模式很快进入研究阶段。在早期和晚期的NSCLC患者中,SBRT的广泛应用已经取得了较好的疗效。那么SBRT与免疫治疗尤其是PD-1/PD-L1抑制剂的联合治疗模式目前在全球都在探索。
本文就SBRT联合PD-1/PD-L1抑制剂在NSCLC的机制、进展和挑战进行了比较全面的梳理。虽然目前SBRT联合免疫治疗的临床证据不是很充足,但已有的研究给我们带来了希望。不过在剂量、分割、结合时机、靶区、安全性等方面仍存在很多有争议的地方。在真实世界中,我们同样观察到联合治疗模式下的毒副反应发生了一些变化,例如肺炎,尤其是无症状肺炎的发生率在2020ASCO报道来看高达40-60%,2级以上也高达13%左右,如何鉴别放射性肺炎和免疫性肺炎,在治疗方面和预后方面的差异,以及是否可以再重启免疫治疗,时机如何选择,再联合治疗模式下对肺炎的全程管理是非常重要的课题,同时也是一个期待解决的难点,值得进一步的探索。希望未来在放疗联合免疫治疗给患者带来生存获益的同时,医生同时要关注毒副反应的变化。
查看更多