查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2024年10月7日下午约 17 点 30 分公布2024年度诺贝尔生理学或医学奖,获奖者为Victor Ambros 和 Gary Ruvkun,表彰他们在发现microRNA 及其在转录后基因调节中的作用,并阐明了控制基因活动的基本原则等贡献。

自20世纪60年代以来,人们认为已经完全阐明了基因调节的基本原理,亦即大家熟知的中心法则——DNA复制、转录为mRNA、mRNA翻译为蛋白质。
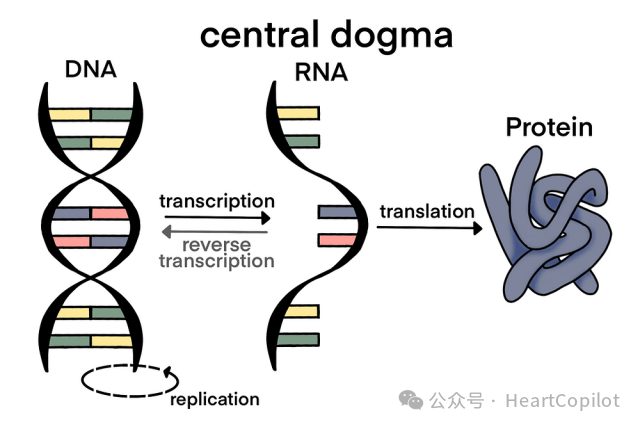
中心法则
时间来到了80年代末,Victor Ambros 和 Gary Ruvkun在Robert Horvitz 实验室进行博士后研究。他们发现一种异常短小的RNA分子,不包含翻译为蛋白质的序列,却通过结合mRNA的互补序列来抑制其翻译过程。研究结果于1993年在Cell发表。文章发表以后,一石惊起......(啥也没有)
直至2000年,第二个类似分子被发现;学术界的兴趣才被彻底点燃,数年内发现几百种这类分子。这类分子就是本年度诺贝尔生理与医学奖获得者的主要贡献——微小RNA(microRNA,miRNA)。
微小RNA(microRNA)是由基因组不同区域编码的短链RNA分子,长度为18–26个核苷酸。它们在细胞核内由RNA聚合酶II转录为初级miRNA(pri-miRNA),经由Drosha酶处理成前体miRNA(pre-miRNA),然后被运送到细胞质中,由Dicer酶加工成成熟的miRNA双链体。这些双链体被整合入miRNA诱导的沉默复合物,核心成分Argonaute蛋白根据与靶mRNA的部分或完全互补序列,通常位于3’非翻译区(3’UTR),指导基因表达的调控。
miRNA的合成及功能
研究表明,外泌体是miRNAs的重要运输载体。外泌体是由各种细胞类型释放的30~150纳米大小的囊泡,能够通过旁分泌(作用于邻近细胞)、自分泌(被原始细胞重新摄取)或内分泌(释放到循环系统)方式,传递miRNAs的生物学功能(如图所示)。外泌体的内容物反映了来源细胞的状态;在不同的生理和病理条件下,特定的miRNAs在外泌体中会富集或减少。
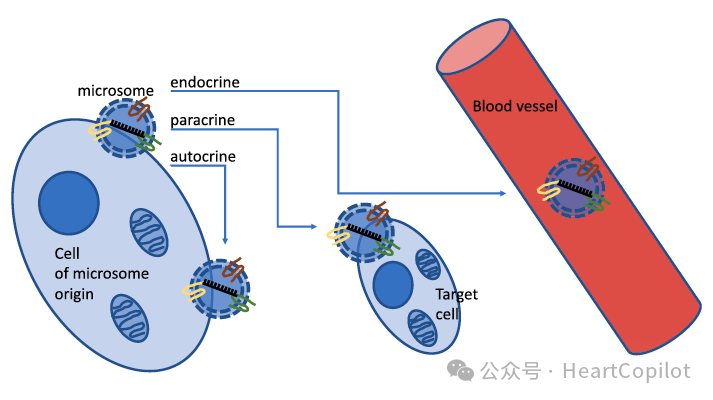
基础研究的价值永远不可低估,它们对医学临床的影响如同杜甫的诗句——“润物细无声”。miRNA的影响扩及多个临床学科,在心血管领域也不例外。
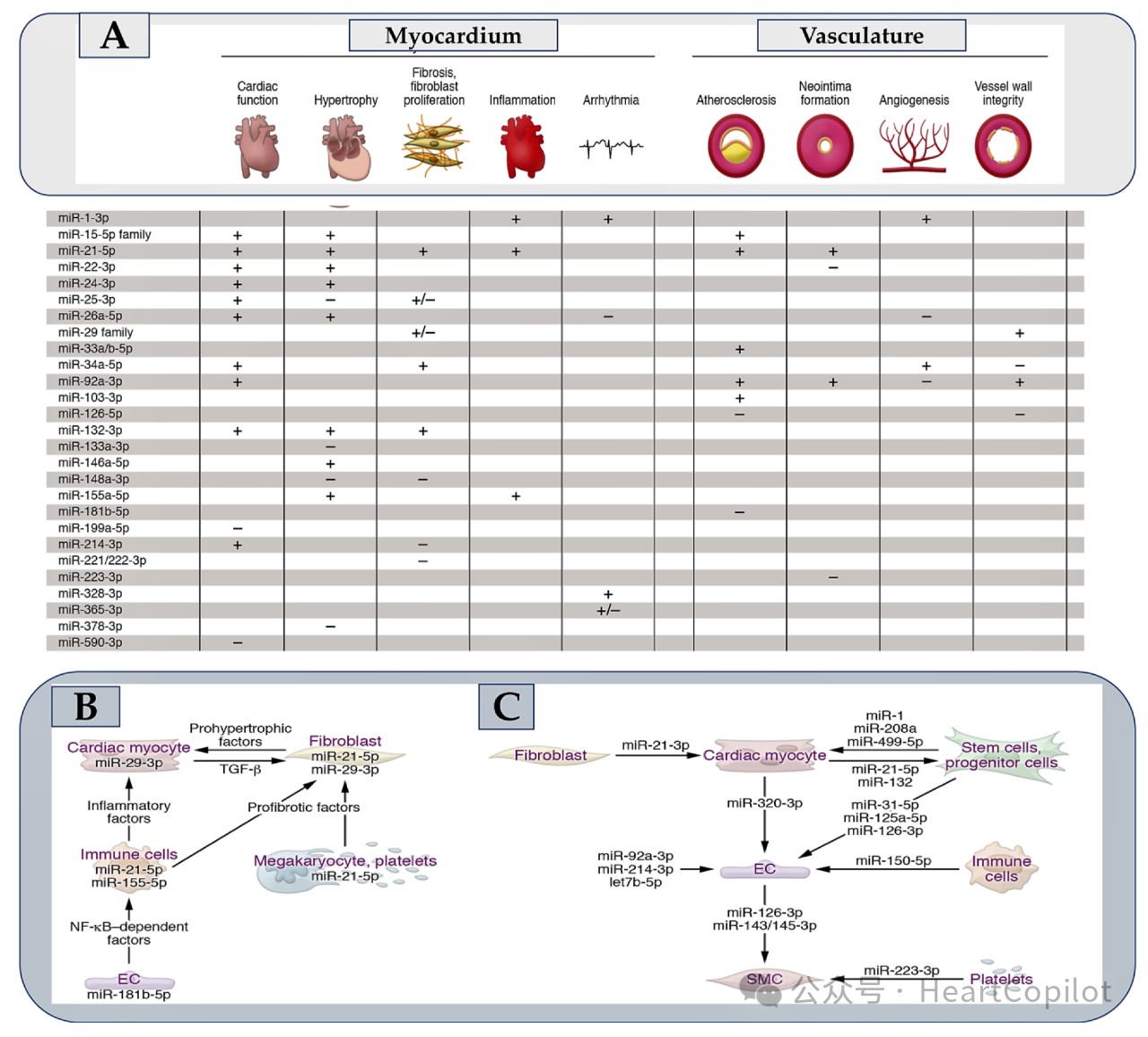
+表示促进,-表示抑制;B 概述了控制心血管系统内细胞间通信的靶标的微小 RNA 实例。C 详细说明了在心血管系统内分泌的 miRNA 示例的旁分泌作用
自2006年首次报道miRNA在心血管疾病中的作用,miRNA已成为调节心血管生理和病理的重要分子。单个miRNA通常可以调控多个功能相关的基因,而这些基因也可能反过来影响miRNA的表达。有些miRNA形成簇,受特定因子的调控,簇内的每个miRNA都有自己特定的靶基因。在心脏中,miR-1和miR-133a等miRNA促进心肌细胞的分化,影响心脏传导和动作电位;miR-208a/b和miR-499在心脏发育的后期阶段起作用,调节心肌收缩蛋白的表达和肌纤维类型的特异性。这些miRNA在多种心血管疾病的发生和发展中都有重要作用。对miRNA在心血管生理和疾病中的作用的深入研究,为其作为诊断、预后和治疗工具的应用提供了新的可能性。例如,调控Notch信号通路是一个有前景的治疗策略。由于Notch通路在不同细胞类型中的作用具有情境依赖性,其精确调控需要高度的特异性。多种miRNA与Notch通路存在复杂的交互作用,针对这些miRNA的干预可能为心血管疾病的治疗开辟新途径。
下面就miRNA在冠心病(含心肌梗死)、心力衰竭两个重点领域的进展简要分享。

心肌梗死引发的细胞凋亡和炎症反应导致心肌细胞丧失和心肌纤维化,显著降低心脏功能,进而导致心力衰竭,甚至死亡。一些miRNAs通过促进纤维化,增加了MI相关的发病率和死亡率。
miR-181a和miR-181b:de Couto等的研究显示,由心肌球源性干细胞(cardiosphere-derived cells,CDC)分泌的外泌体具有心脏保护作用。在猪和大鼠的缺血/再灌注诱导的MI模型中,冠状动脉内注射CDC分泌的外泌体(CDCexo)能够改善心脏功能。这种有益效果主要归因于外泌体中富集的一组特定miRNAs,尤其是miR-181b。miR-181b通过靶向蛋白激酶Cδ型(PKCδ),介导抗炎性巨噬细胞的极化,从而发挥保护作用。相似地,Vaskova等研究发现,沙库巴曲/缬沙坦在慢性MI模型中,可减少心肌纤维化。其机制是增加了外泌体产生,并特异性下调了miR-181a的表达,导致心肌纤维化和病理性肥大的减轻。使用miR-181a反义抑制剂(antagomiR)处理的大鼠,左心室功能和心脏重构明显改善;而添加miR-181a模拟物则抵消了沙库巴曲/缬沙坦的有益效果。这表明miR-181a可能是早期心肌缺血的有价值生物标志物,通过特异性antagomiR下调miR-181a有望发展为治疗手段。
miR-212:一些miRNAs已被证明通过PI3K/AKT信号通路在MI后保护心脏。例如,miR-212通过下调水通道蛋白9(aquaporin-9)的表达,激活PI3K/AKT通路,减少了caspase介导的细胞凋亡,进而抑制心肌细胞凋亡,改善血管生成和心脏功能。
miR-144:miR-144也被证明在鼠缺血/再灌注和非再灌注MI模型中,能够防止不良的MI后重构。反复静脉注射miR-144可减少梗死面积,改善心脏功能。值得注意的是,miR-144与Argonaute-2蛋白结合,保护其免受血浆RNA酶的降解,使静脉给药成为可能。然而,这种给药方法无法避免潜在的非靶向和全身性影响。
miR-19a和miR-19b:Gao等显示,miR-19a和miR-19b在预防MI后心力衰竭中起重要作用。小鼠MI模型中,心内注射miR-19a或miR-19b模拟物可减少梗死面积,维持心脏功能,并提高存活率。miR-19a/19b通过抑制梗死心脏中的免疫反应,提供心脏保护。这提示miR-19a/19b(以及可能的其他miR-17-92簇成员)可作为MI早期治疗的潜在靶点,预防MI后心力衰竭的发生。
miR-199a:在一项猪MI模型中,Gabisonia等取得了令人鼓舞的结果。通过腺相关病毒介导,将miR-199a递送至左室,MI猪在28天后显示出显著的心功能改善,左室射血分数和搏出量恢复,梗死面积减少,心肌纤维化减轻,心肌收缩功能改善。这些效果是通过刺激心肌细胞的去分化和增殖实现的。然而,长期表达miR-199a导致大多数治疗动物出现猝死,强调在临床应用中对miRNA剂量和递送进行精确控制的重要性。
miR-216a:研究发现,miR-216a在CAD患者,特别是老年患者中显著升高。miR-216a通过诱导血管内皮细胞的衰老和炎症,促进了动脉粥样硬化和CAD的发生。其机制涉及SMAD家族成员3/NF-κB抑制因子α(Smad3/IκBα)通路,这是转化生长因子β1(TGF-β1)的主要下游介质,具有抗炎作用(Yang等,2018)。Smad3是miR-216a的潜在靶点,因此miR-216a可能成为内皮功能障碍和动脉粥样硬化发展的生物标志物和治疗靶点。
miR-29a:另外,miR-29a可下调I型和III型胶原蛋白的表达,这些胶原蛋白已知在动脉粥样硬化的发展中发挥作用。miR-29a还下调了Quaking蛋白,后者进一步调节清道夫受体A和脂质摄取(Liu等,2017)。这些下游因子都参与了动脉粥样硬化的发生和进展。miR-29a可能通过激活PTEN/AKT通路和高迁移率族蛋白1(HBP1),增加血管生成和细胞周期调节;或者通过影响磷酸酶基因,促进动脉粥样硬化的发展(Wang等,2013)。因此,miR-29a的反义抑制剂(antagomiR)有可能用于治疗动脉粥样硬化,而miR-29a的水平也可作为其发展的生物标志物。
限制miRNA临床应用的一个主要障碍是如何实现靶向、特异性的递送。任何潜在的miRNA疗法都需要在局部而非全身范围内,以非常受控的方式使用。在MI中,特别需要克服微血管阻塞,才能将治疗剂递送至梗死部位。
Hong等开发了一种抗凝纳米复合物,将miR-1抑制剂与聚赖氨酸树状分子结合,用于递送。该纳米复合物能够减少微血管中的微血栓形成,抑制凝血因子Xa,从而克服梗死区域的微血管阻塞。miR-1抑制剂的额外作用是降低心肌细胞的凋亡,减少纤维化,改善心脏功能。
Bejerano等研究了一种将miR-21模拟物递送至心肌梗死部位心脏巨噬细胞的纳米颗粒方法。在小鼠冠状动脉结扎模型中,接受miR-21模拟物治疗的心脏巨噬细胞从促炎性状态转变为抗炎性状态,增加了血管生成,减少了梗死区域的细胞凋亡和病理性重构。然而,这些积极作用并未导致收缩功能的改善。此外,miR-21在某些癌症和其他病理情况下水平升高,令人担忧其模拟物可能产生的全身性副作用。miRNA调控的高度精确性和多方面作用,在设计基于miRNA的临床应用时带来了挑战。

miR-21:最近的一项研究在大型动物(猪)模型中提供了miRNA治疗心力衰竭(HF)的有效证据。在该研究中,通过左前降支(LAD)闭塞一小时并随后再灌注,导致了大面积心肌梗死后的HF。这些病理变化与miR-21水平的升高有关,miR-21是通过激活丝裂原活化蛋白激酶(MAPK)信号通路调节心肌纤维化的重要因子。在接受了锁核酸(LNA)修饰的抗miR-21(anti-miR-21)治疗的猪模型中,通过导丝球囊导管将其递送,结果显示,在心肌梗死后一个月内,治疗组相比对照组心功能显著改善,肝肾功能得到维持。anti-miR-21的有益效果归因于其抑制了miR-21在MI后触发的促纤维化和促炎性转录重编程。值得注意的是,心脏特异性的miRNA水平在血浆中并未升高,提示其作用机制是局部而非全身性的。
miR-222:miR-222总体上似乎具有心脏保护作用。它在体力运动时被诱导,可在健康和患有HF的个体中介导运动带来的心脏保护效应。在压力超负荷诱导的HF模型和HF患者中,观察到转化生长因子(TGF)-β介导的miR-221-3p和miR-222-3p的下调,可能激活促纤维化信号,导致成纤维细胞的激活和纤维化的发展。miR-221/222的潜在靶点包括c-Jun氨基端激酶1(JNK1)、TGF-β受体1和2,以及红细胞生成素转化特异性原癌基因1(ETS-1),这些都参与了TGF-β/SMAD信号通路。因此,将miR-221/222模拟物递送至心脏成纤维细胞,可能用于HF的治疗。然而,递送至心肌细胞可能有害,因为在小鼠心肌细胞中过表达miR-221/222导致了心肌纤维化、功能障碍和死亡。一如既往,miRNAs作为治疗靶点充满希望但又难以捉摸。
有趣的是,miRNAs可能至少部分解释了射血分数保留的心力衰竭(HFpEF)在男女之间的不同患病率。Florijn等发现,雌激素通过不同机制调节多种miRNA的表达,例如招募特定的转录因子,调节RNA聚合酶II的活性,以及直接参与miRNA加工和功能的蛋白质的表达,如Dicer和Argonaute-2。男女之间miRNA表达的差异以及由此导致的炎症和心脏重构的差异,可能是心血管病理生理性别差异的基础。这些差异可归因于由雌激素激活的miRNAs和从X染色体表达的miRNAs。前者主要表现出保护作用,后者则对心血管功能多为有害。因此,绝经后女性的雌激素缺乏导致了保护性miRNAs的丧失和有害的X染色体相关miRNAs的增加,导致HFpEF和其他性别特异性的心血管疾病。
在HF治疗中,miR-132是最有前景的治疗靶点之一。miR-132是调节导致心血管疾病(尤其是HF)的多种病理生理过程的关键因子。过表达miR-132的小鼠出现心肌肥大和HF,最终导致死亡。这些效应在接受miR-132反义抑制剂(antagomiR)治疗的小鼠中得到了预防。在猪的HF模型中也证实了这一拯救效应,anti-miR-132治疗以剂量依赖的方式预防了心肌梗死后HF的发展。miR-132的已知和潜在靶点包括FOXO3、SERCA2a(肌浆网Ca²⁺-ATP酶)、TEK(受体酪氨酸激酶)、NOS3(内皮一氧化氮合酶3)和STIL,这些基因的失调与导致HF的不良生长和重构的不同方面有关,如纤维化、凋亡、氧化还原调节和钙处理。实际上,miR-132反义抑制剂CDR132L是目前唯一在临床试验中测试的基于miRNA的心血管治疗药物。它被证明是安全、耐受性良好的,并能以剂量依赖的方式选择性地抑制miR-132水平。
一些miRNAs已被证明与HF患者的不同临床结局相关,因此可能作为指导预后评估和治疗决策的生物标志物。
例如,循环中的低水平miR-199a-3p(与缺氧相关)和miR-27a-3p(与血管生成相关),以及其他已知的HF相关miRNAs,已被证明与最初因HF入院的患者在18个月内的心血管相关再住院显著相关。再住院的最佳预测指标实际上是let-7i-5p。所有与再住院相关的miRNAs都参与了与动脉粥样硬化有关的过程,如血管生成、炎症和内皮功能障碍。循环中的miR-122水平,特异性表达于肝脏,调节胆固醇和脂肪酸代谢,被报道为慢性收缩性HF临床结局的独立预测因子。它可以作为补充现有的N末端脑利钠肽前体(NT-proBNP)的额外生物标志物,以改进风险分层。Bruno等鉴定了一组在HF患者中差异表达的循环miRNAs,这些患者发展出了早期肾功能不全。这些miRNAs可作为诊断和预后生物标志物,有助于为急性HF患者选择最佳治疗方案。血清肌酐和中性粒细胞明胶酶相关脂质运载蛋白(NGAL)水平的升高(目前肾功能恶化的标准指标)与miR-27a-3p、miR-199a-3p、miR-423-5p、miR-652-3p和miR-let-7i-5p水平降低显著相关,而NGAL水平的升高则与miR-18a-5p、miR-106a-5p、miR-199a-3p、miR-223-3p和miR-423-3p水平降低相关,其中miR-199a-3p是肾功能恶化的最强预测因子。

本文转自HeartCopilot
查看更多