查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





第20届世界肺癌大会(WCLC)仍在如火如荼召开中,会议的第三天,主旨报告三大临床研究相继公布,带来了令人振奋的研究结果。下面将为大家一一揭晓。
研究一
来自纪念斯隆凯特琳癌症中心的A.Drilon教授报道了Selpercatinib(LOXO-292)在RET基因融合阳性肺癌病人中的1/2期临床研究LIBRETTO-001的注册性结果。分析结果显示LOXO-292治疗RET基因融合阳性NSCLC患者具有良好的效果,同时确认了与之前研究一致的安全性和耐受性。

RET基因是一种原癌基因,它的异常会导致癌症的发生和发展,肺癌中的RET基因倾向于与其他基因融合,发生率在NSCLC中约占2%左右,对肺癌来说KIF5B是RET基因最常见的伴侣基因。而对于晚期的NSCLC一半以上的病人会发生脑转移。目前并无针对RET基因异常驱动的抑制剂被正式批准使用,多靶点激酶抑制剂靶向并不“专一”,并且带来了不少的毒副作用限制了应用剂量,削弱了对RET融合基因的抑制功能。目前的数据显示免疫治疗药物对驱动型基因阳性患者的效果有限,包括RET基因融合。

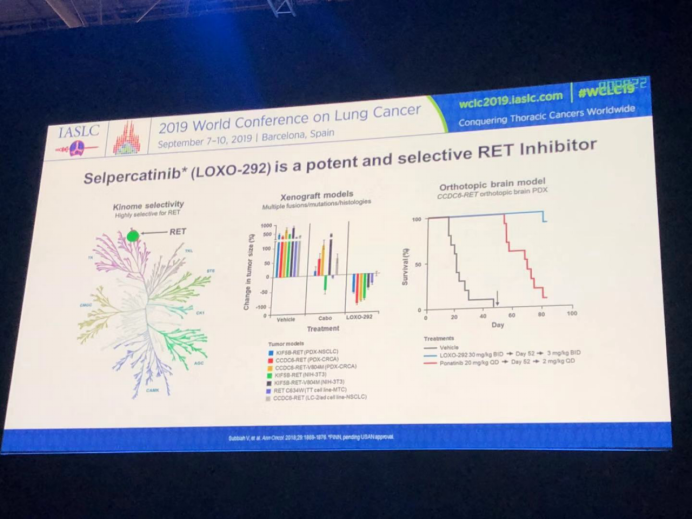
LOXO-292是一种强效、口服、高度选择性RET激酶抑制剂,对RET基因具有良好的专一性。在移植瘤模型中展现出了对多种RET融合基因阳性瘤细胞的抑制作用,同时原位脑瘤模型应用LOXO-292后的生存期更长。
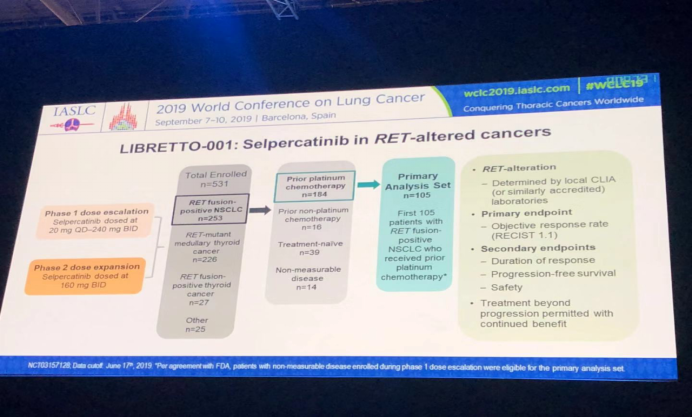
LIBRETTO-001研究初期共招募了531例RET基因异常实体瘤患者,其中既往经过铂类化疗的RET基因融合患者有184例,未经治疗患者39例,最终对105例既往化疗过的RET融合基因阳性的NSCLC患者进行分析。主要研究终点是客观缓解率(ORR)。次要研究终点是缓解持续时间(DOR)、无进展生存期(PFS)及安全性。
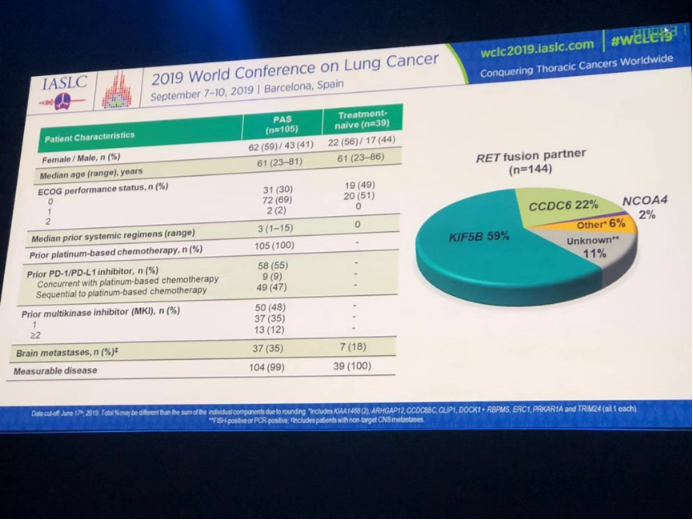
144例RET融合患者中,KIF5B融合为59%,CCDC6融合为22%,NCOA4为2%,其他少见融合为6%,未知融合为11%。两组的中位年龄均为61岁。既往中位化疗方案为3个。既往PD-1/PD-L1抑制剂使用者为55%。既往多靶点激酶抑制剂使用占比为48%。既往化疗组的脑转移为35%,未经治疗组的发生率为18%。
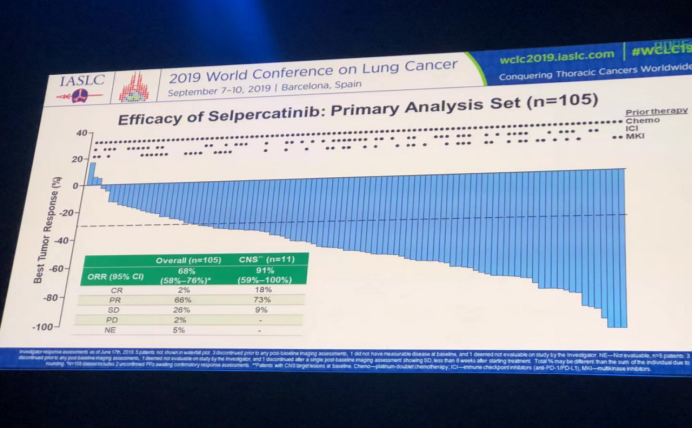
对其中首先确定的105例既往化疗RET基因融合阳性NSCLC患者进行疗效分析发现:总体ORR为68%(95% CI:58%-76%),中枢神经系统转移的ORR为91%(95% CI:59%-100%)。CR分别为2%和18%。PR分别为66%和73%。SD为26%和9%。
对34例RET基因融合阳性未经治疗NSCLC患者进行疗效分析发现:总体ORR为85%(95% CI: 69%-95%)。CR、PR、SD、PD分别为3%、82%、9%、3%。
既往治疗组的缓解持续时间分析发现:中位DOR是20.3个月(95% CI:13.8-24.0);中位随访时间是8.0个月。中位PFS是18.4个月(955 CI:12.9-24.9)中位随访时间9.6个月。其中28例患者发生进展,23例进展后继续治疗。ORR、DOR、PFS与既往治疗方式无关。
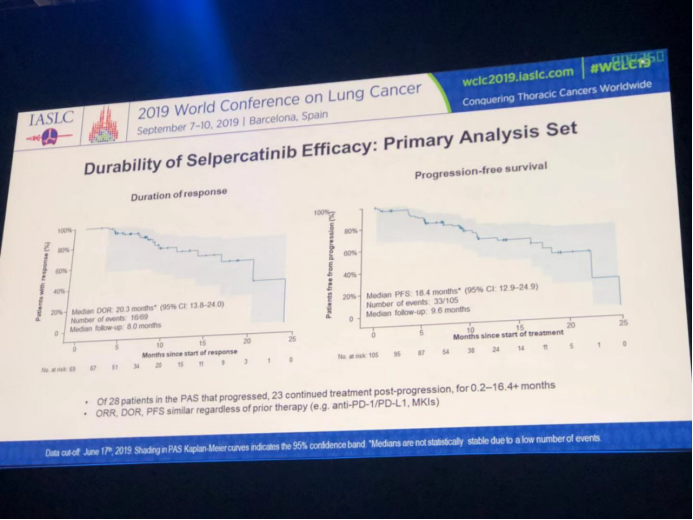
对未经治疗组的疗效持续结果分析显示:中位DOR还未达到;中位随访时间为4.8个月。中位PFS仍未达到;中位随访3.7个月。
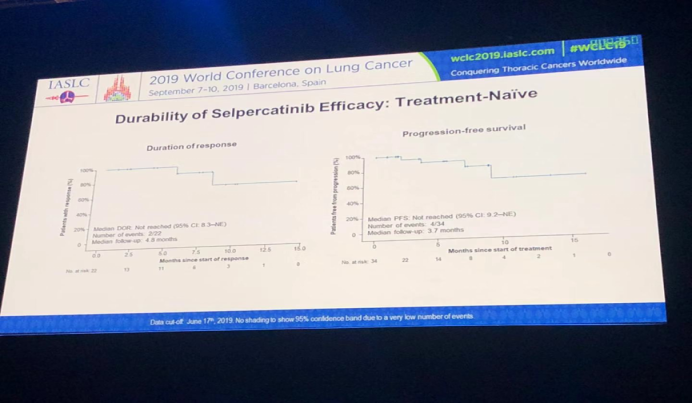
通过对531例招募患者进行安全性分析发现LOXO-292展现出了良好的安全性:治疗相关性毒性反应最多的是口腔干燥(27%),其次有AST升高(22%)、ALT升高(221%)、腹泻(16%)等,仅有9例患者(1.7%)出现因治疗相关毒性反应而治疗中断。
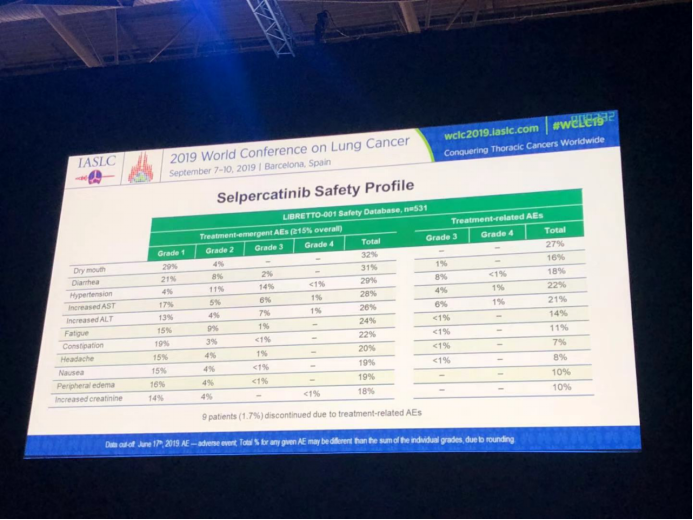
本次汇报提供了一例初治患者口服LOXO-292的病例经验:患者,女,65岁,KIF5B-RET融合阳性的NSCLC,转移部位有舌根部、肺部、骨。LOXO-292的初始剂量 160mg BID。治疗10月后仍是PR状态,且耐受性较好。
另一例患者口服LOXO-292后表现出了克服获得性看门基因耐药性的良好效果:患者,女,42岁,KIF5B-RET融合突变阳性的NSCLC。既往15种治疗方案,包括化疗、免疫治疗和试验性激酶抑制剂。在经过vandetanib治疗后检测发现该患者存在RET V804L看门基因突变,随后开始LOXO-292治疗,初始剂量为160mg BID,用药后患者气短症状得到改善,8周后根据RECIST 1.1评价为PR,11月时评价显示患者仍正常治疗中。
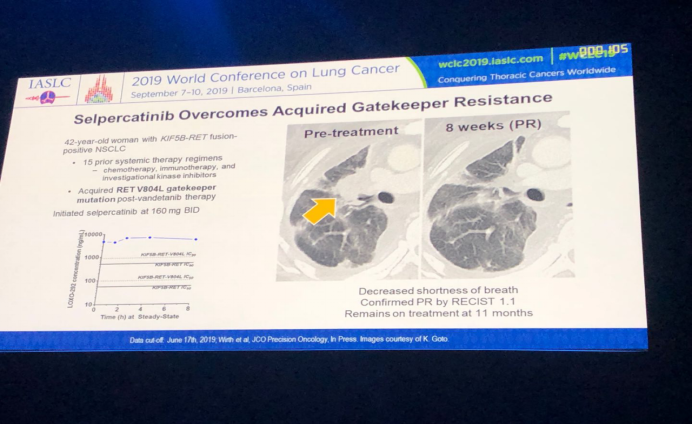
LIBRETTO-001研究证实了LOXO-292在RET基因融合阳性NSCLC患者中具有强效、可耐受的抗肿瘤特性。对既往化疗组和初始治疗组均表现出了较高的有效性,尤其对脑转移患者能达到91%的反应率。同时,安全性良好,所致治疗相关性毒性反应大多数为低级别反应,仅极少数病人(1.7%)因相关毒性反应中断治疗。总体疗效和安全性在基因驱动阳性的NSCLC中,与其他强效、可选择性、靶向CNS转移病灶的药物相当。对RET基因融合阳性初治疗NSCLC患者,LOXO-292对比顺铂+培美曲塞±帕尼单抗的一项全球随机III期临床试验在未来几月内将开展。

研究二
英国国家肺基质试验(NLMT):在晚期非小细胞肺癌(NSCLC)中的Ⅱ期伞式试验的首次结果;入组患者来自于英国22个研究中心,3月15日至7月19日共入组315名晚期NSCLC患者,其基线特征:47%为男性,中位年龄65岁,60%患者为IV期,10%患者PS2,鳞癌占24%;对患者的诊断活检组织行28基因集合的高通量测序,即二代测序(NGS);常规治疗进展后进行分层,可归类为22个生物标志物组和8个靶向治疗组。
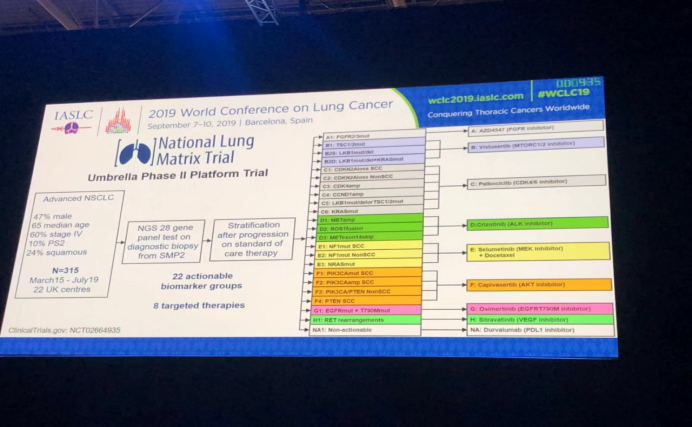
以通路为基础的分子基因组畸变分为4组,分别是:
1. 细胞周期进展组(Rb抑癌基因组):C1-4:palbociclib治疗(CDK4/6抑制剂);
2. PI3K/PTEN/AKT/mTOR组:B1:vistusertib治疗(MTORC1/2抑制剂);F1-4:capivasertib治疗(AKT抑制剂);
3. RAS突变组: (1) RAS突变+/-STK11缺失:C5-6:palbociclib治疗(无AKT突变);B2D,B2S:vistusertib治疗;(2) NF1缺失:E2:selumetinib(MEK抑制剂) + docetaxel治疗;
4. RTK信号通路组:A1:AZD4547治疗(FCFR抑制剂);D1-3:crezotinib治疗(ALK抑制剂);G1:osimertinib治疗(EGFR T790M抑制剂)。

主要研究终点:客观缓解率(ORR),持久临床效益(DCB),无进展生存(PFS),ABDFGH组:ORR>30%;DCBR>30%;E组: ORR>40%;DCBR>40%; C组:mPFS>3月。若后验概率(PP)>0.50则继续研究,当入组患者为15例时进行中期分析;入组30例时进行最后分析。

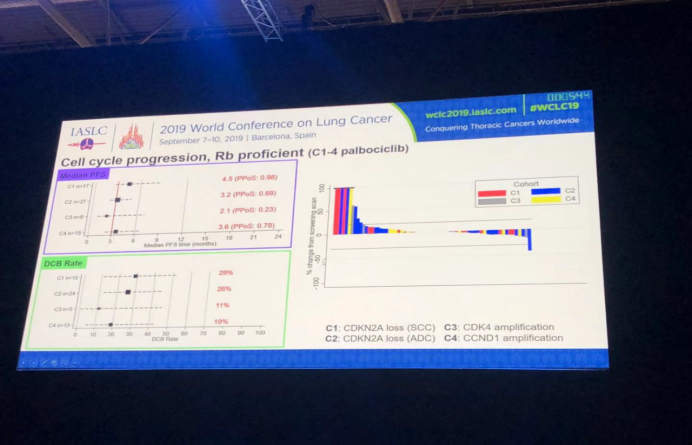
细胞周期进展组,即Rb抑癌基因组:其中四个亚组分别是C1:CDKN2A缺失(小细胞肺癌:SCC);C2:CDKN2A(肺腺癌:ADC);C3:CDK4扩增;C4:CCND1扩增;四个亚组的中位PFS分析结果和DCBR结果以及患者肿瘤变化瀑布图(正向表示肿瘤缩小,负向表示肿瘤增大)。根据结果分析,palbociclib治疗后,小细胞肺癌CDKN2A抑癌基因缺失患者效果好于肺腺癌CDKN2A抑癌基因缺失患者;CCND1抑癌基因扩增患者效果好于CDK4抑癌基因扩增患者。
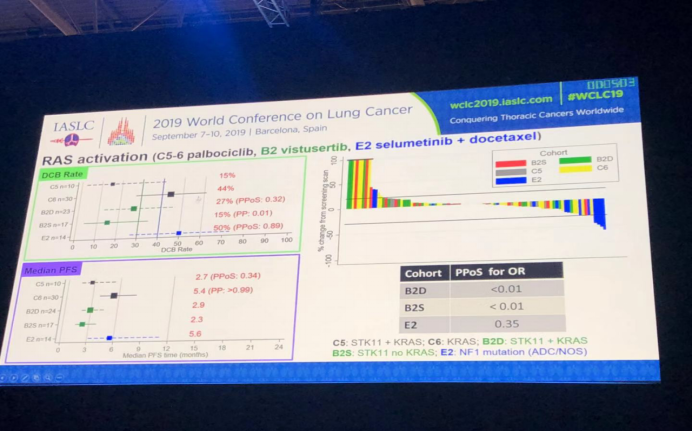
RAS活化组,分为5个亚组,分别是C5: STK11+KRAS突变;C6:KRAS突变;B2D: STK11+KRAS突变; B2S: STK11突变,无KRAS; E2: NF1突变,各组治疗方案参考上述材料。五个亚组的中位PFS分析结果和DCBR结果以及患者肿瘤变化瀑布图如图所示。根据结果分析,KRAS图突变患者palbociclib治疗疗效明显好于STK11+KRAS双突变患者;STK11d+KRAS双突变患者vistusertib治疗疗效好于STK11突变和无KRAS患者。NF1突变患者selumetinib靶向联合多西他赛治疗疗效最好。
PI3K/PTEN/AKT/mTOR组分为5个亚组,分别为B1:TSC突变;F1:PIK3CA突变(SCC);F2:PIK3CA扩增(SCC);F3:PI3K/PTEN无SCC;F4:PTEN缺失/突变(SCC)。患者治疗后中位PFS,DCBR结果以及患者肿瘤变化瀑布图如图所示。Capivasertib治疗后,PTEN缺失/突变的小细胞肺癌疗效最好,其次是PIK3CA扩增小细胞肺癌,PIK3CA突变小细胞肺癌,PI3K/PTE突变的非小细胞肺癌疗效最差。
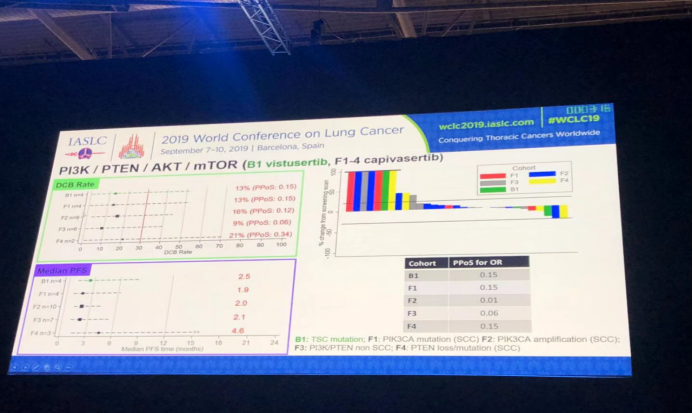
RTK信号组,分为5个亚组,分别是A1:EGFR突变;G1:EGFR T790M突变;D1: MET扩增;D2:ROS1基因融合;D3:MET14号外显子跳跃突变;患者治疗后中位PFS,DCBR结果以及患者肿瘤变化瀑布图如图所示。crezotinib治疗后,ROS1基因融合患者和MET14号外显子跳跃突变患者疗效好于MET扩增患者。EGFR T790M突变患者osimertinib治疗效果最好。
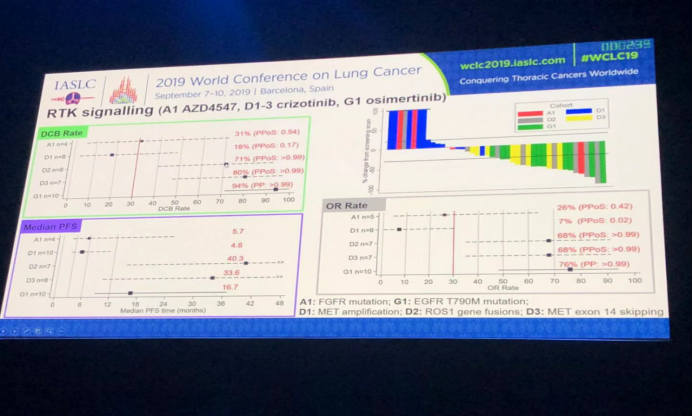
根据患者吸烟史和组织病理类型对所有患者进行亚组分析;患者ORR和肿瘤变化瀑布图结果分析如图所示。从不吸烟的患者ORR显著好于具有吸烟史的患者,非鳞癌患者ORR好于鳞癌患者。
这些似乎不好靶点是否是潜在的好的靶点呢?造成疗效差的原因为以下四点:首先是好的靶点采用了错误的途径治疗,其次是好的靶点采用了错误的基因组学背景治疗,再者是好的靶点采用了错误的治疗策略;最后是好的靶点用了错误的靶向药物。

研究三 CASPIAN重磅研究:Durvalumab联合铂类+依托泊苷(EP)一线治疗广泛期小细胞肺癌总生存明显获益
研究背景:既往30多年,广泛期小细胞肺癌一线可选择的治疗策略有限,仍以EP化疗方案为首选。虽然对于这种治疗方案,患者的初始应答率很高,但疗效不能持久。一般而言,接受治疗的患者通常于治疗后6个月内复发,中位OS约为10个月。目前开展的免疫检查抑制剂相关研究在广泛期小细胞肺癌患者中显现出可获益的抗肿瘤活性,尤其在一线治疗中。CASPIAN这项研究旨在评估durvalumab±tremelimumab联合EP一线治疗广泛期小细胞肺癌的有效性和安全性。
研究设计:该研究为一项随机、开放、双盲全球多中心的III临床研究,入组标准为:初治的广泛期小细胞肺癌;PS 0或1;无症状或者已经治疗且稳定的脑转移;预计生存时间≥12周;具有可测量的肿瘤病灶。拟入组805例患者,并按照1:1:1的比例随机分成3个亚组:第一组给予4周期durvalumab+EP治疗,结束后使用durvalumab单药维持治疗直至疾病进展;第二组给予6周期EP方案化疗,而后根据患者的具体情况选择性给予PCI;第三组给予durvalumab+tremlimumab联合EP治疗4周期,并于结束后使用durvalumab单药维持治疗直至疾病进展。该研究的主要观察终点为OS。次要观察终点包括了PFS、ORR、安全性/耐受性、生活质量。

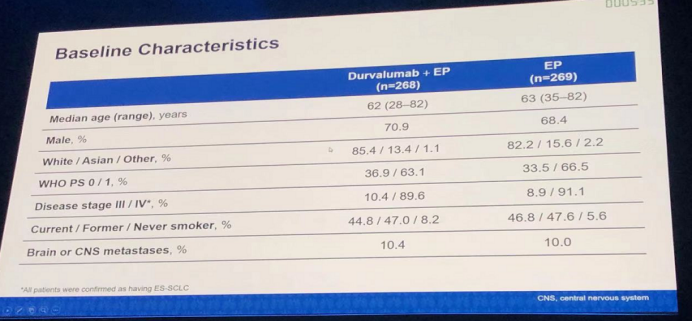
研究结果:目前该研究仅将durvalumab+EP与EP进行了亚组之间的对比分析。患者的基线特征如下图所示:
患者详细治疗情况如下图所示:
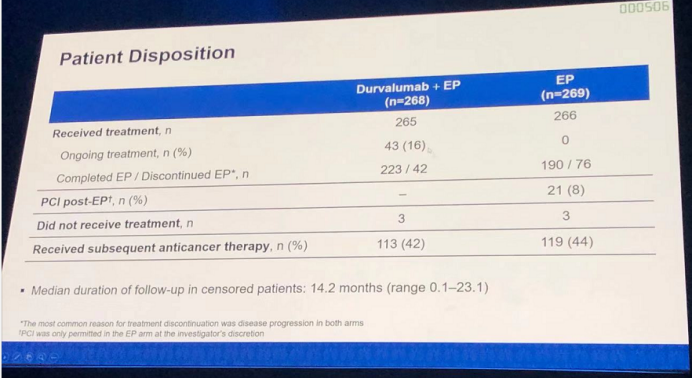
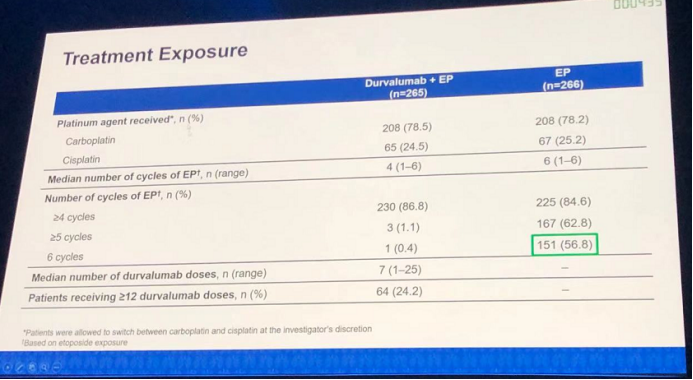
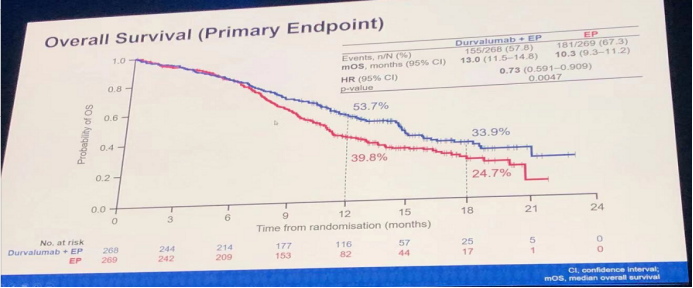
生存分析结果:durvalumab+EP组的mOS为13个月,高于EP组的10.3个月,两亚组的HR(95% CI)为0.73(0.591-0.909),p值为0.0047,具有明显的统计学差异。无论是12个月OS率(53.7% vs. 39.8%),还是18个月OS率(33.9% vs. 24.7%),durvalumab+EP组均明显优于EP组。
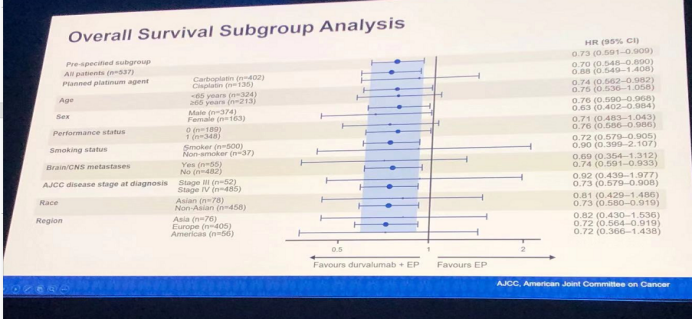
并且OS的获益在各亚组分析中仍然存在。
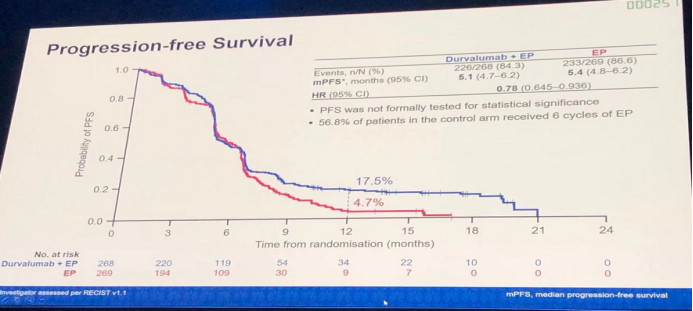
Durvalumab+EP、EP两亚组的mPFS分别为5.1个月、5.4个月,两亚组的HR(95% CI)为0.78(0.645-0.936),未显示出明显的统计学差异。但12个月的PFS率,durvalumab+EP组(17.5%)为EP组(4.7%)的3.7倍。
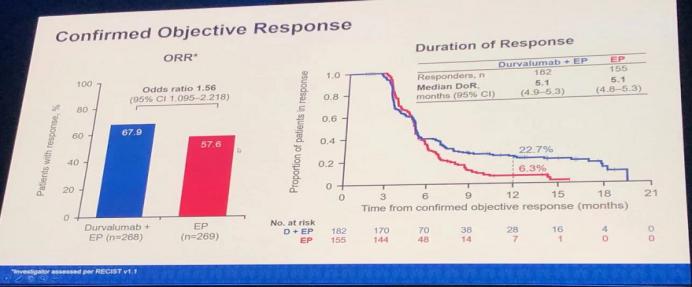
两亚组的ORR及DOR结果如下图所示:
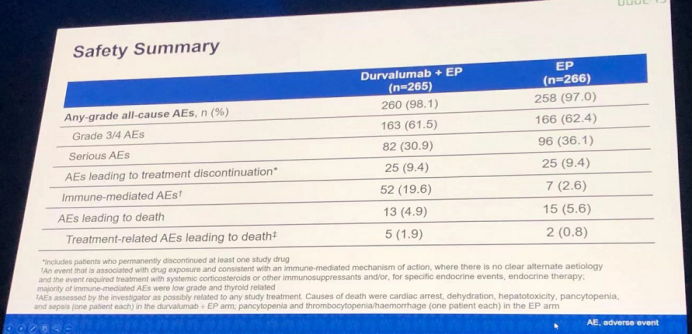
安全性分析结果:免疫相关不良事件发生率,durvalumab+EP组(19.6%)明显高于EP组(2.6%),尽管如此,这些不良事件绝大多数是低级别、可耐受的,且与甲状腺密切相关。除此之外,两亚组的治疗相关的不良事件发生情况未见明显差异。
研究结论:相比于EP联合PCI的治疗策略,一线选择durvalumab+EP明显提高了广泛期小细胞肺癌OS,这一结果令人振奋。此外,durvalumab+EP组的PFS和ORR优于EP组。两亚组治疗相关不良事件均可耐受。该研究中,durvalumab+tremlimumab联合EP与EP两亚组的对比结果仍在分析中,我们也非常期待这一结果的公布。因此,durvalumab与顺铂或卡铂联合依托泊苷为广泛期小细胞肺癌一线治疗策略提供了一种新的选择。
近来肺癌治疗模式不断取得突破性进展,尤其是靶向以及免疫治疗,这些研究成果的成功问世势必为肺癌患者带来无尽的生的希望。
撰稿 | 孟雪 发自西班牙巴塞罗那(山东省肿瘤医院)
查看更多