查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





儿童肾母细胞瘤的诊断与治疗
作者:史艳侠 中山大学肿瘤防治中心
肾母细胞瘤,又称为威尔姆斯瘤(Wilms’tumor,WT),是儿童最常见的泌尿生殖系统胚胎性恶性肿瘤[1]。临床一般表现为无症状的腹部肿块,通常在父母或护理人员为儿童洗澡、穿衣时触及,腹痛、肉眼血尿、发烧等症状可在就诊时发现,同时,约20%患儿有高血压表现[2]。WT生长迅速、恶性程度高、发生转移早,常血行转移至肺和肝脏[3]。WT可双侧发病,超过12%的WT合并有不同类型先天性疾病,例如:睾丸下降不全、尿道下裂、偏身肥大、虹膜缺如[4]。全球先天性畸形的发病率为17.6%[5],而与肾母细胞瘤相关先天畸形的比例占8%~17%[6]。约1/3的WT中发现有WT1,CTNNB1及WTX基因的异常[7],TP53、MYNC也被发现与WT发病相关[8],提示肾母细胞瘤的发生发展与分子生物学水平上的异常高度相关。北美国家肾母细胞瘤研究组/美国儿童肿瘤协作组(NationalWilms’TumorStudygroup,NWTS/Children’sOncologyGroup,COG)根据WT组织学改变与其预后之间的关系,将WT分为2个组织学类型,预后良好型(favorablehistology,FH)和预后不良型(unfavorablehistology,UFH):FH包括上皮型、间叶型、胚芽型和混合型;UFH即未分化型,包括局灶未分化型与弥漫未分化型。而欧洲国际儿科肿瘤协会(sociétéinternationaled’oncologiepédiatrique,SIOP)则是将WT分为低危、中危和高危型。WT的治疗以手术为主,由于对放化疗敏感,以其组织学分型和肿瘤分期为依据进行辅助放化疗也成为WT综合治疗中的重要环节。WT的预后与多种因素相关,尤其是组织学分型与肿瘤分期,其他因素还包括患儿年龄及生物预后标志等[9]。
1儿童肾母细胞瘤的诊断

尽管弥漫未分化型仅占所有WT患者的10%,但是有超过60%的死亡都是由这一类型的WT所导致[13],NWTS/COG的一项报告认为弥漫未分化型WT的确诊对于预测患者较短生存期有重大意义[14]。胚芽型WT同样预后不良,SIOP的回顾性研究结果显示胚芽型WT患者5年无事件生存率为60%~70%[15]。与非未分化型的其他组织学亚型WT患者相比,胚芽型WT患者的复发风险明显升高[16]。
2儿童肾母细胞瘤的治疗
2.1手术治疗
目前,儿童肾母细胞瘤的总体生存率已经超过90%[17],通过手术切除联合放化疗的综合治疗方案就能够取得满意疗效。NWTS/COG主张在化疗前进行手术切除,而SIOP主张在化疗后再进行手术切除。WT的分期与肿瘤的遗传学、组织学、分子标记物等特征无关,不论是术前化疗或术后化疗,其临床分期均与肿瘤镜下是否完整切除、肾包膜是否完整、是否浸润肾窦血管、手术切缘是否有残留、部署淋巴结、肾周组织是否浸润、腹腔是否有浸润密切相关[18],因此,手术对于WT的分期意义重大。目前最常用的术式为经腹横向切口做肿瘤和患肾切除术,该术式可充分暴露手术视野,便于探查区域淋巴结,该术式仅对术中可疑转移淋巴结进行摘除送病理活检,不推荐做正式的淋巴结清扫术,因为淋巴结清扫并不能提高生存率,反而增加手术并发症。未做淋巴结活检的病例局部复发率升高,可能是由于这些患儿术后被低分期,导致治疗不足造成的。晚期肿瘤不过分强调完全切除,予术后化疗和放疗可清除残余瘤组织[19]。
2.2化学治疗
长春新碱(vincrstine,VCR)联合更生霉素(actinomycinD,ACTD),针对晚期患者再加用阿霉素(doxorubicin,ADM)、依托泊苷(etoposide,VP-16)、环磷酰胺(cyclophosphamide,CTX)等,组成治疗WT大部分化疗方案的主体。
以WT的肿瘤分期及组织学分型为依据,目前SIOP推荐的化疗方案见表2[20]。
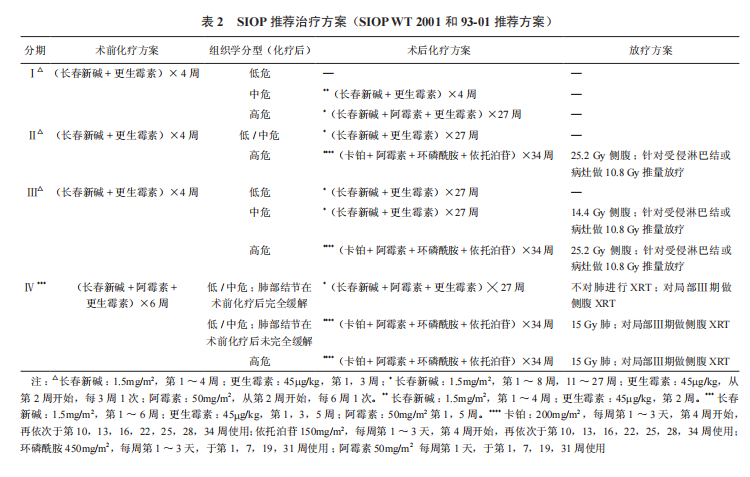
NWTS/COG不主张术前化疗,因为NWTS/COG认为术前化疗会影响术后肿瘤病理分期和组织学类型的判定,错误的评估可能导致患者治疗过度或治疗不足。SIOP则鼓励术前标准化疗,甚至是在缺乏远处转移灶或存在较大的瘤栓时也同样鼓励术前标准化疗。尽管新辅助化疗有可能会对肿瘤分期和组织学评估产生误判风险,但是能够缩小术前肿瘤体积,从而降低围术期肿瘤破溃的风险,也能帮助更好地评估所做化疗方案对个体患者的有效性,同时,能为术后辅助化疗方案的指定提供依据和参考。
WT的总体生存率及无事件生存率与诊断WT时肿瘤的组织学分型、临床分期、肿瘤大小及患者年龄有关。极低危患者(年龄<24个月且肿瘤<550g、Ⅰ期FH型)的预后最好,5年总体生存率≥98%[21]。弥漫未分化型WT患者的预后最差,4年无事件生存率在Ⅱ、Ⅲ、Ⅳ期患者分别约为83%、65%、33%[22]。FH型WT的复发率约为15%,UFH型WT的复发风险接近50%,病理学上UFH型的确诊是肿瘤复发最有效的预后指标,其他的危险因素还包括肿瘤大小、分期、年龄和特定的分子标记物。大部分复发都发生于治疗的前2年内,且最常发生于肺,中枢神经系统的受累者较少见[23]。对于复发的WT患者,大剂量化疗联合自体造血干细胞移植解救疗法是否带来益处还未得到肯定,但很多联合环磷酰胺、依托泊苷、卡铂的化疗方案都取得了不同程度的疗效[24]。
2.3放射治疗
WT的放射治疗同化学治疗一样,都是以肿瘤分期及病理组织学分型为依据,选择不同放射部位及剂量。由于WT属于放射反应敏感性肿瘤,放疗就成为WT综合治疗中相当关键的组成部分,术前放疗不如术后放疗常用,目前,一般推荐术后放疗于肾切除术后14d内开始,SIOP推荐放疗方案见表2[20]。NWTS/COG推荐的放疗方案是FH型Ⅰ、Ⅱ期患者不需行腹部放疗,而FH型Ⅲ期、UFH型Ⅰ~Ⅱ期三期的局灶未分化型推荐行10.8Gy侧腹或腹部的辅助放疗,Ⅲ期的FH和UFH型都需对病灶做10.8Gy放疗,针对Ⅲ期弥漫未分化型需做20Gy放疗;Ⅳ期FH型不伴高风险分子标记物且第6周肺部结节完全缓解者,则不对肺进行放疗,仅对局部Ⅲ期行侧腹部放疗;Ⅳ期FH型伴高风险分子标记物且第6周肺部结节未完全缓解者,对肺做12Gy放疗,且对局部Ⅲ期做侧腹部放疗;SIOP只用胸部平片对肺转移病灶进行评价,Ⅳ期UFH型患者行12Gy肺部放疗加局部三期侧腹部放疗[20]。针对儿童WT的放射治疗存在很多远期不良反应,包括肾脏损伤、不育、肌肉萎缩、身材矮小、脊柱侧凸等。小于1岁且接受过>10Gy放疗的患儿更容易出现生长缺陷,这与侧腹部放疗影响到脊柱有关[25]。针对存在肺脏转移患儿的放射治疗还可能导致甲状腺疾病、乳腺组织损伤,对肝转移患儿行大剂量放疗还会增加门静脉高压的风险[26]。
3小结
目前,儿童肾母细胞瘤的总体生存率已经超过90%,诊治方法已经标准化,通过手术切除联合放化疗的综合治疗方案就能够取得满意疗效。国际上2个儿童肿瘤组织(NWTS/COG和SIOP)在肾母细胞瘤初始治疗上不同,虽有争议,但是两组生存率是相似的。尽管当前WT的总生存率很高,仍有少数患儿由于复发、转移及对化疗药物不敏感等多种因素而死亡,研究显示肾母细胞瘤复发率接近15%,复发患者的长期生存率仅50%,因此,除应当掌握儿童肾母细胞瘤的标准诊治手段以外,更应加深对WT分子生物学水平上的理解和认识,尤其对于伴有高危复发风险的患者,而这些患者往往伴有分子生物学水平上的异常改变,例如染色体1q/16q的杂合性缺失,单个基因水平的上调或下调,细胞内信号通路的异常激活等。探索调控WT肿瘤细胞恶性生物学行为的“分子开关”,除了能够决定其危险因素分层、治疗策略以及新药的研发方向之外,还有助于将来有规模地开展遗传咨询及个体精准化治疗。
参考文献
[1]袁寅莲,张箐箐,董斐婷. 围手术期程序化综合干预在小儿肾母细胞瘤中的应用效果[J].癌症进展,2018,16(4):529-532.
[2]DénesFT,DuarteRJ,CristófaniLM,et al. Pediatric genitourinary oncology[J]. Front Pediatr, 2013(1): 48.
[3]]唐文,蔡嵘,任刚,等.儿童肾母细胞瘤临床与病理相关性研究[J].临床儿科杂志,2018,36(7):524-528.
[4]易斌.肾母细胞瘤诊疗进展[J].中华实用儿科临床杂志,2012,27(23): 1784-1787.
[5]Rankin J, SilfKA, Pearce MS, et al. Congenital anomaly and childhood cancer: a population-based, record linkage study[J]. Pediatr Blood Cancer, 2008, 51(5): 608-612.
[6]Dumoucel S, Gauthier-Villars M, Stoppa-Lyonnet M, et al. Malformations, genetic abnormalities, and Wilms tumor [J] . Pediatr Blood Cancer, 2014, 61(1): 140-144.
[7]DengC, Dai R, Li X, et al. Genetic variation frequencies in Wilms ’ tumor: A meta-analysis and systematic review[J] . Cancer Sci, 2016, 107(5): 690-699.
[8]Ooms AH, Gadd S, Gerhard DS, et al. Significance of TP53 mutation in wilms tumors with diffuse anaplasia: A report from the children’s oncology group[J]. Clin Cancer Res, 2016, 22(22): 5582-5591.
[9]许涛,景红霞,李林均.肾母细胞瘤的研究进展[J].现代肿瘤医学, 2015 (13): 1928-1931.
[10]白明,张敬悌,王盛兴,等.小儿肾母细胞瘤的治疗及生存分析[J].现代泌尿外科杂志,2018,23(10): 765-768.
[11]Zuppan CW, Beckwith JB, Luckey DW. Anaplasia in unilateral Wilms ’ tumor: a report from the National Wilms ’ Tumor Study Pathology Center[J]. Hum Pathol, 1988, 19(10): 1199.
[12]Vujanić GM, Sandstedt B, Harms D, et al. Revised International Society of Paediatric Oncology (SIOP) working classification of renal tumors of childhood[J]. Med Pediatr Oncol, 2002(38): 79.
[13]Faria P, Beckwith JB, Mishra K, et al. Focal versus diffuse anaplasia in Wilms tumor--new definitions with prognosticsignificance: a report from the National Wilms Tumor Study Group[J]. Am J Surg Pathol, 1996, 20(8): 909.
[14]Bonadio JF, Storer B, Norkool P, et al. Anaplastic Wilms ’ tumor: clinical and pathologic studies[J]. J Clin Oncol, 1985, 3(4): 513.
[15]van den Heuvel-Eibrink MM, van Tinteren H, Bergeron C, et al. Outcome of localised blastemal-type Wilms tumour patients treated according to intensified treatment in the SIOPWT 2001 protocol, a report of the SIOP Renal Tumour Study Group (SIOP-RTSG) [J]. Eur J Cancer, 2015, 51(4): 498-506.
[16]Aoba T, Urushihara N, Fukumoto K, et al. Relapse of unilateral favorable histology Wilms ’ tumor: significant clinicopathological factors[J]. J Pediatr Surg, 2012, 47(12): 2210.
[17]Jeffrey S, Dome NG, James I, et al. Advances in Wilms tumor treatment and biology: progress through international collaborationc. J Clin Oncol, 2015(33): 2999-3007.
[18]杨文萍,武海燕,张文,等,儿童肾母细胞瘤病理诊断共识[J].中华病理学杂志,2017,46(3):149-154.
[19]Hamilton TE, Ritchey ML, Haase GM, et al. The management of synchro- nous bilateral Wilms tumor: a report from the National Wilms Tumor Study Group[J]. Ann Surg, 2011(253): 1004–1010.
[20]Dome JS, Graf N, Geller JI, et al. Advances in Wilms tumor treatment and biology: Progress through international collaboration[J]. J ClinOncol 2015(33): 2999.
[21]Shamberger RC, Anderson JR, Breslow NE, et al. Long-term outcomes for infants with very low risk Wilms tumor treated with surgery alone in National Wilms Tumor Study-5[J]. Ann Surg, 2010, 251(3): 555.
[22]Dome JS, Cotton CA, Perlman EJ, et al. Treatment of anaplastic histology Wilms ’ tumor: results from the fifth National Wilms ’ Tumor Study[J]. J Clin Oncol, 2006, 24(15): 2352.
[23]Venkatramani R, Chi YY, Coppes MJ, et al. Outcome of patients with intracranial relapse enrolled on national Wilms Tumor Study Group clinical trials[J]. Pediatr Blood Cancer, 2017(1): 64.
[24]Geller JI. Current standards of care and future directions for high- risk pediatric renal tumors: Anaplastic Wilms tumor and Rhabdoid tumor[J]. Urol Oncol, 2016(34): 50.
[25]Hogeboom CJ, Grosser SC, Guthrie KA, et al. Stature loss following treatment for Wilms tumor[J]. Med Pediatr Oncol, 2001, 36(2): 295.
[26]Warwick AB, Kalapurakal JA, Ou SS, et al. Portal hypertension in children with Wilms’ tumor: a report from the National Wilms’ Tumor Study Group[J]. Int J Radiat Oncol Biol Phys, 2010, 77(1): 210.
查看更多