查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:复旦大学附属华山医院神经内科 血管组 洪澜
大约有20-25%的急性缺血性卒中为醒后卒中,且醒后卒中的再灌注治疗是近年来的研究热点。近年来发表的EXTEND-IV研究以及WAKE-UP利用高级影像筛选能够从溶栓治疗中获益的醒后卒中患者。EXTEND-IV利用灌注影像鉴别是否存在足够的缺血半暗带体积,WAKE-UP研究利用磁共振的DWI-FLAIR错配判断患者是否发病至到院在4.5小时之内。然而并不是所有卒中急救中心都具备急诊高级影像检查的能力,而且也有研究发现40%发病3小时内的急性卒中患者并不存在DWI-FLAIR错配,因此利用高级影像筛选醒后卒中患者可能会遗漏可能从静脉溶栓中获益的醒后卒中人群。同时也有研究提示大多数的醒后卒中在临近苏醒时发生。另一方面,替奈普酶(Tenecteplase,TNK)也已被证明是不劣效于阿替普酶(rt-PA)的溶栓药物。因此,来自挪威的研究者开展了TWIST研究,探究对于不经高级影像筛选(只经头颅CT平扫检查)的醒后卒中患者,TNK0.25mg/kg静脉溶栓相比于标准治疗(不给予静脉溶栓)是否能够改善患者的功能预后。
TWIST是一项随机、开放标签、盲法评价结局的临床试验。目标纳入样本连为600名。主要入选标准和排除标准如下:
1. 入选标准
(1) 伴有肢体运动障碍且NIHSS≥3,或有失语的醒后卒中
(2) 可在醒后4.5小时之内获得治
2. 排除标准
(1) 颅内出血
(2) 梗死体积大于1/3大脑中动脉分布区
(3) NIHSS>25或NIHSS意识评分>2
(4) 基线mRS≥3
符合条件的患者将被随机分配至0.25mg/kg TNK或标准治疗(不包括静脉溶栓),两组均允许动脉内治疗。研究的主要终点如下:
1. 有效性终点
(1) 主要有效性终点:3月mRS作为有序变量(位移分析)
(2) 次要有效性终点:3月mRS 0-1
2. 安全性终点
(1) 死亡
(2) 症状性颅内出血
研究自2017年6月启动至2021年9月结束,因新冠疫情入组明显减慢等原因,最终纳入578名患者,其中TNK组288名,对照组290名。两组的基线年龄、性别、基线NIHSS评分均平衡,基线NIHSS的中位数均在6分。但值得注意的是对照组的动脉内治疗比例为14.5%,显著高于TNK组的6.3%。两组患者的基线数据见下图:

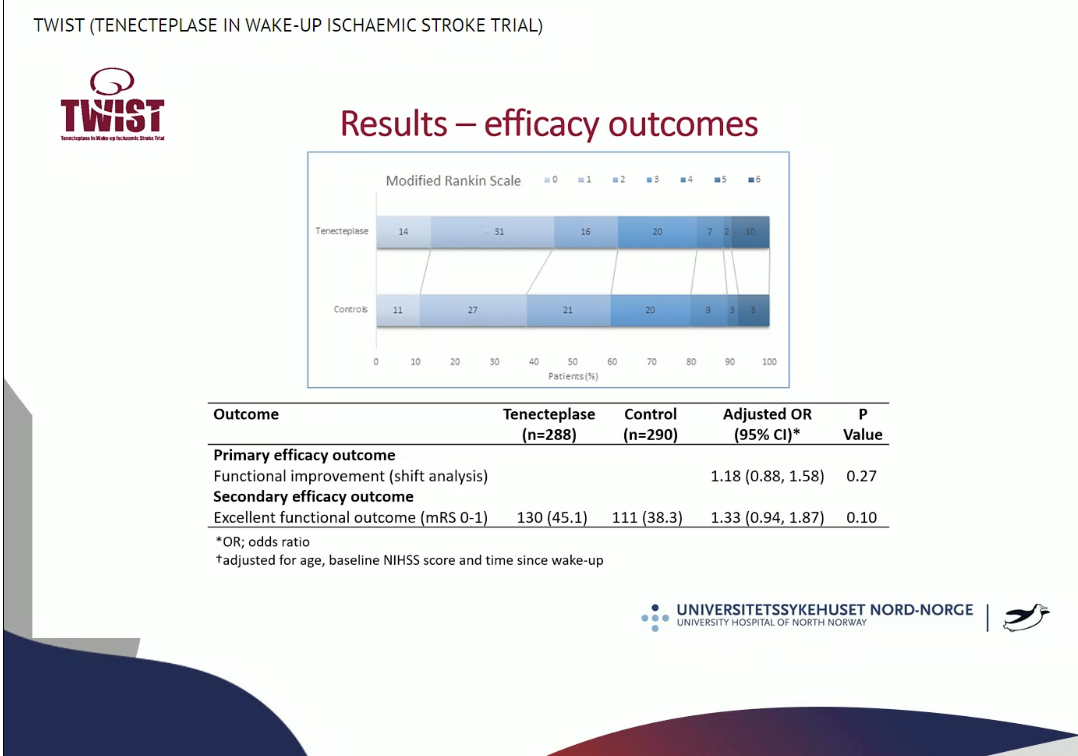
意向治疗集分析显示,主要有效性终点mRS位移的校正OR为1.18,95%CI0.88-1.58,P=0.27。次要有效性终点mRS 0-1在TNK组的比例为45.1%,在对照组中的比例为38.3%,校正OR为1.33,95%CI0.94-1.87,P=0.10。具体mRS位移见下图:
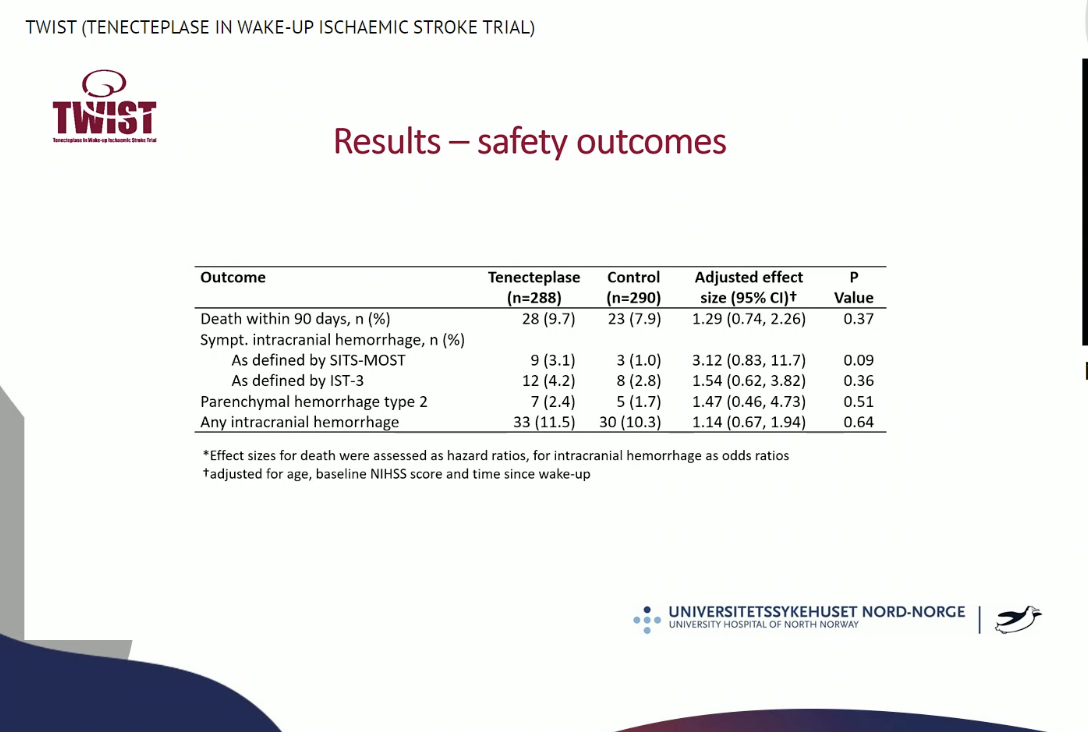
两组的安全性终点无统计学差异,但是TNK组的症状性颅内出血比例在数值上高于对照组(TNK组3.1%, 对照组1.0%,P=0.09),具体见下表:
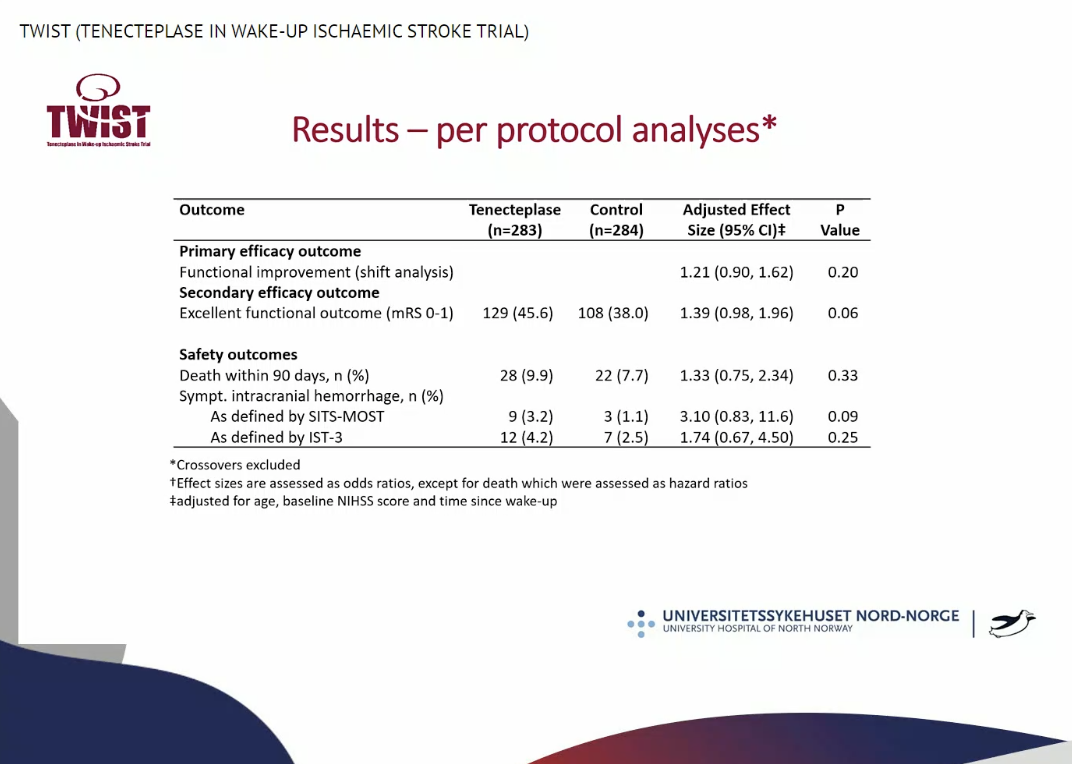
符合方案集的敏感性分析显示,有45.6%的TNK组患者获得了3月mRS 0-1,对照组中这一比例为38.0%,P值为0.06。同时TNK组的症状性颅内出血比例在数值上仍高于对照组(TNK组3.2%, 对照组1.1%,P=0.09)。其余符合方案集的结局分析见下图:
研究结论,只经过平扫头颅CT筛选的醒后卒中患者经TNK溶栓,与不经溶栓的对照组相比,功能预后并未得到改善。但是有较多的TNK溶栓患者获得了3月mRS 0-1。TNK组的症状性颅内出血比例在数值上高于对照组。
小编认为由于本研究的基线NIHSS评分较低,因此若想要获得阳性结果,样本量应当更大,研究团队过于乐观地估计了样本量,且并没有达到预期样本量。同时,本研究的阴性结果不仅受样本量限制影响,还可能与对照组较高的动脉内取栓比例相关。除此之外。在研究进行的过程中WAKE-UP和EXTEND- IV研究的发表,使患者可能接受了高级影像筛选,选择进行rt-PA溶栓,从而影响可能从TNK溶栓中获益的患者的入组,存在一定的选择偏倚。对于醒后卒中患者来说,该研究并未成功挑战高级影像筛选在醒后卒中患者再灌注治疗中的必要性。
本研究的主要发起者和共同主要研究者Eivind Berge教授于2020年2月因癌症过世,谨以此报道纪念这位挪威的卒中专家,医学科学家。

查看更多