查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肾性贫血是指各种肾脏疾病导致红细胞生成素(EPO)绝对或相对生成不足,以及尿毒症毒素影响红细胞生成及其寿命而发生的贫血。应用红细胞生成刺激剂(ESAs)补充EPO是肾性贫血治疗的关键手段之一。然而,目前临床上关于ESAs的应用仍然存在诸多疑惑有待解决,如:ESAs剂量如何合理选择?大剂量ESAs如何界定、有无替代治疗方案?大剂量ESAs转为低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)时如何确定后者的剂量及疗程?
本文中,多位领域内一线专家们,针对以上临床热点话题,展开了精彩阐述。

大剂量ESAs有何危害?
ESAs是肾性贫血的传统治疗手段,临床应用已久,但此方法存在一定的局限性。据四川省人民医院李贵森教授介绍,外源性注射ESAs不能有效维持内源性EPO水平,易引起EPO水平的剧烈波动,而大剂量ESAs还可能引起高血压、增加血栓、心脑血管事件和死亡风险[1]。
CHOIR研究[2]二次分析结果提示,随着ESAs剂量增加,无论患者血红蛋白水平如何,非透析肾性贫血患者复合终点事件(死亡、心力衰竭住院、卒中、心肌梗死)风险显著增加(图1)。较之ESAs低剂量患者,应用高剂量ESAs(>10095 U/周)患者的不良事件风险最高可升高至3.5倍以上。即使患者血红蛋白位于较高水平,风险也依然存在。
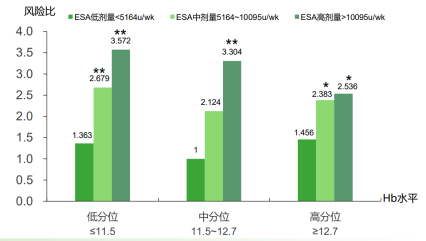
图1 ESAs剂量增加非透析肾性贫血患者复合终点事件风险
31项随机对照研究12956例CKD患者的荟萃分析结果显示,ESAs前3个月的治疗剂量每增加10000 U,全因死亡风险也显著增加41%[3]。
如何界定“大剂量”ESAs?
大剂量ESAs的危害是显而易见的,但问题在于,何种剂量应被定义为“大剂量”?李贵森教授接着谈到,目前学界对于“大剂量ESAs”的定义尚存在争议,荟萃分析和中国研究将“大剂量ESAs”的界限定为>10000 U/周[3,4]。此剂量在临床中较为常见,似乎很容易达到。
对于这一焦点问题,多位专家发表了自己的看法。
上海交通大学医学院附属新华医院蒋更如教授认为,符合中国国情的回顾性研究提示ESAs剂量一般为10000~12000 U/周,这是贫血纠正期皮下注射的剂量,维持期剂量可能有所不同。大剂量ESAs即使能够纠正贫血,也会带来高血压、卒中、血栓等问题,超过20000 U/周的ESAs剂量即便可使血红蛋白达标,也会带来多于获益的风险。因此建议采用符合中国国情的剂量,即10000~12000 U/周。与国外相比,中国患者的ESAs剂量普遍偏大,可能与传统治疗理念及透析充分性的影响有关。国内部分透析充分性做得较好的地区,ESAs剂量就比较低。因此究竟是ESAs低反应性,还是透析不充分的问题导致了患者ESAs使用剂量的增加,这值得关注。
西安交通大学第一附属医院蒋红利教授基于临床实践经验谈到,ESAs用量及疗效受患者铁代谢情况、透析充分性等影响,每周不应超过300 U/kg的剂量,折算后不应超过每周20000 U,所以每周2支10000 U剂量的EPO应被视为大剂量;郑州大学第一附属医院王沛教授认为,目前国内大多数中心ESAs剂量以7000-8000 U/周居多,通常情况下剂量提高大约50%,即达到12000 U/周及以上应被视为较大剂量,这在临床实践中也较常见。
广东省人民医院叶智明教授指出,大剂量ESAs的界定应以ESAs谷浓度为标准。当注射8000 U剂量ESAs后,部分患者ESAs谷浓度即可达到正常水平的10倍甚至20倍,因此或许可考虑将血浓度作为判断大剂量ESAs的标准,将内源性EPO水平和外源性ESAs剂量相结合。
同时,叶智明教授也提到,在贫血治疗新方案HIF-PHI出现后,若ESAs剂量达到12000 U/周,即可考虑替换为HIF-PHI,而不是继续增加ESAs剂量,以避免体内EPO浓度过高造成的不良反应。
如何确定大剂量ESAs转换替代治疗的
后续剂量及疗程?
肾性贫血ESAs治疗过程中,给予适量ESAs治疗1个月后Hb水平无明显增加,或稳定剂量的ESAs维持治疗期间,为维持Hb稳定需要2次增加ESAs剂量且增加的剂量超过稳定剂量的50%,此种情况称之为ESAs低反应性。对于该类患者的处理,《中国肾性贫血诊治临床实践指南》的建议包括针对低反应性的特定病因进行治疗,评估风险后行个体化治疗等,同时也建议可酌情考虑转为HIF-PHI治疗。
在将ESAs转换为HIF-PHI时,后者的剂量选择是目前临床讨论较多的话题。《中国肾性贫血诊治临床实践指南》及《罗沙司他治疗肾性贫血中国专家共识》均建议,在说明书规定剂量的前提下,需要结合患者体重、既往使用 ESAs剂量以及基础Hb值、铁代谢以及营养状态等多种因素来决定HIF-PHI的剂量,需个体化。对此,多位专家也基于临床实践经验分享了自己的观点。
蒋更如教授指出,对于既往使用大剂量ESAs的HD患者,应考虑100~120 mg剂量的HIF-PHI。达标时间方面,需要考虑血红蛋白增长速度和患者安全,在3个月甚至更长的时间内稳定达标。蒋更如教授希望未来能进行相关研究,对于想从ESAs转换为HIF-PHI的患者,及大剂量ESAs血红蛋白不能达标的患者,需明确HIF-PHI转换剂量问题,为临床实践提供指导。
蒋红利教授认为,由ESAs转换为HIF-PHI的剂量应视血红蛋白水平而定。原每周应用ESAs 10000 U的,转为HIF-PHI一般为70~100 mg,大部分患者能够维持较为理想的血红蛋白水平。当然,用药后的达标时间主要还是依赖于患者的血红蛋白基础值。目前在临床实践中,HIF-PHI的起始剂量一般为100~120 mg,可使患者的血红蛋白较快上升,尽早达标。一旦达到目标血红蛋白水平后,即可考虑减量。达标时间也与患者基线血红蛋白值密切相关:如果基线血红蛋白较低(如60 g/L左右),可能需要约3个月方能提升至目标值;如果基线值为90~100 g/L,则一个月左右即可达标。
王沛教授认为,HIF-PHI剂量应按照既往ESAs剂量来选择。目前约80%患者HIF-PHI维持剂量为70 mg-100mg,在药物纳入医保后,患者对于该方案的接受度较高。
叶智明教授也提出HIF-PHI通过3~4个月的治疗让血红蛋白稳定达标。如果血红蛋白上升过于迅速,对患者是非常不利的。
临床上应更合理地使用ESAs,避免大剂量ESAs给患者带来的不良影响。当患者存在ESAs疗效不佳时,应考虑炎症、铁缺乏、透析充分性等影响因素,并针对病因进行纠正,必要时可以转换合适的替代治疗,合理调控血红蛋白提升速度,以期给患者带来更好的预后。
参考文献:
1. 中国医师协会肾脏内科医师分会肾性贫血指南工作组. 中国肾性贫血诊治临床实践指南. 中华医学杂志, 2021, 101(20): 1463-1502.
2. 中国研究型医院学会肾脏病学专业委员会. 罗沙司他治疗肾性贫血中国专家共识[J]. 中华医学杂志, 2022, 102(24): 1802-1810.
3. McCullough PA, Barnhart HX, Inrig JK, et al. Cardiovascular toxicity of epoetin-alfa in patients with chronic kidney disease. Am J Nephrol. 2013, 37(6): 549-58.
4. Koulouridis I, Alfayez M, Trikalinos TA, et al. Dose of erythropoiesis-stimulating agents and adverse outcomes in CKD: a metaregression analysis. Am J Kidney Dis. 2013, 61(1): 44-56.
5. Pan S, Zhao DL, Li P, et al. Relationships among the Dosage of Erythropoiesis-Stimulating Agents, Erythropoietin Resistance Index, and Mortality in Maintenance Hemodialysis Patients. Blood Purif. 2022, 51(2): 171-181.
审批编号:CN-100906
过期日期:2024-8-30
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不用于推广目的。
查看更多