查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





为全面反映2022年我国药品不良反应监测情况,提高安全用药水平,更好地保障公众用药安全,国家药品不良反应监测中心组织编撰《国家药品不良反应监测年度报告(2022年)》。
第1章 药品不良反应监测工作情况
2022年,国家药品不良反应监测中心在国家药品监督管理局的领导下,深入贯彻落实党中央、国务院决策部署,扎实开展药品不良反应监测评价工作,监测评价体系逐步健全,法规制度日趋完善,报告数量和质量稳步提升,监测评价手段和方法更加成熟,各项工作取得明显成效,为药品监管提供科学有力支撑,切实保护和促进公众健康。
一是统筹谋划,全力推动体系能力建设。贯彻落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》《“十四五”国家药品安全及促进高质量发展规划》,加强基层监测机构指导,开展调查研究和专项检查,督促药品上市许可持有人(以下简称“持有人”)落实主体责任,加快完善“一体两翼”工作格局。
二是聚势赋能,持续健全法规制度体系。配合推动《药品不良反应报告和监测管理办法》修订,发布《药物警戒体系主文件撰写指南》《药品上市许可持有人MedDRA编码指南》,指导持有人开展监测、报告、分析和评价工作,推动药物警戒制度建立健全。
三是持之以恒,不断提升技术支撑能力。服务疫情防控工作大局,加强《新型冠状病毒感染诊疗方案》涉及药品监测、分析和评价,切实保障疫情防控用药安全。密切关注国内外监管动态,强化监测数据分析评价。根据评价结果,及时发布药品安全警示信息,2022年国家局发布药品说明书修订公告24期。
四是持续发力,加快优化监测信息系统。加强基础设施建设,扩容计算存储资源,增加网络安全防护能力,不断完善监测系统,提升系统访问性能和报告效率,为监测评价提供有效技术支撑。
五是聚焦前沿,大力发展科研创新工作。加强与科研院所、高等院校、医疗机构合作,推动监管科学行动计划。加强重点实验室建设与课题研究,合作开展国家重点研发计划、科技部重大专项课题。建设创新药和附条件批准药品信号检测平台,不断探索研究监测评价新方法新工具。
第2章 药品不良反应/事件报告情况
2.1报告总体情况
2.1.12022年度药品不良反应/事件报告情况
2022年全国药品不良反应监测网络收到《药品不良反应/事件报告表》202.3万份。1999年至2022年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》2,085.6万份(图1)。
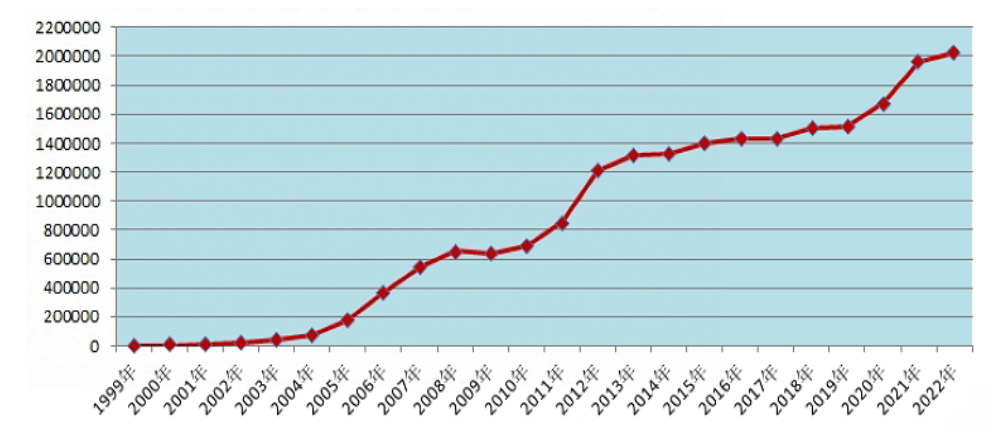
图1 1999年-2022年全国药品不良反应/事件报告数量增长趋势
2.1.2新的和严重药品不良反应/事件报告情况
2022年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告64.2万份,新的和严重药品不良反应/事件报告占同期报告总数的31.7%。
2022年全国药品不良反应监测网络收到严重药品不良反应/事件报告26.4万份,严重药品不良反应/事件报告占同期报告总数的13.0%(图2)。
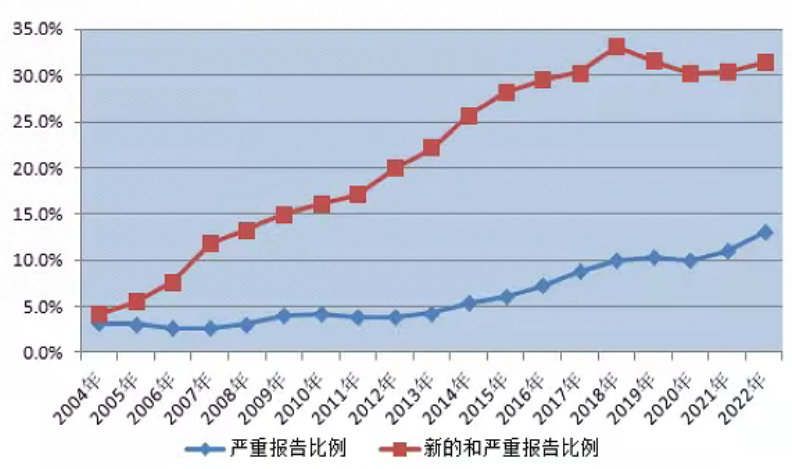
图2 2004年-2022年新的和严重以及严重药品不良反应/事件报告比例
药品不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。药品不良反应是药品的固有属性,一般来说,所有药品都会存在或多或少、或轻或重的不良反应。
药品不良反应监测是药品上市后安全监管的重要支撑,其目的是及时发现和控制药品安全风险。持有人、经营企业、医疗机构应当报告所发现的药品不良反应,国家鼓励公民、法人和其他组织报告药品不良反应。
经过各方努力,持有人、经营企业、医疗机构报告药品不良反应的积极性已经逐步提高,我国药品不良反应报告数量稳步增长,与欧盟、美国等国家和地区药品不良反应报告数量发展趋势相同。严重药品不良反应/事件报告比例是衡量报告总体质量和可利用性的重要指标之一,药品不良反应监测评价工作一直将收集和评价新的和严重药品不良反应作为重点内容。新的和严重药品不良反应报告,尤其是严重药品不良反应报告数量多了,并非说明药品安全水平下降,而是意味着监管部门掌握的信息越来越全面,对药品的风险更了解,风险更可控,对药品的评价更加有依据,监管决策更加准确。同样,在医疗实践中,能及时了解药品不良反应发生的表现、程度,并最大限度地加以避免,也是保证患者用药安全的重要措施。
2.1.3每百万人口平均报告情况
每百万人口平均报告数量是衡量一个国家药品不良反应监测工作水平的重要指标之一。2022年我国每百万人口平均报告数为1,435份。
2.1.4药品不良反应/事件县级报告比例
药品不良反应/事件县级报告比例是衡量我国药品不良反应监测工作均衡发展及覆盖程度的重要指标之一。2022年全国97.8%的县级地区报告了药品不良反应/事件。
2.1.5药品不良反应/事件报告来源
持有人、经营企业和医疗机构是药品不良反应报告的责任单位。按照报告来源统计,2022年来自医疗机构的报告占87.6%、来自经营企业的报告占8.1%、来自持有人的报告占4.2%、来自其他报告者的报告占0.1%(图3)。
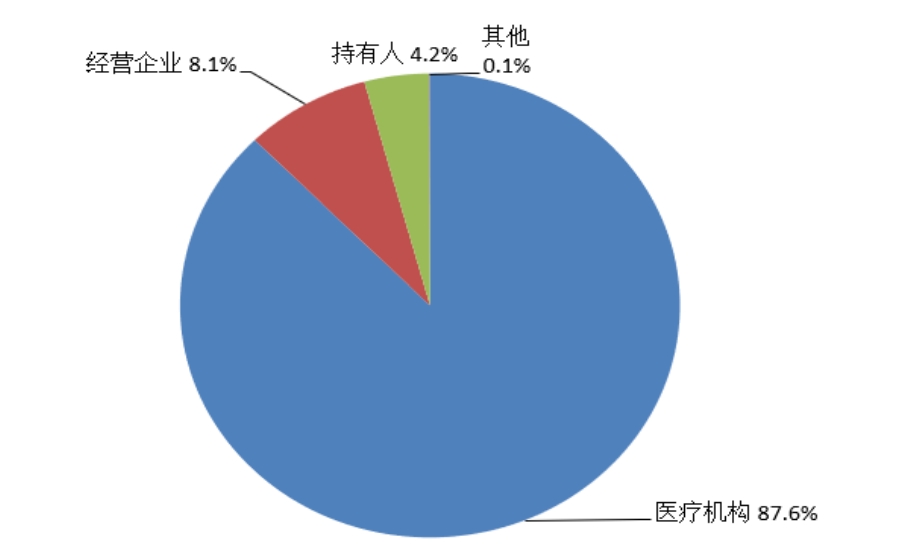
图3 2022年药品不良反应/事件报告来源
按照报告数量统计,2022年持有人报送药品不良反应/事件报告共计8.4万份,同比增长4.6%。其中,新的和严重药品不良反应/事件报告占持有人报告总数的42.3%,高于总体报告中新的和严重药品不良反应/事件报告占比。
2.1.6报告人职业
按照报告人职业统计,医生占55.9%、药师占25.8%、护士占12.5%、其他职业占5.8%(图4)。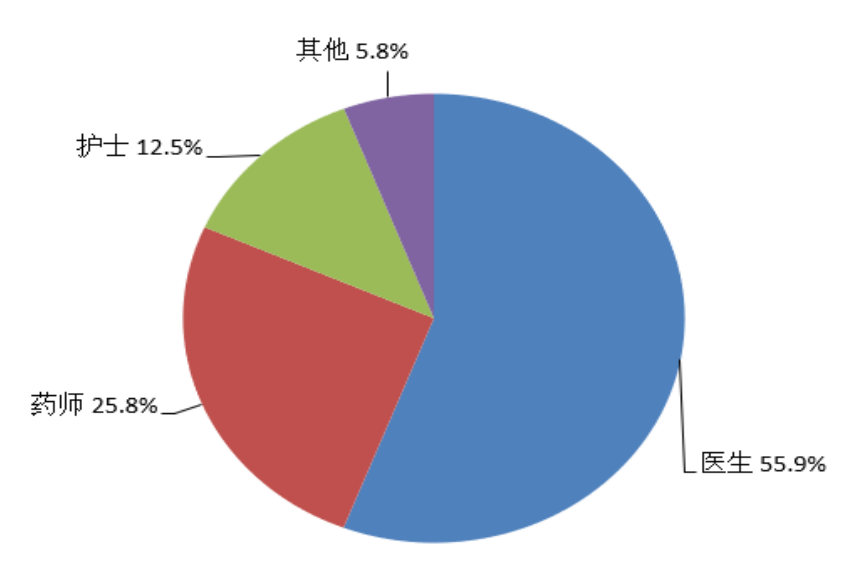
图4 2022年报告人职业构成
2.1.7药品不良反应/事件报告涉及患者情况
2022年药品不良反应/事件报告中,女性多于男性,性别比为0.87:1。从年龄分布看,14岁及以下儿童患者占7.8%,65岁及以上老年患者占32.3%(图5)。
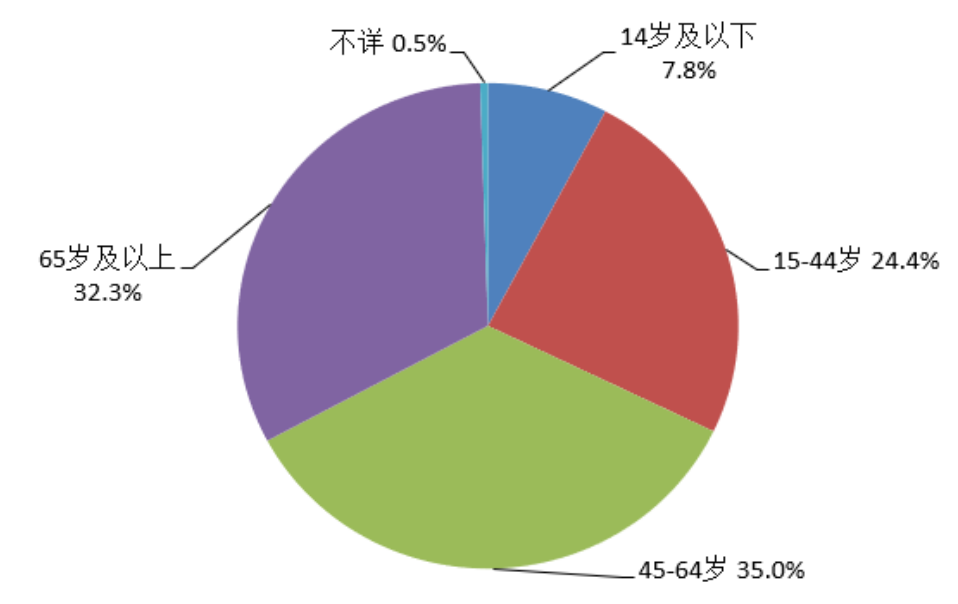 图5 2022年药品不良反应/事件报告涉及患者年龄
图5 2022年药品不良反应/事件报告涉及患者年龄
2.1.8药品不良反应/事件报告涉及药品情况
按照怀疑药品类别统计,化学药品占82.3%、中药占12.8%、生物制品占2.6%、无法分类占2.3%(图6)。
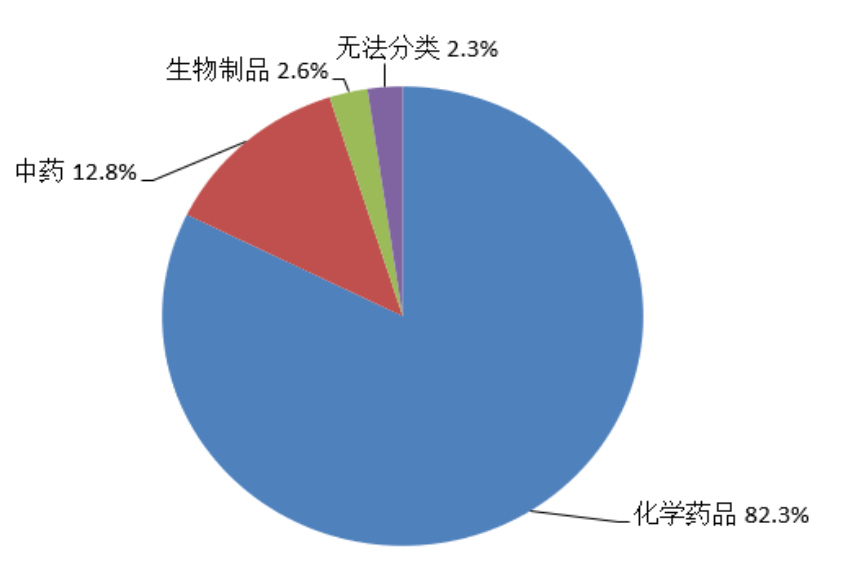
图6 2022年药品不良反应/事件报告涉及药品类别
按照给药途径统计,2022年药品不良反应/事件报告中,注射给药占55.1%、口服给药占36.6%、其他给药途径占8.3%;注射给药中,静脉注射给药占90.6%、其他注射给药占9.4%(图7)。
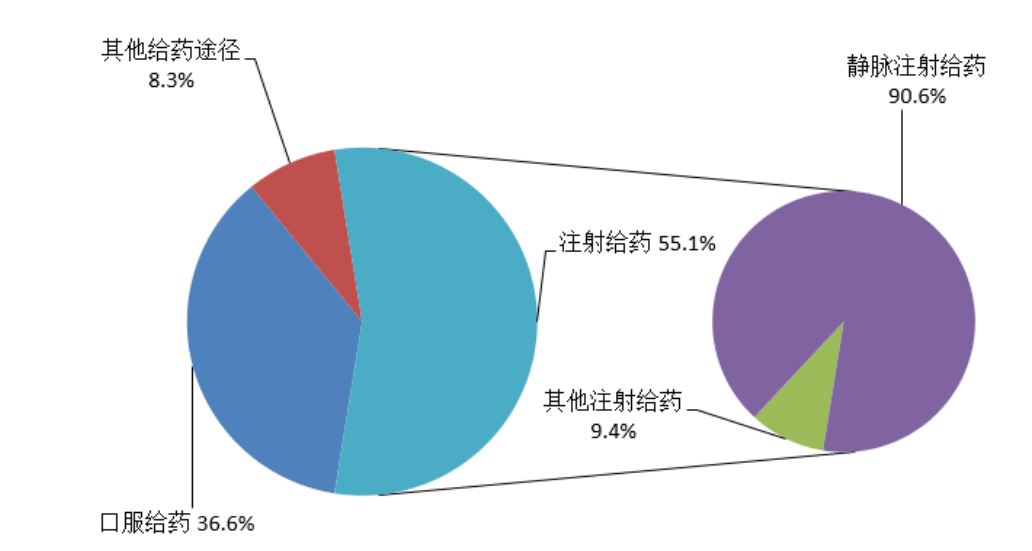
图7 2022年药品不良反应/事件报告涉及给药途径
2.1.9药品不良反应/事件累及器官系统情况
2022年报告的药品不良反应/事件中,累及器官系统排名前3位依次为胃肠系统疾病、皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应(图8)。
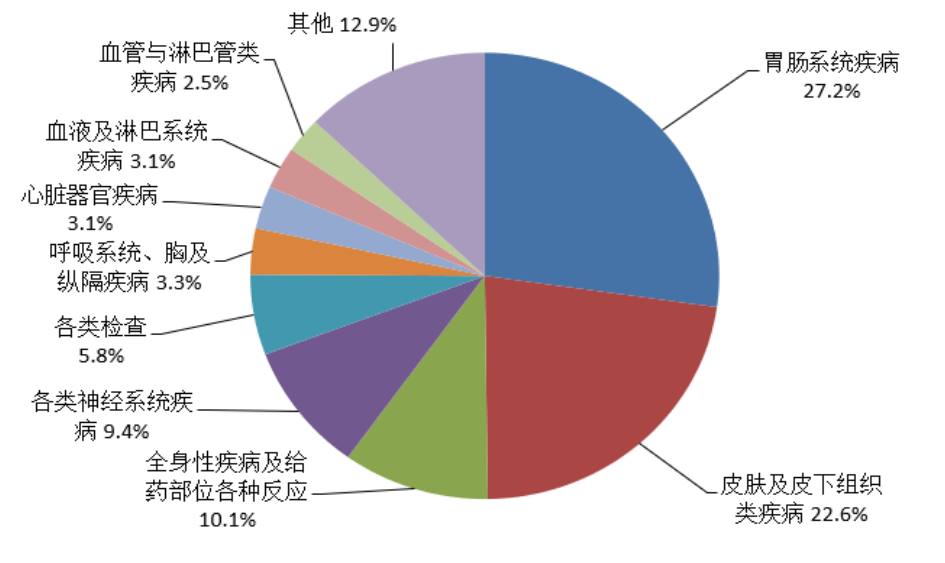
图8 2022年药品不良反应/事件累及器官系统
2.2化学药品、生物制品监测情况
2.2.1总体情况
2022年药品不良反应/事件报告中,涉及怀疑药品218.5万例次,其中化学药品占82.3%、生物制品占2.6%;2022年严重不良反应/事件报告涉及怀疑药品33.9万例次,其中化学药品占87.4%、生物制品占5.0%。
2.2.2涉及患者情况
2022年化学药品、生物制品不良反应/事件报告中,男女患者比为0.87:1,女性多于男性。14岁及以下儿童患者占8.1%,65岁及以上老年患者占32.6%。
2.2.3涉及药品情况
2022年药品不良反应/事件报告涉及的化学药品中,例次数排名前5位的类别依次为抗感染药、肿瘤用药、心血管系统用药、镇痛药、电解质/酸碱平衡及营养药。2022年严重药品不良反应/事件涉及化学药品中,报告数量最多的为肿瘤用药,占35.1%;其次是抗感染药,占27.8%。按严重报告占本类别报告比例计算,肿瘤用药的严重报告比例最高,为46.0%,其次是免疫系统用药,为19.1%。
2022年药品不良反应/事件报告涉及的生物制品中,细胞因子占74.2%、抗毒素及免疫血清占11.7%、血液制品占1.7%、诊断用生物制品占0.2%。按剂型统计,2022年化学药品不良反应/事件报告中,注射剂、口服制剂所占比例分别为59.9%和33.6%,其他剂型占6.5%。生物制品中,注射剂、口服制剂占比分别为74.7%和0.1%,其他制剂占25.2%。
2.2.4总体情况分析
与2021年相比,2022年药品不良反应/事件报告情况未出现显著变化。从不良反应涉及患者年龄看,14岁及以下儿童患者占比再次出现下降,总体安全性依然良好;65岁及以上老年患者占比仍然保持升高趋势,提示临床应持续加强对老年患者的安全用药管理。从化学药品类别上看,抗感染药报告数量仍居于首位,占比继续保持下降趋势;肿瘤用药占比持续升高,其严重报告构成比居首位,提示临床应始终关注该类药品的风险。
感冒多为自限性疾病,一般可自行恢复。如果感冒对学习、工作和生活造成严重影响,可选用感冒药进行治疗。感冒药种类繁多,一般由多种药品成分组成,用于缓解各类感冒症状。化药类感冒药主要成分包括解热镇痛药(如对乙酰氨基酚、布洛芬)、抗组胺药(如氯苯那敏)、减鼻充血药(如盐酸伪麻黄碱)、镇咳药(如右美沙芬)、祛痰药(如愈创木酚甘油醚)等,其中抗组胺药和减鼻充血药可缓解鼻塞、流涕、流泪、打喷嚏等症状。中药感冒药主要由辛温解表(如麻黄,桂枝、紫苏等)或辛凉解表(如薄荷、牛蒡子、桑叶等)或解暑化湿的药味组成(如藿香、香薷、佩兰等);风热感冒或温病初起咽喉肿痛等,也包括使用一些清热解毒类药物(如金银花、连翘、板蓝根等)。此外,感冒药中还有一些中西药复方制剂,由中药和化药成分共同组成。
患者自行用药应仔细阅读说明书,注意感冒药的成分,避免同时服用含有相同成分的不同药品,防止药物过量风险。例如,过量服用对乙酰氨基酚可能引起严重肝功能损伤,甚至引发肝衰竭。既往有肝脏疾病或者长期饮酒者使用对乙酰氨基酚发生肝损伤的风险更高。此外,感冒药中的抗组胺药成分(如氯苯那敏、苯海拉明等)可能引起嗜睡、困倦,患者应尽量避免在服药期间驾驶车船或操作机器等。2岁以下婴幼儿因机体功能发育不完全,使用感冒药可能出现严重不良反应;如确需用药,建议使用儿童专用剂型,并在医师或药师的指导下用药。如果感冒症状不能缓解或有加重趋势,建议及时就医。
2.3中药监测情况
2.3.1总体情况
2022年药品不良反应/事件报告中,涉及怀疑药品218.5万例次,其中中药占12.8%;2022年严重不良反应/事件报告涉及怀疑药品33.9万例次,其中中药占5.9%。
2.3.2涉及患者情况
2022年中药不良反应/事件报告中,男女患者比为0.8:1,女性多于男性。14岁及以下儿童患者占5.8%,65岁及以上老年患者占30.3%。
2.3.3涉及药品情况
2022年药品不良反应/事件报告涉及的中药中,例次数排名前5位的类别分别是理血剂中活血化瘀药(23.4%)、清热剂中清热解毒药(12.3%)、祛湿剂中清热除湿药(7.6%)、祛湿剂中祛风胜湿药(5.0%)、补益剂中益气养阴药(4.0%)。2022年中药严重不良反应/事件报告的例次数排名前5位的类别分别是理血剂中活血化瘀药(36.4%)、清热剂中清热解毒药(9.9%)、补益剂中益气养阴药(8.5%)、开窍剂中凉开药(5.5%)、补益剂中补阳药(5.0%)。
2022年中药不良反应/事件报告按照给药途径统计,注射给药占24.8%、口服给药占62.5%、其他给药途径占12.7%;注射给药中,静脉注射给药占97.1%、其他注射给药占2.9%。
2.3.4总体情况分析
与2021年相比,2022年中药不良反应/事件报告数增长率为2.1%,严重报告占比为5.8%,低于总体药品不良反应/事件报告中严重报告占比。从给药途径看,注射给药占比有所下降。从药品类别上看,活血化瘀药的报告数量依然居首位,但占比略有下降。从总体情况看,2022年中药占总体不良反应/事件报告比例呈下降趋势,但仍需要注意安全用药。
“是药三分毒”,中药和其他药品一样,在发挥治疗作用的同时,也可能会产生一定不良反应。辨证论治是中医认识疾病和治疗疾病的基本原则,严格按照说明书规定的功能主治使用中药,有助于减少和避免不良反应/事件的发生。如果不遵循中医辨证论治的原则或者辨证不当、超说明书功能主治用药,可能增加中药不良反应/事件发生风险。随着中药临床使用日趋广泛,应提高中药安全使用意识。
2.4基本药物监测情况
2.4.1国家基本药物监测总体情况
2022年全国药品不良反应监测网络共收到《国家基本药物目录(2018年版)》收载品种的不良反应/事件报告94.2万份,其中严重报告13.3万份,占14.1%。报告涉及化学药品和生物制品占88.1%,中成药占11.9%。
2.4.2国家基本药物化学药品和生物制品情况分析
《国家基本药物目录(2018年版)》化学药品和生物制品部分共417个(类)品种。2022年全国药品不良反应监测网络共收到国家基本药物化学药品和生物制品药品不良反应/事件报告89.1万例次,其中严重报告15.7万例次,占17.6%。
2022年国家基本药物化学药品和生物制品不良反应/事件报告按照药品类别统计,报告数量排名前5位的分别是抗微生物药、抗肿瘤药、心血管系统用药、激素及影响内分泌药、治疗精神障碍药;累及器官系统排名前5位的是胃肠系统疾病、皮肤及皮下组织类疾病、各类神经系统疾病、全身性疾病及给药部位各种反应、各类检查。
2.4.3国家基本药物中成药情况分析
《国家基本药物目录(2018年版)》中成药共涉及268个品种。2022年全国药品不良反应监测网络收到国家基本药物中成药不良反应/事件报告12.0万例次,其中严重报告6,962例次,占5.8%。2022年国家基本药物7大类中成药中,药品不良反应/事件报告总数由多到少依次为内科用药、骨伤科用药、妇科用药、外科用药、耳鼻喉科用药、儿科用药、眼科用药。
监测数据表明,2022年国家基本药物监测总体情况基本保持平稳。
2018年11月1日起,我国正式启用《国家基本药物目录(2018年版)》。该目录主要分为化学药品和生物制品、中成药和中药饮片三个部分。其中化学药品和生物制品部分包括抗微生物药、抗寄生虫病药、麻醉药等26类药品,中成药部分包括内科用药、外科用药、妇科用药等7类药品。与2012年版基本药物目录相比,2018年版基本药物目录共调入药品187种,调出22种(其中17种为化药),目录总品种数量由原来的520种增加到685种,其中西药417种、中成药268种。
第3章 相关风险控制措施
根据2022年药品不良反应监测数据和分析评价结果,国家药品监督管理局对发现存在安全隐患的药品及时采取相应风险控制措施,以保障公众用药安全。
发布注销莲必治注射液药品注册证书的公告。发布西咪替丁注射制剂、小儿化痰止咳制剂、甲氨蝶呤口服制剂等药品说明书修订公告共24期,增加或完善33个(类)品种说明书中的警示语、不良反应、注意事项、禁忌等安全性信息。
发布《药物警戒快讯》12期,报道国外药品安全信息48条。
第4章 各论
根据药品不良反应监测结果以及公众关注情况,对抗感染药、心血管系统用药、抗变态反应药、儿童用药的不良反应报告情况进行分析,并提示安全风险如下。
4.1抗感染药不良反应监测情况
抗感染药是指具有杀灭或抑制各种病原微生物作用的药品,包括抗生素、合成抗菌药、抗真菌药、抗病毒药等,是临床应用最为广泛的药品类别之一,其不良反应/事件报告数量一直居于首位,是药品不良反应监测工作关注的重点。
2022年全国药品不良反应监测网络共收到抗感染药不良反应/事件报告56.6万份,其中严重报告7.5万份,占13.2%。抗感染药不良反应/事件报告数量占2022年总体报告数量的28.0%。
4.1.1涉及药品情况
2022年抗感染药不良反应/事件报告数量排名前3位的药品类别分别是头孢菌素类、喹诺酮类、青霉素类,严重不良反应/事件报告数量排名前3位的药品类别分别是头孢菌素类、喹诺酮类、抗结核病药。
2022年抗感染药不良反应/事件报告中,注射剂占76.9%、口服制剂占18.8%、其他剂型占4.3%,与药品总体报告剂型分布相比注射剂比例偏高;严重不良反应/事件报告中,注射剂占78.3%、口服制剂占19.7%、其他剂型占2.0%。
4.1.2累及器官系统情况
2022年抗感染药不良反应/事件报告中,总体报告和严重报告的药品不良反应/事件累及器官系统情况详见图9。与抗感染药的总体报告相比,严重报告的全身性疾病及给药部位各种反应,免疫系统疾病,各类检查,呼吸系统、胸及纵隔疾病,心脏器官疾病构成比偏高。
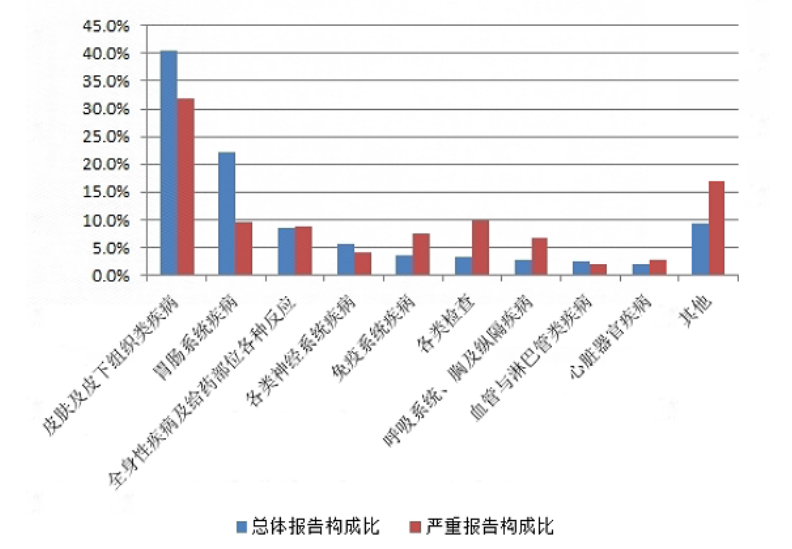
图9 2022年抗感染药不良反应/事件累及器官系统
抗感染药药品不良反应/事件总体报告中,口服制剂累及器官系统排名前5位的是胃肠系统疾病、皮肤及皮下组织类疾病、各类神经系统疾病、各类检查、肝胆系统疾病;注射剂累及器官系统排名前5位是皮肤及皮下组织类疾病、胃肠系统疾病、全身性疾病及给药部位各种反应、各类神经系统疾病、免疫系统疾病。
抗感染药严重药品不良反应/事件报告中,口服制剂累及器官系统排名前5位是皮肤及皮下组织类疾病、肝胆系统疾病、各类检查、胃肠系统疾病、代谢及营养类疾病;注射剂累及器官系统排名前5位是皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应、胃肠系统疾病、免疫系统疾病、各类检查。
4.1.3监测情况分析及安全风险提示
近年来,抗感染药不良反应/事件报告占总体报告比例呈现持续下降趋势,提示抗感染药的临床使用可能更趋于合理,但其严重不良反应报告数量仍然较高,抗感染药的用药风险仍需继续关注。
头孢唑林为β内酰胺类广谱抗生素,为第一代注射用头孢菌素。接受头孢唑林注射剂治疗的患者有发生严重不良反应的风险,包括过敏性休克、严重皮肤过敏反应、粒细胞缺乏症、肾损害等。使用头孢唑林前必须详细询问患者先前有否对头孢唑林、其他头孢菌素类、青霉素类或其他药物的过敏史,有青霉素类药物过敏性休克史者应禁用头孢唑林。因肾功能受损或肾功能不全而导致的低尿量患者,应谨慎使用头孢唑林,应用时必须减量,如果对肾功能受损的患者(肌酐清除率小于55mL/min)给予不适当的高剂量,可能会引起癫痫发作。肝功能损害、肾功能损害或营养不良的患者,疗程较长的患者和以往经抗凝治疗稳定的患者,可出现头孢唑林相关的凝血酶原活性下降的风险。头孢唑林慎用于有胃肠道疾病,特别是有结肠炎病史的患者。
4.2心血管系统用药不良反应监测情况
心血管系统用药是指用于心脏疾病治疗、血管保护、血压和血脂调节的药品,包括降血压药、抗心绞痛药、血管活性药、抗动脉粥样硬化药、抗心律失常药、强心药和其他心血管系统用药。与2021年相比,心血管系统用药不良反应/事件报告数量同期下降,严重报告数量同期上升1.2个百分点,提示应对该类药品严重风险给予更多关注。
2022年全国药品不良反应监测网络共收到心血管系统用药的不良反应/事件报告17.5万份,占总体报告的8.7%;其中严重报告1.3万份,占7.2%。
4.2.1涉及药品情况
2022年心血管系统用药不良反应/事件报告数量排名前3位的药品类别是降血压药、抗心绞痛药、血管活性药;心血管系统用药严重报告数量排名前3位的药品类别是抗动脉粥样硬化药、降血压药、血管活性药。
2022年心血管系统用药不良反应/事件报告中,注射剂占26.8%、口服制剂占71.5%、其他剂型占1.7%;严重报告中,注射剂占36.4%、口服制剂占60.6%、其他剂型占3.0%。
4.2.2累及器官系统情况
2022年心血管系统用药不良反应/事件报告中,总体报告和严重报告的药品不良反应/事件累及器官系统情况详见图10。2022年心血管系统用药不良反应/事件报告中,口服制剂累及器官系统排名前5位是各类神经系统疾病,胃肠系统疾病,全身性疾病及给药部位各种反应,皮肤及皮下组织类疾病,呼吸系统、胸及纵隔疾病;注射剂累及器官系统前5位是各类神经系统疾病、胃肠系统疾病、皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应、心脏器官疾病。
2022年心血管系统用药严重不良反应/事件报告中,口服制剂累及器官系统排名前5位的是肝胆系统疾病、各类检查、各类神经系统疾病、皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应;注射剂累及器官系统排名前5位的是全身性疾病及给药部位各种反应、各类神经系统疾病、皮肤及皮下组织类疾病、心脏器官疾病、胃肠系统疾病。
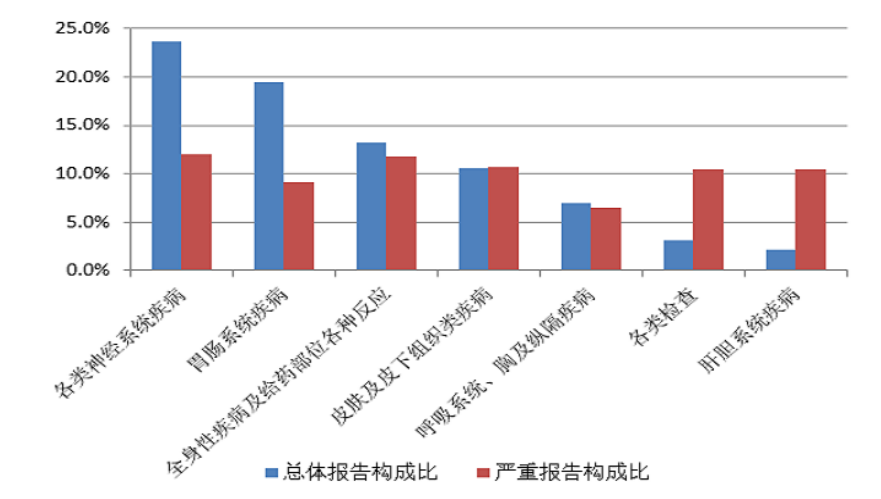
图10 2022年心血管系统用药不良反应/事件累及器官系统
4.2.3监测情况分析及安全风险提示
2022年心血管系统用药不良反应/事件报告中,老年患者报告占比及严重报告占比仍明显高于总体报告中该年龄组患者水平,提示老年患者是心血管系统用药的主要群体。老年人为心血管疾病的高发人群,同时老年患者有不同程度的肝肾功能减退,医务人员在用药时应关注老年患者发生药品不良反应的风险。2022年心血管系统用药不良反应/事件报告中,口服制剂的报告占比明显高于注射剂,提示心血管系统用药不良反应/事件报告更多来自口服给药途径;严重不良反应/事件报告中,阿托伐他汀报告数量位居首位。阿托伐他汀为他汀类调脂药物,血脂调节药品在临床上不仅用于血脂代谢紊乱及相关心血管疾病的治疗,还用于此类疾病的预防。提示医务人员和患者应关注此类药品发生药品不良反应的风险。
临床常用的血管活性药物有血管收缩药和血管扩张药,血管收缩药有去甲肾上腺素、肾上腺素等,血管扩张药有酚妥拉明、异丙肾上腺素、硝酸甘油等。血管活性药物通过调节血管的收缩和舒张状态改变血管功能,进一步促使改善微循环血流灌注,临床上用于抢救重症患者,尤其是休克患者的治疗。
血管活性药物使用时需注意以下几个方面:(一)需要从小剂量低浓度开始,同时密切监测血压等生命体征。(二)严防使用时外渗,发现局部红肿疼痛等情况时及时更换输注的血管,必要时局部给予普鲁卡因封闭,防止局部坏死。(三)停药时应该逐步减量,严防突然撤药引起不良反应。(四)应用时注意药物浓度和输注速度,最好使用微量泵控制输注速度。
4.3抗变态反应药不良反应监测情况
抗变态反应药主要用于防治机体因各种抗原性物质(如细菌、病毒、寄生虫、花粉等)引起的过敏反应性疾病,包括抗组胺药、过敏介质阻释药等。
2022年全国药品不良反应监测网络共收到抗变态反应药不良反应/事件报告1.3万份,其中严重报告524份,占3.9%。抗变态反应药不良反应/事件报告占2022年总体报告的0.7%。
4.3.1涉及药品情况
2022年抗变态反应药不良反应报告/事件中3类药物的排名依次为抗组胺药、过敏介质阻释药、其它抗变态反应药,严重不良反应/事件报告数量排名前3位的药品类别分别是抗组胺药、其它抗变态反应药、过敏介质阻释药。
2022年抗变态反应药不良反应/事件报告中,口服制剂占84.7%、注射剂占10.1%、其他剂型占5.2%;严重不良反应/事件报告中,口服制剂占48.8%、注射剂占39.4%、其他剂型占11.8%。
4.3.2累及器官系统情况
2022年抗变态反应药不良反应/事件报告中,总体报告和严重报告的药品不良反应/事件累及器官系统情况详见图11。与抗变态反应药的总体报告相比,严重报告的药品不良反应/事件累及器官系统中,皮肤及皮下组织类疾病,精神病类,呼吸系统、胸及纵隔疾病,心脏器官疾病,眼器官疾病,免疫系统疾病构成比明显偏高。
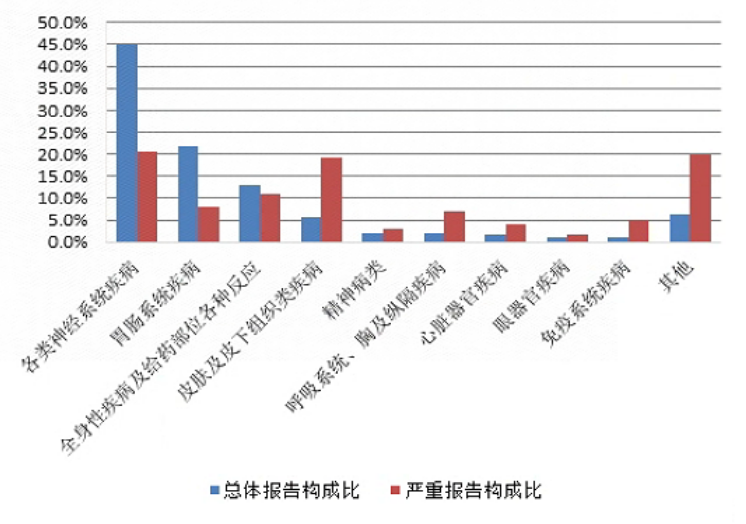
图11 2022年抗变态反应药不良反应/事件累及器官系统
抗变态反应药总体不良反应/事件报告中,口服制剂累及器官系统排名前5位的是各类神经系统疾病、胃肠系统疾病、全身性疾病及给药部位各种反应、皮肤及皮下组织类疾病、心脏器官疾病;注射剂累及器官系统排名前5位是各类神经系统疾病、全身性疾病及给药部位各种反应、胃肠系统疾病、皮肤及皮下组织类疾病、精神病类。
抗变态反应药严重药品不良反应/事件报告中,口服制剂累及器官系统排名前5位是各类神经系统疾病、皮肤及皮下组织类疾病、胃肠系统疾病、全身性疾病及给药部位各种反应、肝胆系统疾病;注射剂累及器官系统排名前5位是各类神经系统疾病,皮肤及皮下组织类疾病,全身性疾病及给药部位各种反应,免疫系统疾病,呼吸系统、胸及纵隔疾病。
4.3.3监测情况分析及安全风险提示
从药品不良反应/事件监测数据看,抗变态反应药严重报告比例较低,安全性整体情况平稳。
在变态反应性疾病(如荨麻疹、过敏性鼻炎等)治疗中,抗组胺药是较常用的药物,其中有许多药物在我国作为非处方药管理,包括以苯海拉明、异丙嗪、氯苯那敏、赛庚啶等为代表的第一代抗组胺药和以西替利嗪、氯雷他定为代表的第二代抗组胺药。第一代抗组胺药最常见的不良反应是中枢抑制作用引起的嗜睡、困倦等反应以及抗胆碱作用引起的口干、视物模糊、眼内压升高等反应;同时,抗胆碱作用还可加重前列腺肥大患者的尿潴留症状。因此,驾驶员、操作精密仪器、从事高空作业者以及青光眼、前列腺肥大患者不宜选用第一代抗组胺药。相对而言,第二代抗组胺药的副作用较小,但也有少数患者可能出现类似反应。极少数使用抗组胺药的患者会出现严重甚至危及生命的心脏反应,尤其是通过肝药酶CYP3A4代谢的第二代抗组胺药与CYP3A4抑制剂(如红霉素、阿奇霉素、酮康唑等药物)同用时;所有抗组胺药过量服用都有可能产生严重的心脏毒性。因此应严格按说明书的用法用量使用抗组胺药,需要同时服用其他药物时应咨询医师或药师。
4.4儿童用药监测情况
2022年国家药品不良反应监测网络共收到0-14岁儿童患者报告占总报告数7.8%。儿童患者严重报告占儿童患者总报告数11.4%。
4.4.1涉及患者情况
2022年儿童患者药品不良反应/事件报告中,男性和女性患者比例为1.3:1,男性高于女性。2022年儿童患者药品不良反应/事件报告年龄分组情况见图12。
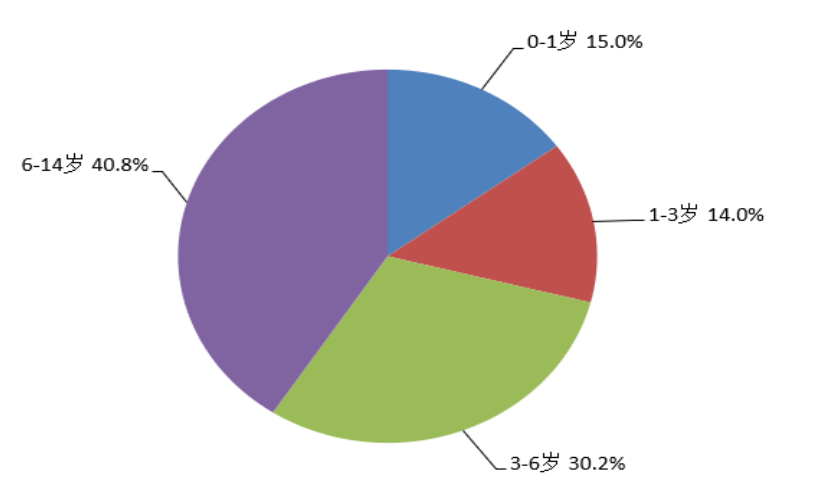
图12 2022年儿童患者药品不良反应/事件报告涉及儿童患者年龄
4.4.2涉及药品情况
按照药品类别统计,化学药例次占86.5%、中药例次占9.4%、生物制品例次占4.1%。化学药品排名前5位的是抗感染药、电解质/酸碱平衡及营养药、呼吸系统用药、代谢及内分泌系统用药、镇痛药。中药排名前5位的是清热剂、解表剂、止咳平喘剂、祛痰剂、祛湿剂。生物制品共涉及5个药品分类,分别为其他生物制品、细胞因子、抗毒素及免疫血清、血液制品、诊断用生物制品。
2022年儿童患者药品不良反应/事件报告中,注射剂占71.0%、口服制剂占22.1%、其他制剂占6.9%;化学药品不良反应/事件报告中,注射剂、口服制剂所占比例分别为75.0%和18.8%;中成药不良反应/事件报告中,注射剂、口服制剂所占比例分别为22.7%和70.6%;生物制品中,注射剂占比例40.4%。
4.4.3累及器官系统情况
2022年儿童患者药品不良反应/事件报告中,累及系统排名前3位的是皮肤及皮下组织类疾病、胃肠系统疾病、全身性疾病及给药部位各种反应(图13)。化学药累及系统前3位的与总体一致,中成药累及系统排名前3位的是胃肠系统疾病、皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应。生物制品累及系统与整体排序有所差异,分别是各类检查、全身性损害、皮肤及皮下组织类疾病。
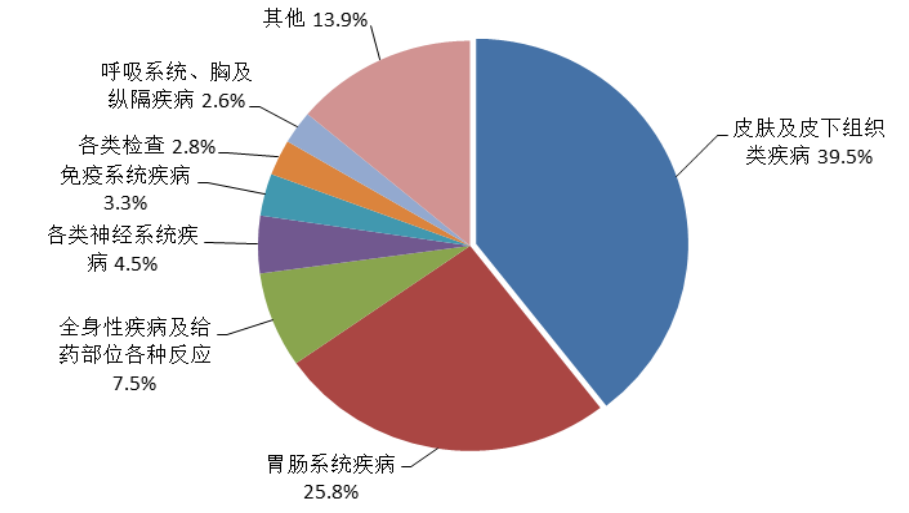
图13 2022年儿童患者药品不良反应/事件累及器官系统
4.4.4监测情况分析及安全风险提示
2022年儿童患者药品不良反应/事件报告占报告总数的7.8%,严重报告占比低于总体严重报告占比,总体风险可控。儿童患者用药的化学药品中,抗感染药和呼吸系统用药的构成比高于该类别药品在化学药总体报告中的构成比,提示儿童患者使用以上药品较多,不良反应发生情况较多;中药排名靠前的药品类别为清热剂、解表剂、止咳平喘剂、祛痰剂,这4类药品的使用与儿童疾病谱和生理特点有关。
药物治疗是儿童防病治病的主要手段,儿童正处于迅速生长发育的阶段,生理特点独特,对药物具有特殊的反应性和敏感性,药效学、药动学与成人相比有很大的差异,儿童用药的安全性与成人相比具有更多的复杂性,因此仍应持续关注儿童人群用药安全。
儿童有别于成人,其器官功能尚未发育完全,肝脏解毒和肾脏排泄等功能较弱,因此对药物的耐受性较差,如果用药不当,很容易引起不良反应/事件,甚至对健康造成甚于疾病本身的严重危害。特别是2岁以下儿童,用药尤需慎重。
儿童用药时要考虑小儿的生理特点,勿将大人的药给小儿服用;家长要遵医嘱用药,正确计算用药的剂量,即按照体表面积或体重来计算用药剂量,不可自作主张给孩子增加或减少剂量;应严格按剂量要求、按时用药,有时儿童家长,因治疗心切,希望“立杆见影”,往往自行加量,这是非常危险的。如果漏服一次药,下次服药时自行服用双倍剂量,很容易发生不良后果。服药过量造成的危害,可能比原疾病更为严重。
要注意药物的毒副作用,并向医生反映孩子曾有哪些药物过敏或其它不良反应史,以提醒医生用药;在孩子服药过程中,家长要注意观察,若发现有与原疾病无关的表现时,或出现药物治疗相关的异常反应,应及时就诊。能用一种药尽量不再加另一种药,尤其是新生儿,以防发生不良反应或中毒;儿童用药需要注意的除了剂量之外,还有服药时间,哪些药物需要饭前吃,哪些药物适合饭后吃,哪些药不适宜一起吃,都要向医生或药师咨询清楚。
家长应将药物放在小儿不能触及的地方,不要与食物放在一起。家长喂药时,不要骗孩子这是糖果,避免给孩子错误的认知,造成不良后果。孩子喜欢模仿,好奇心强,因此父母自己服药时应避开孩子。家长应对孩子进行相关教育,简单介绍一下家里各种包装的药物的相关作用,告知孩子不可自行服用。家中常备用药应分门别类,不同药物分开放置,如内服药和外用药应分开放置,儿童药物与成人药物分开放置,以防拿错造成不必要的后果。家庭用药应保存完整的外包装及说明书,可有效防止误食过期变质药物,同时可提醒家长相关的用量用法,了解不良反应和注意事项,避免发生不良后果。万一出现小儿误食药物导致中毒的情况,请记住一定要带上可疑药物,及时把孩子送往医院救治。
第5章 有关说明
5.1本年度报告中的数据来源于国家药品不良反应监测数据库中2022年1月1日至2022年12月31日各地区上报的数据。
5.2与大多数国家一样,我国药品不良反应报告是通过自发报告系统收集并录入到数据库中的,存在自发报告系统的局限性,如漏报、填写不规范、信息不完善、无法计算不良反应发生率等。
5.3每种药品不良反应/事件报告的数量受到该药品的使用量和不良反应发生率等诸多因素的影响,故药品不良反应/事件报告数量的多少不直接代表药品不良反应发生率的高低或者严重程度。
5.4本年度报告完成时,其中一些严重报告、死亡报告尚在调查和评价的过程中,所有统计结果均为现阶段数据收集情况的真实反映,并不代表最终的评价结果。
5.5本年度报告相关医学术语统计采用人用药品技术要求国际协调理事会(ICH)监管活动医学词典(MedDRA)。MedDRA是在ICH主办下编制的标准化国际医学术语集,用于与人用医疗产品相关的监管沟通和数据评估。各类检查是MedDRA中的一项系统器官分类,包括有限定词(例如:升高、降低、异常、正常)和没有限定词的检查名称。
5.6专业人士会分析药品与不良反应/事件的关联性,提取药品安全性风险信息,根据风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入安全性信息,更新药品如何安全使用的信息等。当药品的获益不再大于风险时,药品也会撤市。
5.7本年度报告数据均来源于全国药品不良反应监测网络,不包含疫苗不良反应/事件的监测数据。
来源:国家药品监督管理局药品评价中心
查看更多