查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近年来,我国呼吸危重症医学发展迅速,已成为应对重大呼吸系统疾病风险的坚实盾牌。本次呼吸危重症专辑邀请了中国医学论坛报社呼吸与危重症编委会编委,中南大学湘雅医院呼吸与危重症医学科、呼吸重症监护专科(RICU)主任李园园教授以“呼吸危重症”为主题组稿,分享“湘雅呼吸危重症”诊疗经验。


自20世纪80年代末发现NO的生理作用以来,其治疗潜力越来越受到临床医生的关注。NO是一氧化氮合酶(NOS)通过氧化L-瓜氨酸和L-精氨酸产生的内源性分子。它由健康内皮细胞分泌,通过激活可溶性鸟苷酸环化酶(sGC)来产生环磷酸鸟苷(cGMP),进而激活cGMP依赖的蛋白激酶(PKG),导致一系列调节机制减少细胞内钙离子浓度,松弛血管平滑肌张力,从而实现血管扩张。此外,NO通过抑制关键促炎细胞因子[包括白介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-6和干扰素(IFN)-γ]的表达来调节炎症反应,以及通过影响T细胞增殖和肥大细胞分泌活性来调节免疫和过敏反应。此外,NO通过抑制病毒核糖核酸(RNA)和脱氧核糖核酸(DNA)合成等机制表现出抗病毒特性。
NO可作为iNO或由NO供体携带进入体内发挥作用,如硝普钠或通过胃肠外途径给药的有机硝酸盐。iNO作为一种选择性肺血管扩张剂,可诱导通气肺区域的肺血管舒张,在不降低全身血压的情况下改善氧合,其临床应用涵盖了新生儿呼吸窘迫综合征、肺动脉高压、急性呼吸窘迫综合征(ARDS)等多种呼吸危重症。



无论是儿童还是成人,iNO在治疗肺动脉高压方面都展现出了良好的效果。在新生儿持续性肺动脉高压(PPHN)治疗中,我国专家建议iNO作为足月或近足月儿PPHN的标准治疗手段。美国食品与药物管理局(FDA)建议PPHN患儿可接受20 ppm剂量的iNO治疗,疗程可达14d。iNO可改善PPHN足月和晚期早产儿的氧合并减少体外膜肺氧合(ECMO)的使用。最近一项观察性研究表明,iNO治疗在改善早产儿和足月新生儿的氧合方面同样有效。因胎膜早破或羊水过少而疑似肺发育不全的婴儿最有可能受益。
iNO通常用于成人或儿童PAH患者的急性血管反应性测试,以识别在没有严重血管重塑的情况下主要由肺血管阻力(PVR)增加引起的PAH患者。iNO主要检测特发性、遗传性或药物性PAH患者,因为他们最有可能表现出血管反应性。根据当前指南的建议,该测试在开始任何PAH特异性治疗之前进行,以筛选对口服高剂量钙通道阻滞剂有效的患者。如果PAH与肺静脉高压并存,慢性血管舒张治疗可诱发肺水肿。在这种情况下,短时间iNO可用于确定肺动脉血管扩张剂是否不利。

iNO在ARDS的治疗中也具有一定的应用价值。它可以改善患者的氧合状态,减轻肺部炎症反应,从而在一定程度上缓解呼吸窘迫的症状。
iNO是一种有效的选择性肺血管扩张剂,它的半衰期仅2~6 s,并且通过吸入局部递送。这些特性使得iNO能够选择性地扩张通气肺单位的肺血管,从而改善通气/灌注(V/Q)匹配,而不会引起全身性低血压。在临床应用中iNO并不是ARDS常规治疗的一部分,而是作为严重低氧血症的“抢救性”治疗策略之一。这是因为其短暂效应在24~48 h后消失,并且在改善生存率或其他临床结局[例如28 d无机械通气天数、重症监护病房(ICU)住院时间]无优势。因此,英国重症监护指南不建议在ARDS患者中使用iNO。美国胸科协会目前的ARDS治疗指南没有对iNO的使用提出任何建议。然而,尽管没有观察到明显的临床益处,但全球仍有高达13%的严重ARDS患者使用iNO。

COVID-19大流行导致高ICU住院率和ARDS高发病率,严重低氧血症患者可能需要ECMO支持,但全球各地医疗保健系统资源有限,因此,iNO由于其改善 V/Q 比例的特性,可以作为替代方案或桥梁。相关研究显示,iNO有抑制新型冠状病毒复制的作用。iNO 的其他潜在益处是支气管舒张和抗炎作用。
在机械通气患者中,iNO剂量为10~80 ppm。一项关于治疗16例COVID-19相关难治性低氧血症患者 的研究显示,20~30 ppm 的 iNO 不能改善氧合,但如患者同时合并右心室功能不全,则可观察到 iNO 反应更好的趋势。而另一项针对10名严重低氧血症患者的初步研究显示,在20ppm的iNO试验30min后,对氧合没有改善。与之相对,一项研究表明,当氧合指数比低于150 mmHg时,给予10 ppm及逐步升高的iNO后,即使考虑潜在的混杂因素,iNO也与氧合指数的显著改善密切相关;另一项对12名患者的研究表明,iNO20~80 ppm使仰卧位氧合指数从136 mmHg上升为170 mmHg,死腔通气比从0.54降低到0.46,俯卧位下进一步将氧合指数从145 mmHg增加到205 mmHg。最近一项多中心随机单盲研究证实,入住ICU并接受插管和机械通气的COVID-19感染合并严重ARDS成年患者,接受48h的80ppm iNO治疗后,氧合指数有明显改善,但28 d和90 d无机械通气时间和死亡率没有差异。iNO剂量和iNO给药时间的差异(插管后早期与晚期抢救治疗)可能解释了这些结果存在相互矛盾的原因。但大多数研究证实在COVID-19感染合并严重ARDS患者中应用iNO可以改善氧合。
iNO也被建议作为重度COVID-19自主呼吸患者的辅助治疗。29例确诊为新型冠状病毒感染且咳嗽或呼吸急促患者通过面罩接受高剂量iNO,每日两次,持续30 min,最多14 d,直至症状消退、出院、插管或过渡到姑息治疗。iNO降低了呼吸急促患者的呼吸频率,并在存在低氧血症时改善了氧合。此外,iNO在自主呼吸患者中耐受性良好,并且安全。迄今为止,由于数据的缺失和研究质量有限,无法推断iNO在COVID-19患者中的疗效,需要进一步随机对照试验来阐明。


目前,已被广泛证实安全可用的iNO输送系统为加压气瓶作为NO的来源,然后使用传感器来控制NO的输送浓度并监测二氧化氮(NO2)浓度,但这种输送系统相对比较笨重和昂贵。近年来,新型轻质、便携、经济的氮氧化物发生器和输送系统已经被开发出来,包括电弧iNO和电化学iNO。研究表明,在通过这种新系统呼吸NO期间或之后没有发生不良事件,高铁血红蛋白和NO2水平保持在安全范围内。该设备将允许在门诊或院外环境中使用iNO,并且由于其经济性,将增加NO治疗的可及性。此外,它将允许NO作为一种潜在的慢性疗法用于科研和临床。
iNO的临床应用操作涉及患者选择、设备选择和连接、iNO治疗浓度的滴定、不良反应和有效性评估、转运和泄漏的处理以及iNO撤离等多方面,可参照图1执行。
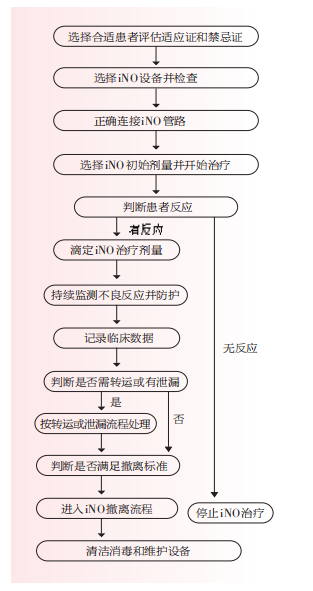
图1 iNO的临床应用操作流程图


随着对iNO作用机制的深入研究和临床应用经验的不断积累,iNO在呼吸危重症中的应用前景将更加广阔。未来的研究方向包括探索新的适应证 、优化治疗方案 、开发更安全有效的iNO设备等。同时,随着精准医疗时代的到来,iNO有望在个性化治疗方面发挥更大的作用,为呼吸危重症患者带来更多的希望和福音。


中南大学湘雅医院呼吸治疗师
中国肺功能联盟肺功能检查规范化培训导师
国家慢病防治办公室肺功能技术工作组副组长
湖南省防痨协会呼吸重症专业委员会常务委员
湖南省呼吸治疗联盟副主席
新冠期间省级抗疫专家组成员
参与国家级科研课题3项,主持省级课题1项,发表论文8篇,专利2项,参编专家共识3部,编写和翻译呼吸治疗著作6部

[1] STUEHR D J, SANTOLINI J, WANG Z Q, et al. Update on mechanism and catalytic regulation in the NO synthases[J]. J Biol Chem, 2004,279(35): 36167-36170.
[2] CORSON M A, JAMES N L, LATTA S E, et al. Phosphorylation of endothelial nitric oxide synthase in response to fluid shear stress[J]. Circ Res, 1996,79(5): 984-991.
[3] STEUDEL W, HURFORD W E, ZAPOL W M. Inhaled nitric oxide: basic biology and clinical applications[J]. Anesthesiology, 1999,91(4): 1090-1121.
[4] LEFER A M. Nitric oxide: nature's naturally occurring leukocyte inhibitor[J]. Circulation, 1997,95(3): 553-554.
[5] MASOOD M, SINGH P, HARISS D, et al. Nitric oxide as a double-edged sword in pulmonary viral infections: Mechanistic insights and potential therapeutic implications[J]. Gene, 2024,899: 148148.
[6] MILLER M R, MEGSON I L. Recent developments in nitric oxide donor drugs[J]. Br J Pharmacol, 2007,151(3): 305-321.
[7] FROSTELL C G, BLOMQVIST H, HEDENSTIERNA G, et al. Inhaled nitric oxide selectively reverses human hypoxic pulmonary vasoconstriction without causing systemic vasodilation[J]. Anesthesiology, 1993,78(3): 427-435.
[8] GOLDBART A, GOLAN-TRIPTO I, PILLAR G, et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial[J]. Sci Rep, 2020,10(1): 9605.
[9] 中华医学会儿科学分会新生儿学组,编辑委员会中华儿科杂志.新生儿肺动脉高压诊治专家共识[J].中华儿科杂志, 2017,55(3): 163-168.
[10] American Academy of Pediatrics. Committee on Fetus and Newborn. Use of inhaled nitric oxide[J]. Pediatrics, 2000,106(2 Pt 1): 344-345.
[11] BARRINGTON K J, FINER N, PENNAFORTE T, et al. Nitric oxide for respiratory failure in infants born at or near term[J]. Cochrane Database Syst Rev, 2017,1(1): D399.
[12] NELIN L, KINSELLA J P, COURTNEY S E, et al. Use of inhaled nitric oxide in preterm vs term/near-term neonates with pulmonary hypertension: results of the PaTTerN registry study[J]. J Perinatol, 2022,42(1): 14-18.
[13] PELIOWSKI A, FINER N N, ETCHES P C, et al. Inhaled nitric oxide for premature infants after prolonged rupture of the membranes[J]. J Pediatr, 1995,126(3): 450-453.
[14] KLINGER J R, ELLIOTT C G, LEVINE D J, et al. Therapy for Pulmonary Arterial Hypertension in Adults: Update of the CHEST Guideline and Expert Panel Report[J]. Chest, 2019,155(3): 565-586.
[15] CREAGH-BROWN B C, NICHOLSON A G, SHOWKATHALI R, et al. Pulmonary veno-occlusive disease presenting with recurrent pulmonary oedema and the use of nitric oxide to predict response to sildenafil[J]. Thorax, 2008,63(10): 933-934.
[16] XU Z, LIU X, ZHANG L, et al. Comparative outcomes of corticosteroids, neuromuscular blocking agents, and inhaled nitric oxide in ARDS: a systematic review and network meta-analysis[J]. Front Med (Lausanne), 2025,12: 1507805.
[17] GRIFFITHS M, MCAULEY D F, PERKINS G D, et al. Guidelines on the management of acute respiratory distress syndrome[J]. BMJ Open Respir Res, 2019,6(1): e420.
[18] QADIR N, SAHETYA S, MUNSHI L, et al. An Update on Management of Adult Patients with Acute Respiratory Distress Syndrome: An Official American Thoracic Society Clinical Practice Guideline[J]. Am J Respir Crit Care Med, 2024,209(1): 24-36.
[19] BELLANI G, LAFFEY J G, PHAM T, et al. Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries[J]. JAMA, 2016,315(8): 788-800.
[20] AKABERI D, KRAMBRICH J, LING J, et al. Mitigation of the replication of SARS-CoV-2 by nitric oxide in vitro[J]. Redox Biol, 2020,37: 101734.
[21] KACMAREK R M, RIPPLE R, COCKRILL B A, et al. Inhaled nitric oxide. A bronchodilator in mild asthmatics with methacholine-induced bronchospasm[J]. Am J Respir Crit Care Med, 1996,153(1): 128-135.
[22] SAFAEE F B, WIEGAND S B, PINCIROLI R, et al. High Concentrations of Nitric Oxide Inhalation Therapy in Pregnant Patients With Severe Coronavirus Disease 2019 (COVID-19)[J]. Obstet Gynecol, 2020,136(6): 1109-1113.
[23] TAVAZZI G, POZZI M, MONGODI S, et al. Correction to: Inhaled nitric oxide in patients admitted to intensive care unit with COVID-19 pneumonia[J]. Crit Care, 2020,24(1): 665.
[24] FERRARI M, SANTINI A, PROTTI A, et al. Inhaled nitric oxide in mechanically ventilated patients with COVID-19[J]. J Crit Care, 2020,60: 159-160.
[25] FREIDKIN L, GARSIEL K T, PELES I, et al. Medium-Term Effect of Inhaled Nitric Oxide in Mechanically Ventilated COVID-19 Patients[J]. J Clin Med, 2025,14(3).
[26] ZIEHR D R, ALLADINA J, WOLF M E, et al. Respiratory Physiology of Prone Positioning With and Without Inhaled Nitric Oxide Across the Coronavirus Disease 2019 Acute Respiratory Distress Syndrome Severity Spectrum[J]. Crit Care Explor, 2021,3(6): e471.
[27] Di FENZA R, SHETTY N S, GIANNI S, et al. High-Dose Inhaled Nitric Oxide in Acute Hypoxemic Respiratory Failure Due to COVID-19: A Multicenter Phase II Trial[J]. Am J Respir Crit Care Med, 2023,208(12): 1293-1304.
[28] WIEGAND S B, SAFAEE F B, CARROLL R W, et al. Rescue Treatment With High-Dose Gaseous Nitric Oxide in Spontaneously Breathing Patients With Severe Coronavirus Disease 2019[J]. Crit Care Explor, 2020,2(11): e277.
[29] SAFAEE F B, Di FENZA R, GIANNI S, et al. Inhaled high dose nitric oxide is a safe and effective respiratory treatment in spontaneous breathing hospitalized patients with COVID-19 pneumonia[J]. Nitric Oxide, 2021,116: 7-13.
[30] 中华医学会呼吸病学分会呼吸治疗学组,中国医师协会呼吸医师分会呼吸职业发展委员会呼吸治疗师工作组.一氧化氮吸入疗法临床应用专家共识(2024版)[J].中华医学杂志, 2024,104(26): 2386-2400.
[31] BERRA L, RODRIGUEZ-LOPEZ J, REZOAGLI E, et al. Electric Plasma-generated Nitric Oxide: Hemodynamic Effects in Patients with Pulmonary Hypertension[J]. Am J Respir Crit Care Med, 2016,194(9): 1168-1170.
[32] GIANNI S, FENZA R D, MORAIS C, et al. High-Dose Nitric Oxide From Pressurized Cylinders and Nitric Oxide Produced by an Electric Generator From Air[J]. Respir Care, 2022,67(2): 201-208.
[33] YU B, ZAPOL W M, BERRA L. Electrically generated nitric oxide from air: a safe and economical treatment for pulmonary hypertension[J]. Intensive Care Med, 2019,45(11): 1612-1614.
查看更多