查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:首都医科大学附属北京友谊医院 张茗卉 郭春艳 赵树梅 周小燕 高红丽 张婷婷 李虹伟
病例简介
1例44岁男性患者,因“活动时喘憋、双眼睑水肿5个月,加重伴双下肢水肿20天”进冠心病监护病房(CCU)。患者5个月,前出现活动时(如快走或爬楼)喘憋,休息后症状可缓解,伴双眼睑水肿,晨起严重,伴腹胀、纳差,于当地医院就诊。
于当地医院行心电图检查示窦性心律,Ⅰ°房室传导阻滞(AVB),Ⅱ、Ⅲ、aVF、V2、V3导联异常Q波,电轴右偏;冠脉造影检查示冠脉未见明显异常;超声心动图示双房增大,左右室心肌病变,左室舒张功能限制性障碍,心包积液(少量);胸部CT示双侧胸腔积液伴肺萎陷,双肺局限性纤维化。
经利尿等对症治疗,患者症状未见明显缓解,并于20天前出现双下肢水肿,为求进一步诊治转入笔者所在医院。
患者既往体健,入院后查体:血压108/61 mmHg,神志清,精神可,舌大,双肺呼吸音低,未闻及明显干湿性啰音;心率72次/分,律齐,可闻及第三心音,P2>A2;腹部膨隆,移动性浊音阳性;双下肢及双足可见凹陷水肿。
心电图检查提示:窦性心律,Ⅰ°AVB,Ⅰ、Ⅱ、Ⅲ、aVF、V1~V6导联呈QS型,肢体导联低电压(图1)。
超声心动图检查提示:双房增大、左右室室壁增厚、心肌颗粒样回声改变、左室舒张功能减低、心包积液(少量)、下腔静脉增宽,阳性所见符合CA表现(图2~9)。
胸片提示:双侧胸腔积液;腹部CT提示:大量腹腔积液。
心脏核磁检查提示:左心室室间隔相对增厚,延迟左心室心内膜下到心肌中层弥漫性信号增高,考虑为CA(图10)。
实验室检查结果如下,N末端脑钠肽前体(NT-proBNP)水平为8897 pg/ml,肌钙蛋白I(cTnI)水平0.006 ng/ml(0~0.02 ng/ml)。血清蛋白电泳提示α1球蛋白、β球蛋白水平增高,血清免疫固定电泳发现免疫球蛋白G(IgG)λ型M蛋白。各项检查结果均支持CA诊断。
为明确有无多发性骨髓瘤,进一步对患者进行了骨髓穿刺检查,髂骨处骨髓取样病理诊断为浆细胞骨髓瘤(图11)。
本例患者最终确诊为多发性骨髓瘤、CA,转当地医院血液科进一步治疗。
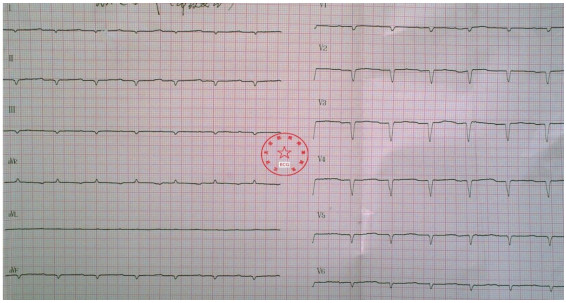
图1 心电图提示窦性心律,Ⅰ° AVB,Ⅰ、Ⅱ、Ⅲ、aVF、V1~V6导联呈QS型,肢体导联低电压。
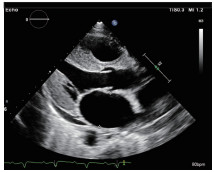
图2 二维超声心动图胸骨旁左室长轴切面显示左房增大,左室内径正常,室间隔及左室后壁轻度增厚,心肌呈颗粒样回声改变,主动脉瓣、二尖瓣瓣叶增厚,心包腔内可见少量液性暗区。
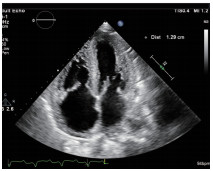
图3 二维超声心动图心尖四腔心切面显示双房增大,室间隔及左、右室壁增厚,心肌呈颗粒样回声改变,二尖瓣、三尖瓣瓣叶增厚,心包腔内可见少量液性暗区。
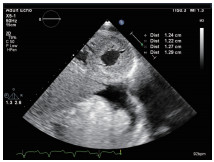
图4 二维超声心动图左室短轴切面显示左室壁增厚约1.2~1.3 cm,另可见左侧胸腔积液。
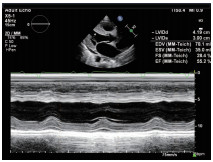
图5 M型超声心动图显示左室射血分数正常低限(55%)。
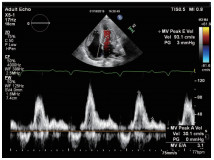
图6 脉冲多普勒频谱显示舒张期二尖瓣口血流频谱E/A=3.1,提示限制性充盈障碍。
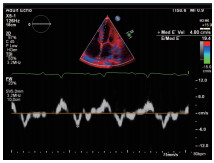
图7 组织多普勒显示二尖瓣环间隔侧E’=4.8cm/s,E/E’=19.4,提示左室舒张功能明显减低。
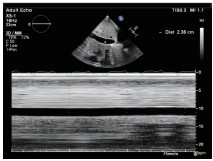
图8 M型超声心动图剑突下切面显示下腔静脉内径增宽约2.36 cm,吸气塌陷率<50%,提示右房压明显增高(15~20 mmHg)。
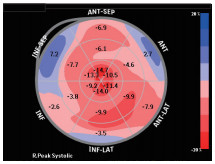
图9 二维斑点追踪超声心动图显示左室整体长轴应变 减低(-10.1%),呈心尖应变保留现象。
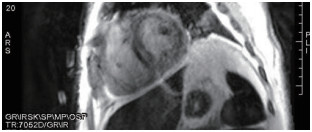
图10 心脏核磁检查提示左心室室间隔相对增厚,延迟左心室心内膜下到心肌中层弥漫性信号增高,考虑为CA。
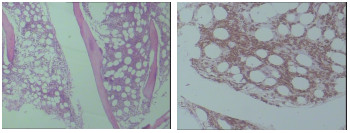
图11 骨髓穿刺病理:镜下造血组织约占40%,三系可见,巨核细胞2~4个/HPF,造血组织间浆细胞样细胞增多,诊断为浆细胞骨髓瘤。
心肌淀粉样变性的诊断
CA也称心脏僵硬综合征,其根本病因在于心肌沉积的淀粉样物质,即以异常的β折叠形式沉积的前体蛋白,表现为在心肌细胞外的不可溶性纤维沉积物,经过刚果红染色在偏振光显微镜下,呈现苹果绿双折射。观察可见淀粉样物质沉积于心室、心房和瓣膜而引起心脏增大、心肌僵硬,累及冠脉主干及细小分支引起心肌缺血,也可累及传导系统引起心律失常。
山东大学齐鲁医院张运院士多次提到“CA是限制性心肌病、浸润性心肌病、间质性心脏病、蛋白质折叠病、肿瘤性心脏病的范例,研究该病具有重要的学术价值。临床医师应进一步提高对该病的认识,减少漏诊误诊。”
已知可沉积在人类心脏的淀粉样物质(前体蛋白)超过30种,但最常见的CA包括以下四种类型:免疫球蛋白轻链(AL)型CA(原发性CA)、甲状腺素转运蛋白相关(TTR)型CA、血清淀粉样蛋白A(AA)型CA(继发性CA)和孤立性心房淀粉样变性等。
AL型CA
AL型CA又称原发性CA,是最常见的CA类型。该型由浆细胞异常增生引起,单克隆浆细胞生成的AL蛋白因蛋白折叠错误无法溶解于血清,而被心肌细胞内吞产生毒性,可伴发于多发性骨髓瘤。此类型常表现为多器官受累,如肾脏(~70%)、肝脏(~17%)、周围和自主神经(~15%)以及胃肠道(~10%)等。2/3的发病者为男性,中位首诊年龄为60~65岁,主要症状表现为乏力、呼吸困难、眼睑紫癜、舌体增大(厚度为正常的2~3倍)、下肢水肿、颈静脉怒张、胸腔积液、体位性低血压、心律失常、心绞痛、腹泻/便秘、周围/自主神经病变。此型预后极差,平均生存时间仅6个月。
TTR型CA
TTR型CA包括突变型(TTRm)和野生型(TTRwt),TTRwt显著多于TTRm。其中TTRm属于常染色体显性遗传性疾病,涉及>100种TTR基因变异,其中以Val30Met和V122I最常见。该型常出现限制型心肌病的症状和体征,但发展较慢,绝大多数为男性,多数有周围和自主神经病,半数合并有腕管综合征,且早于心脏表现8~10年。该型患者虽然左室室壁厚度大于AL型,但预后显著好于其他类型,平均生存时间为6年。
AA型CA
AA型CA又称继发性CA,多由慢性感染、慢性炎症或肿瘤引起,影响心脏者较少,病程较长,临床表现亦较轻。
孤立性心房淀粉样
变性孤立性心房淀粉样变性与心房钠尿肽沉积相关,目前临床意义并不明确,可能与心房颤动(房颤)发生相关。
一般认为,CA的心电图特征包括以下几点。
首先,肢体导联低电压(肢体导联QRS<0.5 mV,胸前导联QRS<1 mV)、胸前导联R波递增不良。
其次,超声提示心室肥厚,而V5、V6导联R波电压矛盾性降低。
第三,无冠心病证据但出现假性心肌梗死图形,如非特异性ST-T改变、异常Q波;
第四,合并房室传导阻滞或多束支传导阻滞。
为进一步量化上述心电图指标,临床陆续提出了QRS积分(包括肢体导联QRS积分和全部导联QRS积分)、QRS指数(QRS积分/左室厚度或QRS积分/体表面积)和Sokolow指数([V1的S波+V5/V6的R波)/左室心肌横截面积],但均未得到普及。2015年夸尔塔(Quarta)等人提出了一个新的指标,全部导联QRS积分(/左室壁厚度/身高2.7),该指标的临界值(cut-off值)为36.4(男性)和27.3(女性),诊断准确率优于其他指标,受试者工作特征(ROC)曲线下面积可达0.8656(男性)和0.8331(女性)。
超声心动图是诊断和评估CA的首选无创检查方法。超声医生要熟练掌握CA的超声特征和诊断要点,并善于在临床工作中发现这些特征,练就“火眼金睛”。现将CA的典型超声心动图表现总结如下。
首先是闪烁征,即增厚心肌中可见散在的呈圆形或不规则的闪烁颗粒样回声,为本病的特征性表现(约92%的患者会出现)。
其次,室间隔及心室壁呈对称性增厚,心肌回声增强,心瓣膜或乳头肌也可因淀粉样物质沉积而增厚或增粗。
第三,心室舒张功能严重受损,常呈限制性充盈障碍(E/A>2、E/E’>15)。
第四,早-中期左室射血分数正常或轻度下降,但心排量明显降低。
第五,下腔静脉内径增宽,随呼吸内径变化率常<50%。
第六,双心房增大,心室腔内径正常或偏小。
近年来,斑点追踪成像逐渐成为临床超声心动图检查中的常规技术,其测量的心肌应变是一种无创、可靠、定量的心肌运动评估方法,可在各种病理条件下早期发现心脏功能障碍。例如在出现充血性心衰症状之前,纵向应变(GLS)异常通常可以作为CA的早期标志。GLS可早于左室壁厚度和射血分数(EF)的改变,帮助提前发现心脏功能损害,同时GLS也是CA预后评价的独立预测因子。进一步取EF/GLS的比值,可以作为鉴别CA和心肌增厚疾病的可靠方法。需要特别指出的是,CA患者还存在一种特殊的应变变化模式——“心尖应变保留模式”,即其中基底段损伤最明显,心尖没有或轻微受累。
如果对CA特点认识不足,仅凭超声心动图表现有可能将本病与肥厚型心肌病或高血压性心脏病相混淆,而出现漏诊或误诊,更有复杂的病例为CA合并高血压性心脏病或主动脉瓣疾病,更需要超声医生在检查中仔细甄别。
钆喷酸葡胺(Gd-DTPA)增强心脏磁共振技术是近年发展起来的又一项影像学评估手段。多数CA患者延迟钆增强(LGE)显像示弥漫性心内膜和室间隔延迟性强化,延迟强化可以是颗粒样或斑片状,这是因为CA患者的细胞间质中有大量淀粉样物质沉积,因而增大的细胞外间隙滞留了Gd-DTPA。病理学研究表明LGE显像区域为淀粉样物质沉积区域,两者相关性良好,是CA的特异性表现。研究报告该技术诊断CA的敏感性为80%,精确性为94%,阳性预测值为92%,阴性预测值为85%,同时也可以准确展示淀粉样物质的分布情况和总的沉积负荷。
对于不能耐受增强核磁的患者或在无法开展心脏增强核磁的医院,初始纵向弛豫时间定量成像(T1mapping)技术同样可以发现CA的特异征象。研究发现,当T1=1082ms时,诊断CA的特异性为80%,敏感性为75%。T1=1012ms时,排除CA的敏感性为100%,特异性为40%。CA组患者T1弛豫时间与心脏收缩和舒张功能有相关关系,随着T1弛豫时间增加,左室射血分数降低(r=-0.51,P<0.01),左心室质量指数增加(r=0.52,P<0.01)。
核素显像 99Tc-二羧基丙烷二磷酸盐(DPD)和焦磷酸盐(PYP)单光子发射计算机断层扫描(SPE-CT)示踪剂与甲状腺素转运蛋白结合,可用于AL型和TTR型CA的鉴别。18F-氟比他班(Neuraceq)正电子发射计算机断层扫描(PET-CT)检查可以计算心肌示踪剂滞留率(MTR),用于监测治疗前后的CA沉积量。
脐周皮下脂肪抽吸+骨髓穿刺 85%的患者刚果红染色阳性,可代替心内膜心肌活检。
心内膜心肌活检 心肌活检是诊断CA的金标准。由于心肌弥漫性浸润,心肌活检的敏感性可达100%,但取材困难且属于侵入性有创操作,临床并发症发生率达6%,多数患者不易接受,难以开展。
心肌淀粉样变性的治疗
针对CA,临床目前尚无根治的方法,患者预后均较差。CA的治疗包括对症治疗(抗心衰/抗心律失常等)和对因治疗。
AL型CA可选择化疗,抑制过度免疫,减少淀粉样蛋白的生成,但疗效不确切,且不良反应多。常用化疗药物有“B、C、D、L、M”5种,分别为:B(硼替佐米)、C(环磷酰胺)、D(地塞米松)、L(来那度胺)、M(左旋苯丙氨酸氮芥)。自体造血干细胞移植是治疗AL型CA的有效方法,但很少有患者接受并实施。
对于TTR型CA,可以选择tafamidis、patisiran和inotersen等药物。Val30Met突变所致的TTR型CA可选择肝脏移植术,但V122I突变所致的TTR型CA对肝脏移植反应极差。当心肌严重受浸时,肝、心联合移植是唯一可能有效的方法。
心肌淀粉样变性的预后
CA预后差,一旦出现临床症状,病程进展会非常迅速,中位生存期一般短于6个月。尤其是发展为右心衰竭后,病情可能出现进展性恶化,患者常常会在短期内死亡。死亡原因主要为充血性心衰,其次为心源性猝死。既往研究表明,纽约心脏协会(NYHA)心功能分级、NT-proBNP水平、左室射血分数、室间隔厚度、E/A等与患者预后相关,可以作为CA患者预后的预测因素。
总之,CA并非临床罕见病,对每一例心衰或心肌肥厚患者,接诊医生都要警惕该病的可能。CA的诊断重于治疗,早期识别并进行正确分型可以改善患者预后。在CA的诊断中,超声心动图是关键的辅助检查之一,超声医生要能准确识别该疾病并敢于做出诊断,最终结合临床症状、实验室检查、核磁及病理结果等确诊。目前,对CA治疗尚无突破性进展,仍以基础治疗和对症治疗为主,因此临床医师应进一步提高对该病的认识,及早诊断,探索更好的治疗方法,以期有效延长患者生存期。
精选30个心内经典病例,由专家解析并点评。12月1日起,每日发布一例,并提供PDF全文下载。反复研读,受益匪浅!稀缺专题,值得收藏!
中国医学论坛报版权所有,转载须授权
查看更多