查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





通讯员 朱雯华 复旦大学附属华山医院神经内科
美国学者S. Donkervoort等报道了一个新的先天性肌营养不良(CMD)/癫痫相关基因BET1,该报道进一步拓宽了内质网(ER)/高尔基体(Golgi)Q-SNARE相关基因突变的临床谱系。SNARE复合体在囊泡介导膜运输的锚定和融合过程中起着关键的作用(图1),GOSR2编码Q-SNARE蛋白(图2)。GOSR2隐性突变可导致进展性肌阵挛癫痫和共济失调。以往曾有研究者报道一例重症GOSR2突变患者可能伴发CMD。此次报道的一例4岁男性,临床表现为先天性肌无力、喂养困难、关节挛缩、呼吸功能不全、眼外肌麻痹、白内障和癫痫。CK水平显著升高(3600-6800 U/L),头颅MRI呈轻度脑白质异常。通过全外显子组测序发现患者存在BET1基因(GOSR2互作ER/Golgi Qc-SNARE囊泡转运基因)的复合杂合突变:一个为错义突变(c.202G>C; p.D68H),预测可能致病并可能影响剪切;一个为截短突变(c.134delC; p.A45X)。而此前BET1突变在人类中从曾未报道。患者肌肉RNA检测提示BET1基因RNA转录水平下降,成纤维细胞免疫印迹提示BET1蛋白重度缺失,成纤维细胞免疫荧光显示BET1向顺面内质网的定位显著下降。以上结果提示,BET1和GOSR2缺陷可能影响囊泡与顺面高尔基体融合,进而导致Q-SNARE介导ER向Golgi囊泡转运出现障碍,引起CMS伴癫痫的表型。除了在酵母中进行功能研究和计算机模拟分析以外,利用GOSR2和BET1缺陷患者的成纤维细胞进行ER-Golgi运输功能学研究来分析SNARE复合体如何形成及保持稳定,将会进一步阐明这一全新的CMD发病机制。
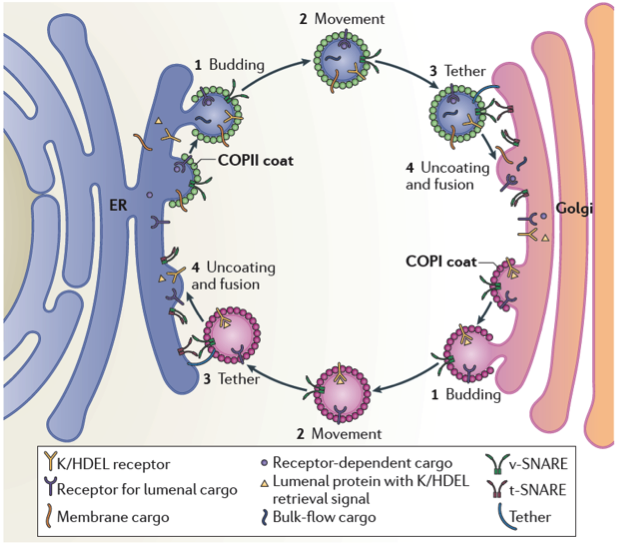
图1 ER和高尔基体的双向运输(Nat Rev Mol Cell Biol. 2013 Jun;14(6):382-92.)
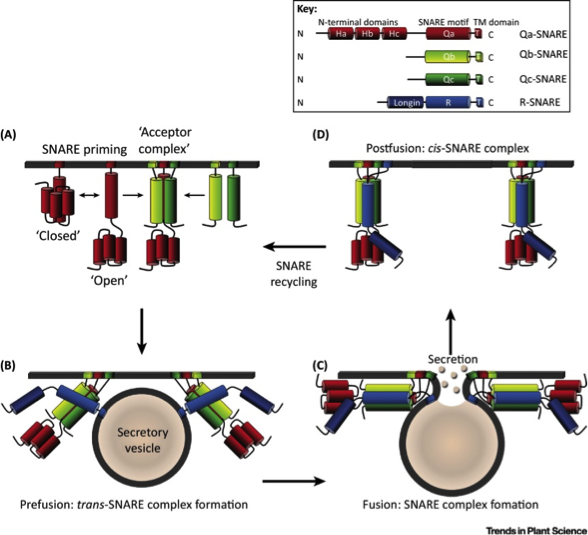
图2 SNARE复合物的循环(Trends Plant Sci. 2017 Jan;22(1):81-95.)
荷兰学者M.van de Locht等报道了快骨骼肌型肌钙蛋白C编码基因(TNNC2) 突变可导致肌收缩功能障碍。杆状体肌病(NEM)是由于编码细肌丝相关蛋白基因突变导致的一组罕见肌肉肌病。但并不是所有细肌丝蛋白病都会出现特征性的杆状体,临床表现的谱系也在不断扩大。肌钙蛋白C (TnC)与TnT、TnI结合形成Tn复合物,调节细肌丝蛋白的激活(图3)。此前尚未有快骨骼肌型TnC(fsTnC)与疾病相关的报道。该研究报道了两例携带fsTnC编码基因TNNC2杂合突变的患者,均具有独特的先天性肌病表型。例1,27岁,突变为c.100G>T; p.Asp34Tyr,除了先天性肌肉无力,还表现为声带麻痹导致气管切开、眼睑下垂、眼外肌麻痹、骨质减少,随着时间推移临床症状可逐渐改善。其兄弟、母亲、外祖母有类似症状,也携带相同的TNNC2突变。例2,19岁,突变为c.237G>C; p.Met79Ile,表型略轻,有早发的呼吸肌无力、构音障碍、全身肌张力低下,随着年龄增长以上症状逐渐改善,19岁时仅遗留轻度近端肌无力,可正常行走。研究者从患者的肌活检样本中分离单根肌纤维进行收缩力测量。肌细胞膜打孔后,肌纤维能被外源性钙离子激活而收缩。例1存在2型纤维萎缩和1型纤维肥大,2型纤维的绝对最大收缩力和标化最大收缩力均下降,而1型纤维均提高。2型纤维对钙离子的敏感性也下降、而1型则提高。例2的肌纤维呈相似结果,但不那么显著。作者根据以上结果推测TNNC2突变会降低肌纤维对钙的敏感性,可能导致细丝结构改变,从而引起患者肌肉无力。例1临床表型重于2型在实验研究的结果中也得到映证。
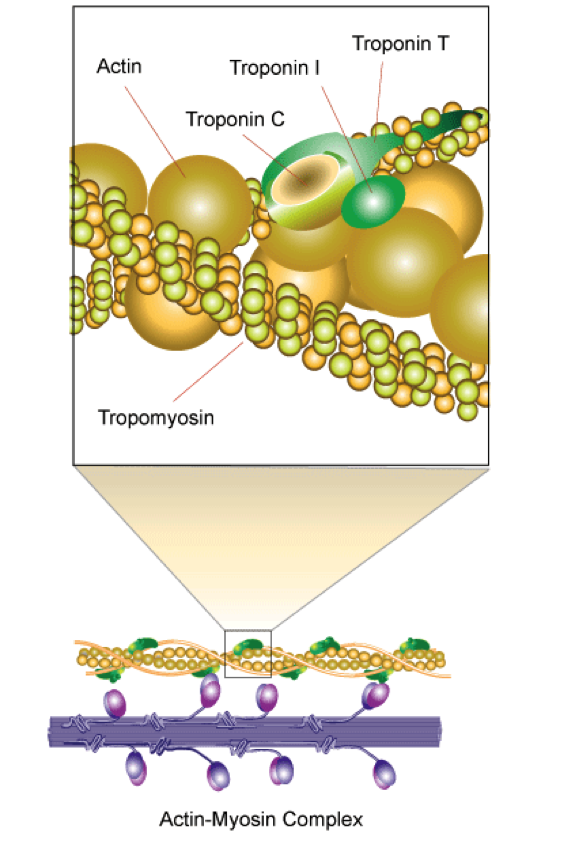
图3 肌动蛋白-肌球蛋白复合物
美国研究者B.T.Darras报道了磷酸化神经丝蛋白重链(pNF-H)与Nusinersen治疗脊肌萎缩症(SMA)(图4)的相关性。神经丝蛋白(NF)是神经元细胞骨架重要的结构蛋白,在轴索受损伤或神经元变性时会大量释放到间质液中。本研究分析了III期随机双盲对照临床试验——ENDEAR和CHERISH研究中治疗组和对照组的pNF-H水平。ENDEAR招募7月龄前出现症状的婴儿型SMA,CHERISH招募2-12岁的晚发型SMA儿童。在临床试验各个关键访视点采取血样进行药物动力学分析,并用检测pNF-H水平。在治疗组和对照组,pNF-H水平均随着时间下降。两组的差别在于,对照组pNF-H水平呈持续性下降,而Nusinersen治疗组早期迅速下降,随后保持稳定。在ENDEAR研究中,两组之间最大差别出现在第64天,Nusinersen治疗组pNF-H水平下降达71.9%,对照组下降仅为16.2%。CHERISH研究中也有相似的趋势,最大差异在第85天,Nusinersen治疗组下降48.4%,而对照组增加6.2%。对两组在基线的特征和pNF-H水平也进行了评估。ENDEAR研究中,基线log(pNF-H)与基线CHOP INTEND评分相关(r=-0.30;p=0.001),与症状出现的年龄相关(r=-0.20;p=0.034),在SMA确诊时(r=-0.25;p=0.006)和首剂治疗时(r=-0.24;p=0.011)均呈现相关性。CHERISH研究中,基线pNF-H与基线体重(r=-0.44)、疾病病程(r=-0.64)、首剂使用年龄(r=-0.63; 以上均p<0.0001)和基线上肢模块测试评分(r=-0.20; p=0.028)相关。这些结果提示,pNF-H可能与SMA基线特征相关,随着Nusinersen治疗可快速下降直至稳定。进一步扩大验证,并和增加与脑脊液参数的相关性分析,能有助于更全面的了解pNF-H与SMA的关联。
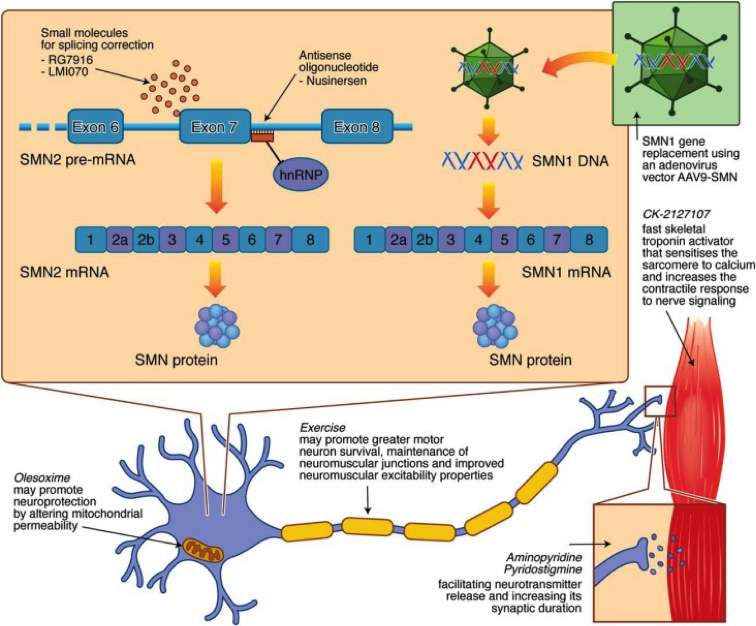
图4 SMA的临床试验治疗策略(Ann Neurol. 2017 Mar;81(3):355-368.)
日本研究者M.Sasaki-Honda构建了一个新的面肩肱型肌营养不良(FSHD)细胞模型。FSHD是一种引起骨骼肌进行性萎缩的遗传性肌病,具有独特的临床特点,肌肉受累具有明显的不对称性,不同个体病程进展也有极大差异。由于这些特点并不能简单地用致病突变来解释,环境因素也可能参与其中。DUX4是FSHD发病机制中的关键因子,对肌细胞具有毒性作用。目前已知FSHD 1型(FSHD1)和2型(FSHD2)的遗传学背景均可导致疾病相关基因组区域的染色质疏松,引起DUX4不恰当的表达上调,但目前仍不清楚其表达是如何调节的。他们建立了来自健康对照、FSHD1、FSHD2患者的iPSC细胞系(图5),然后纠正FSHD2细胞系的SMCHD1突变从而建立等基因对照细胞系。上述细胞系可被高效地转化为肌细胞。FSHD来源的肌细胞DUX4基因及其直接的下游靶基因表达显著上调,说明此方法建立的FSHD细胞模型与以往的遗传学研究结果具有一致性。随后的研究结果显示,DUX4表达在氧化应激时上调,由DNA损伤反应(DDR)介导,抑制DDR调节激酶ATM可下调DUX4表达。该研究成功建立了一个新的可应用于药物筛选的FSHD-iPSC模型,并提示环境因素例如氧化应激和其它一些类型的基因毒性应激可能是FSHD发病的危险因素,在日常行为中应尽量避免。
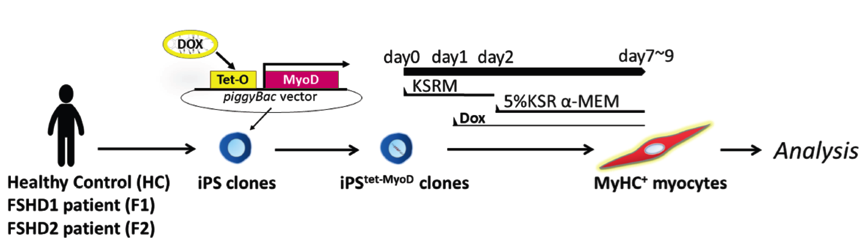
图5 从iPS细胞克隆分化肌细胞流程示意图(Hum Mol Genet. 2018 Aug 9. doi: 10.1093/hmg/ddy293.)
查看更多