查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





PowerPacTMHCRNA对瘢痕疙瘩形成影响的体外研究
作者:蔡玉梅1, 朱世泽2, 杨维群1, 潘明孟3, 王朝阳2, 吴文艺2
(1. 泉州医学高等专科学校病理教研室, 福建泉州362000; 2. 福建医科大学附属第二医院整形外科, 福建泉州362000;3. 福建医科大学附属第二医院皮肤科, 福建泉州362000)
瘢痕疙瘩(KD)是一种因细胞外基质中胶原、蛋白多糖及糖蛋白等过度沉积及胶原纤维排列紊乱的纤维增生性疾病[1],具有浸润性生长特性。目前研究发现KD与Wnt/β-连环蛋白(catenin)信号通路有直接关系,其中卷曲蛋白(Frizzled)受体是此通路的关键调节因子,且其在通路中起重要作用,而糖原合酶激酶(GSK)3β 和D 型细胞周期蛋白(cyclin D)1 是Wnt 信号转导通路中非常重要的靶基因[2]。本文通过对体外生长的人瘢痕疙瘩成纤维细胞(KFB)转染靶向Frizzled 小干扰RNA(siRNA), 初步探讨Frizzled 基因与其上游基因Wnt2和下游靶基因GSK3β 及cyclin D1 对KD 发生及发展的影响,现将结果报告如下。
1.1材料
KD 和正常皮肤标本分别来自福建医科大学附属第二医院皮肤科和整形外科。KD 标本9 例,其中男5例,女4 例,病程6~24 个月,年龄2~55 岁;病因分别为手术4 例,外伤3 例,感染1 例及穿耳孔1 例。取材部位为面部、胸部、背部、耳垂和四肢等,所有标本患者术前均未行激光、放疗、化疗及免疫治疗。正常皮肤标本9 例均取自整形外科,其中男4 例,女5 例,年龄10~48 岁。所有标本均经组织病理证实,且患者知情同意。
胎牛血清(FBS)、0.05%胰蛋白酶-EDTA 和Opti-改良型1640 均购自美国Gibco 公司;改良型1640 购自美国Hyclone公司;转染试剂脂质体(Lipofectamin 2000)和总RNA提取试剂盒(Trizol Reagent)购自美国Invitrogen公司;Wnt2 抗体(1∶200)、Frizzled 抗体(1∶200)、p-GSK3β 抗体(1∶200)和cyclin D1 抗体(1∶200)均购自美国Santacruz公司;GSK3β 抗体(1∶500)购自PTGLAB;辣根过氧化物酶(HRP)结合山羊抗兔IgG(1∶2 000)和HRP 结合山羊抗小鼠IgG(1∶2000)均购自美国Jackson 公司;Super-Signal West Pico 化学发光底物和MPER 哺乳动物蛋白抽提试剂购自美国Pierce 公司; 实时荧光定量聚合酶链式反应(qPCR)通用试剂购自上海吉玛制药技术有限公司;X 光片显影液及定影液购自上海冠龙照相器材公司;聚偏氟乙烯(PVDF)膜购自美国Millipore 公司;PowerPacTMHC 电泳仪购自美国Bio -Rad 公司;AE31-252B 荧光显微镜购自麦克奥迪实业有限公司;Mx3000P qPCR 仪购自美国Stratagene 公司;VE-180垂直电泳槽购自上海天能科技有限公司;Semi-DryCell JY-ZY4(85 mm×85 mm)购自北京君意东方电泳设备有限公司;DY-B1 脱色摇床购自上海沪西仪器;BSC-Ⅱ A2 生物安全柜购自上海旦鼎国际贸易有限公司;柯达X-Omat BT 胶片购自上海化科实验器材有限公司。
1.2 方法
1.2.1 siRNA 的设计、合成和筛选查找人Frizzled 的基因序列(基因库序列号NM_003505),根据Elbashir的设计原则,设计3 个siRNA 序列,根据靶序列起始位置命名为siRNA303、siRNA355 及siRNA2226(表1),由上海吉玛制药有限公司合成。
1.2.2 细胞培养和实验分组人
KD 和正常皮肤成纤维细胞采用组织块贴壁法培养。将成纤维细胞置于含10%FBS 的改良型1640 培养基中,于37℃、5% CO2下孵育,实验取第3~6 代细胞。按照实验设计将其分为正常皮肤细胞组(B0 组)、空白细胞组(B 组)、转染试剂对照组(M 组)、无义序列siRNA 转染组(N 组)和siRNA 转染组(siRNA303 组、siRNA355 组和siRNA2226组)。
1.2.3 siRNA 转染及转染率观察将处于对数生长期的细胞常规消化后稀释至1.5×109/L, 接种于6 孔板中,混匀后于5%CO2、37℃培养24h。将40μg(3.0 nmoL)siRNA 溶解于150 μL 焦碳酸二乙酯(DEPC)处理过的水(DEPC-H2O)稀释至浓度约为20 μmol/L。取500 μL无血清无双抗的培养基(Opti-MEMI)、8 μL siRNA 和5 μL Lipofectamin 2000 混合成转染混合物,室温放置25 min,后逐滴加入6 孔板中孵育4~6 h;再加入1640培养基于5% CO2、37 ℃继续培养24 h 及48 h,于荧光显微镜下计算细胞转染率(转染阳性细胞数/细胞总数×100%),收样,所得细胞用于qPCR 及western blot 检测。
1.2.4 qPCR 测定mRNA 表达根据试剂盒说明书提取总RNA,反转录形成cDNA,后按设计合成的内参β-肌动蛋白(β-actin)、Wnt2、Frizzled、GSK3β 及cyclin D1引物序列(表2)行PCR 扩增,扩增后行琼脂糖凝胶电泳,凝胶成像系统扫描每组目的条带的光密度,后计算与相应内参基因β-actin 条带的光密度比值, 代表本组基因mRNA 的相对光密度。 1.2.5 western blot 检测蛋白表达电转仪将提取的

细胞总蛋白转移至PVDF 膜上, 采用十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳法,考马斯亮蓝染色观察蛋白电泳。加入一抗(1:2 000)4 ℃孵育过夜,加入二抗,室温孵育2 h,通过化学发光检测和凝胶成像分析系统显影、定影及拍照。设甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用Gel-Pro Analyzer 软件系统分析各组Wnt2、GSK3β、cyclin D1 和Frizzled 蛋白条带的灰度值。
1.2.6 细胞增殖检测试剂(CCK-8)测定细胞增殖取处于对数生长期的细胞常规消化后接种于96 孔板,培养12 h,每孔分别于转染前和转染后12 h、24 h、48 h 及72 h后加入培养基100 μL 和CCK-8 10 μL,避光培养2.5 h,采用酶标仪于450 nm 波长检测吸光度(A)值。
1.3 统计学处理
采用SPSS 12.0 软件进行统计分析,数据以Mean±SD 描述。qPCR 和western blot 的实验数据采用2-ΔΔCt法进行相对表达量分析; 多组间比较采用单因素方差分析。P<0.05 认为差异有统计学意义。
2.1 siRNA 转染率测定
转染阳性细胞胞质内可见大量绿色荧光, 转染效率为90%。
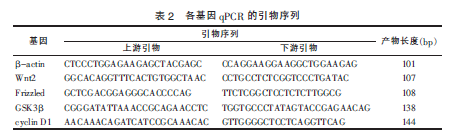
2.2 转染后不同细胞组Frizzled mRNA 表达水平检测
与N 组相比,siRNA 303 组转染24 h 及48 h 后,Frizzled mRNA 表达均下降;而siRNA 355 组和siRNA2226 组转染24 h 后Frizzled mRNA 表达下降,但48 h后表达则上升。B0 组、B 组及M 组分别与N 组比较,差异均无统计学意义(P>0.05)(图1)。2.3 转染后各组Frizzled 蛋白表达水平比较
转染24 h 及48 h 后,与N 组比较,siRNA 303 组、siRNA 355 组及siRNA 2226 组Frizzled 蛋白表达均下降,差异有统计意义(P<0.05)。与N 组比较,B0 组、B组及M 组差异均无统计学意义(P>0.05)(图2)。上述qPCR
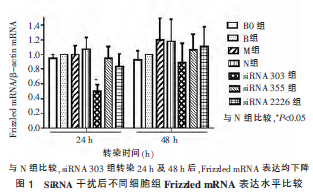
和western blot 结果均表明siRNA 303 组对Frizzled受体具有最佳的mRNA 和蛋白质抑制效率,故选取其作为siRNA Frizzled 靶向抑制片段进一步探讨。
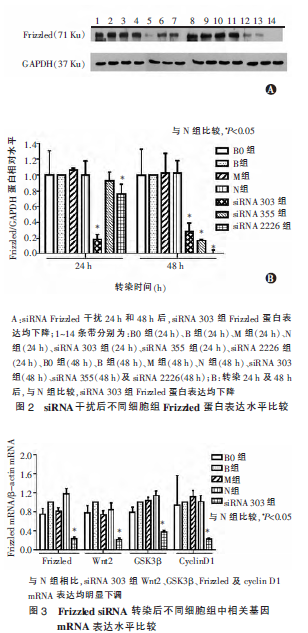
2.4 siRNA 干扰后各组相关基因表达情况
与N 组相比,siRNA 303 组Wnt2、GSK3β、Frizzled及cyclin D1 mRNA 表达均明显下调, 差异有统计学意义(P<0.05)(图3)。
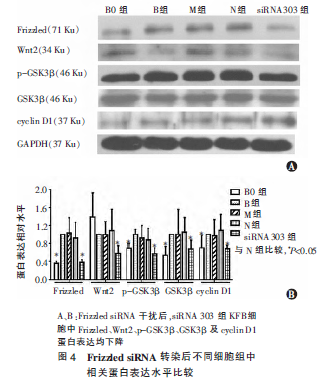
2.5 Frizzled siRNA 干扰后各组相关蛋白表达情况
与N 组相比,siRNA303 组Frizzled、Wnt2、p-GSK3β、GSK3β 及cyclin D1 蛋白表达均明显下调, 差异有统
计意义(P<0.05)(图4)。
2.6 CCK-8 检测siRNA 干扰后KFB 增殖情况
CCK-8 结果显示转染Frizzled siRNA 后,siRNA303 组KFB 进入对数生长期后增殖减慢,且随着培养时间的延长,细胞生长受抑制程度增大,细胞倍增时间明显延迟,与N 组相比,差异有统计意义(P<0.05)。
Frizzled 受体家族由Frizzled 基因编码, 含一个由40~100 个氨基酸组成的高变区和一个由10 个半胱氨酸组成的保守结构域(CRD),是一类7 次跨膜蛋白。人类Frizzled 蛋白受体的数量已达10 种,这些Frizzled蛋白被认为是Wnt 家族成员受体,它是一种跨膜蛋白受体,起源于G 蛋白偶联受体(GPCRs)家族[3]。目前研究发现,Frizzled-1 至Frizzled-10 受体都与肿瘤的发生及发展密切相关,并且在癌症中起着分子靶点的作用。Zhang 等[4]发现Frizzled-1 在多药耐药性(MDR)乳腺癌细胞系中高表达,Frizzled-1 可能通过Wnt 通路介导乳腺癌的MDR,与乳腺癌有密切关系。Frizzled-4 是一个重要的癌症相关基因,Jin 等[5]发现Frizzled-4 能影响多形性胶质母细胞瘤的生长和侵袭, 因此Frizzled-4 可能成为治疗胶质母细胞瘤的分子靶点。Wei 等[6]发现Frizzled-7 的胞外区可以通过调节β-catenin 和蛋白激酶C 亚型(PKC)δ 活性,药理性抑制Wnt 基因的转录活性,进一步抑制Wnt 信号通路下游蛋白的表达,从而导致肝癌细胞生长活性降低,因此Frizzled-7 可能作为一个可行的治疗剂和其他化疗药物结合来提高肝癌的疗效。Nambotin 等[7]发现针对Frizzled-7 设计小干扰肽(RHPDs)放入细胞内,能够通过竞争性抑制Frizzled-7 的活性而减少细胞增殖。Yang 等[8]采用基因芯片分析结果显示Frizzled-7 在三阴性乳腺癌中过度表达, 并采用RNAi 技术证明Frizzled-7 siRNA 能通过降低细胞增殖而明显抑制肿瘤的形成。Wang 等[9]发现Frizzled-8 在人类肺癌组织标本和细胞株中过度表达,表明Frizzled-8是一个潜在的肺癌治疗靶点。由此可见Frizzled 受体蛋白在肿瘤的发生和发展中发挥重要作用,可能是肿瘤发生过程中的一个生物标志物和潜在的基因治疗靶点。
Wnt 信号通路的异常活化与心脏、肺部、肝脏、皮肤以及肾脏等器官纤维化的发生与发展关系密切[10],同时也与肿瘤的发生密切相关,尤其是纤维瘤病[11-12]。Wnt 信号传导主要通过Frizzled受体实现。分泌性Wnt信号分子与Frizzled受体的CRD 结合,从而发挥Wnt信号通路的信号转导功能,且不同的Frizzled 受体可激活不同的经典及非经典Wnt/β-catenin下游信号通路。也有研究认为单一类型的Frizzled受体可以激活2个Wnt下游途径。当Wnt 配体与细胞膜上的Frizzled 受体及辅助受体低密度脂蛋白受体相关蛋白(LRP)5/6 结合时,胞质内散乱蛋白(Dvl)被募集,抑制GSK3β 和酪蛋白激酶(CK)1 活性,并通过固定轴蛋白(Axin),破坏多蛋白复合物,解放被束缚的β-catenin,使其在胞质内稳定积累到一定量时入核,结合到T 细胞因子(TCF)和淋巴细胞增强子(LEF)转录因子上形成转录复合体,触发C-myc 基因、cyclin D1 和白细胞介素(IL)-8 等一系列Wnt 通路下游靶基因的转录活化,最终调节细胞转化和增殖[13]。Wnt 经典通路的特点是保证信号的特异性,但无效应放大[14]。
本研究针对Frizzled 受体基因序列设计合成特异性干扰片段Frizzled受体303序列,siRNA 303 序列对Frizzled 受体具有最佳的mRNA 和蛋白质抑制效率。转染siRNA 303 后,CCK-8 实验显示KFB 进入对数生长期后细胞生长受抑制程度增大,增殖减慢,并且随着培养时间的延长, 细胞倍增时间明显延迟。这可能与Wnt/β-catenin 信号通路抑制后导致其下游与细胞周期相关靶基因如cyclin D1 等改变有关。正常情况下,cyclin D1 蛋白表达可与周期蛋白依赖性激酶(CDK)4/6结合形成复合物,促进细胞G1 期向S 期转换,细胞因而从G1 期进入S 期,促进细胞的过度增殖或活化[15]。所以Frizzled 受体在KD 发生过程中的作用可能是通过上调cyclin D1 表达,使细胞外基质降解和细胞增生分化失控而导致KD 的发生和发展。本研究结果表明Frizzled siRNA 转染后,KFB 的Frizzled 受体及cyclin D1mRNA 和蛋白表达均下降,从而导致KFB 发生G0~G1期阻滞,使得细胞生长受抑,倍增时间延长;且KFB 的Frizzled受体上游基因Wnt2 和下游基因GSK3β mRNA和蛋白表达均下降,且p-GSK3β 蛋白表达下降。提示Wnt/β-catenin 信号通路中的上、下游基因还存在着双向调节,这一现象在其他文献中均未报道,有待今后进一步研究。
综上, 本研究结果表明通过靶向Frizzled 受体的siRNA 抑制,可以干扰Wnt 信号通路,抑制成纤维细胞增殖及活化, 提示Frizzled 受体可能成为一个有效治疗KD 的分子靶点。
参考文献
[1] Wolfram D, Tzankov A, Pülzl P, et al. Hypertrophic scars andkeloids areview of their pathophysiology, risk factors, and therapeuticmanagement[J]. Permatol Surg, 2009, 35(2): 171-181.
[2] Enshell-Seijffers D, Lindon C, Kashiwagi M, et al. Betacateninactivity in the dermal papilla regulates morphogenesis and regenerationof hair[J]. Dev Cell, 2010, 18(4): 633-642.
[3] Wang Y, Macke JP, Abella BS, et al. A large family of transmembranereceptors homologous to the product of the Drosophilatissue polarity gene frizzled[J]. J Biol Chem, 1996, 271(8): 4468-4476.
[4] Zhang H, Zhang X, Wu X, et al. Interference of Frizzled 1 (FZD1)reverses multidrug resistance in breast cancer cells through theWnt/β-catenin pathway[J]. Cancer Lett, 2012, 323(1): 106-113.
[5] Jin X, Jeon HY, Joo KM, et al. Frizzled 4 regulates stemnessand invasiveness of migrating glioma cells established by serial intracranialtransplantation[J]. Cancer Res, 2011, 71(8): 3066-3075.
[6] Wei W, Chua MS, Grepper S, et al. Soluble Frizzled-7 receptorinhibits Wnt signaling and sensitizes hepatocelluLar carcinomacells towards doxorubicin[J]. Mol Cancer, 2011, 10: 16.
[7] Nambotin SB, Lefrancois L, Sainsily X, et al. Pharmacologicalinhibition of Frizzled-7 displays anti-tumor properties in hepatocellularcarcinoma[J]. J Hepatol, 2011, 54(2): 288-299.
[8] Yang L, Wu X, Wang Y, et al. FZD7 has a critical role in cellproliferation in triple negative breast cancer[J]. Oncogene, 2011,30(43): 4437-4446.
[9] Wang HQ, Xu ML, Ma J, et al. Frizzled-8 as a putative therapeutictargetin human lung cancer[J]. Biochem Biophys Res Commun,2012, 417(1): 62-66.
[10] Bayle J, Fitch J, Jacobsen K, et al. Increased expression ofWnt2 and SFRP4 in Tsk mouse skin: role of Wnt signaling inalteredderrnal fibrillin deposition and systemic sclemsis[J]. J InvestDermatol, 2008, 128(4): 87l-881.
[11] Sun X, He Y, Huang C, et al. Distinctive microRNA signatureassociated of neoplasms with the Wnt/β-catenin signaling pathway[J]. Cell Signal, 2013, 25(12): 2805-2811.
[12] 张胜逆, 张涛, 楚瑞琦, 等. 原癌基因WNT1、β-连环蛋白、T细胞因子4 在基底细胞癌中的表达及意义[J]. 临床皮肤科杂志,2016, 48(7): 503-506.
[13] Amin N, Vincan E. The Wnt signaling pathways and cell adhesion[J]. Front Biosci(Landmark Ed), 2012, 17: 784-804.
[14] Luo W, Zhao X, Jin H, et al. Akt1 signaling coordinates BMPsignaling and β-catenin activity to regulate second heart fieldprogenitor development[J]. Development, 2015, 142(4): 732-742.
[15] Liang J, Slingerlang JM. Multiple roles of the PI3K/PKB(Akt)pathway in cell cycle progression [J]. Cell Cycle, 2003, 2 (4):339-345.
查看更多