查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





腮腺恶性肿瘤在头颈部恶性肿瘤中发病率相对较低,缺少大型临床研究数据支持,同时具有病理类型繁多、生物学行为复杂的特点,给临床诊疗带来了诸多挑战,尤其是对于复发转移患者,治疗选择有限且效果欠佳。近年来,靶向治疗和免疫治疗的兴起为晚期肿瘤患者带来了新的治疗选择。HER2在多种恶性肿瘤中呈过表达状态,是肿瘤治疗的关键靶点之一。本期将分享一例HER2阳性的腮腺癌术后复发转移治疗案例,治疗应用维迪西妥单抗联合免疫治疗,患者疾病进展得到有效控制,无进展生存期(PFS)达8月余。我们将在南方医科大学南方医院孙菲教授的分享以及席菁乐教授的专业点评中深入剖析患者的诊疗经过,为HER2阳性腮腺恶性肿瘤的治疗提供临床实践参考。
病例分享

孙菲 教授
南方医科大学南方医院肿瘤内科住院医师、博士
以共同第一或共同作者发表SCI论文7篇(Journal for Immunotherapy of Cancer, Cell Metabolism, Cancer Immunology Research, J Exp Clin Cancer Res, Front Cell Dev Biol等)
现病史
男性,64岁。因“右腮腺癌术后4年余,发现多发转移近半月。”于2023-04-25我科入院。
2018-10患者无明显诱因下发现右侧颈部肿物,起初约“黄豆”大小,无明显自觉症状,后肿物逐渐增大,并出现局部面颈部轻微麻木。2019-02-21外院就诊,完善颈部彩超提示右侧腮腺及颈部结节,性质待定,于彩超引导下行右侧腮腺肿物穿刺活检,病理结果提示(右颈)转移性中分化腺癌。2019-03-06我院就诊,完善PET-CT提示:1.右侧腮腺内结节状高代谢病灶,考虑为腮腺癌,病灶内见少量液化、坏死;2.右侧颌面部皮下见2个软组织结节影,代谢增高,考虑为转移灶;3.右侧颈部(IIA、IIB区)见多个淋巴结增大,代谢增高,考虑为淋巴结转移灶;4.左侧颈部(IIA区)见1个淋巴结稍增大,代谢轻度增高,多考虑为淋巴结炎症。2019-03-13于我院行右侧腮腺癌扩大切除术+面神经解剖术+右侧根治性颈淋巴结清扫术+右侧股前外侧皮瓣制备术+颌面部缺损游离皮瓣移植修复术。2019-03-18手术标本检查与诊断(显微摄影)提示(原发灶及颈大块)唾液腺高级别浸润性导管癌,局部为导管内癌,侵犯皮肤表皮。2019-04-22术后复查增强MRI未见手术残留,胸部CT平扫示:双肺多个微小结节,考虑炎性病灶。2019-05-07至2019-07-01行术后辅助放疗,放疗期间行顺铂单药同步化疗3周期,具体方案为:顺铂50mg d1,40mg d2-3。放疗完成后于2019-07-27、2019-08-21行TP方案辅助化疗2周期,具体方案为:紫杉醇脂质体170mg+顺铂35mg d1,40mg d2。2019-09-26、2019-12-02、2020-07-14、2020-12-18影像学复查未见明确肿瘤残留或复发转移。
2023-03患者无明显诱因下出现腹部胀痛伴胸背部疼痛,呈刺痛样,无放射,无恶心呕吐,无胸闷等不适。外院就诊完善CT检查提示1.左肺上叶前段及右肺上叶后段结节影,边缘毛糙,局部呈浅分叶改变,性质待定(肺Ca?其他?),建议结合活检;2.左后上胸膜呈结节状突起,胸膜转移?3.左侧少量胸腔积液。2023-04-10我院胸外科入院,2023-04-14复查PET-CT提示:1.右侧腮腺癌术后,右侧腮腺缺如,术区软组织代谢轻度增高,考虑为术后改变;左侧颈部(IB区)见1个淋巴结稍增大,代谢轻度增高,考虑为淋巴结炎性增生;2.左肺上叶前段见1个不规则形结节,代谢增高,多考虑为左肺周围型肺癌,但不除外肺转移瘤的可能;3.右肺上叶后段见1个不规则形结节,代谢增高,考虑为肺转移瘤;4.纵隔内(2R组)及左肺门见多个淋巴结增大,代谢增高,考虑为淋巴结转移灶;5.左侧胸膜见多发结节状高代谢病灶,考虑为左侧胸膜广泛转移。
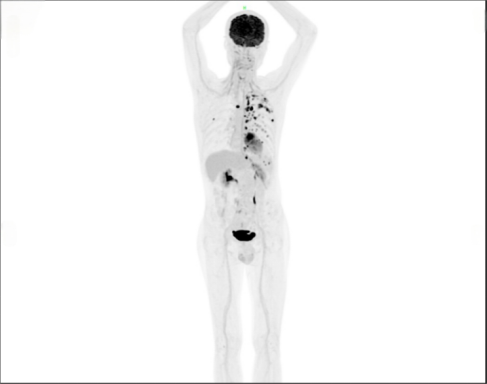
2023-04-19行CT定位下经皮穿刺左肺结节活检术,术后病理示:(左肺结节)镜下形态结合病史,考虑唾液腺高级别浸润性导管癌转移。免疫组化(01#):CK(+)、P63(-)、CD117(-)、EMA(+)、TTF-1(-)、CK7(+)、NapsinA(-)、HER2(2+)、ALK-D5F3(单)(-)、BRAF-V600E(-)、C-met(0)、PD-L1.SP263(CPS<1)、Ki-67(+,90%)。诊断考虑为腮腺癌肺转移,遂于2023-4-25我科入院。
2023-04-19 CT
入院诊断
腮腺癌术后复发转移(rTxN2cM1,IVC期,HER2(2+))
肺继发恶性肿瘤
淋巴结继发恶性肿瘤
胸膜继发恶性肿瘤
诊治经过
患者诊断为腮腺癌术后复发转移IVC期,一般情况差,既往TP方案化疗期间在用药剂量保守情况下仍无法耐受,与患者及家属充分沟通后,患者及家属拒绝一线双药方案姑息化疗,考虑患者HER2表达阳性,最终决定尝试免疫治疗联合抗HER2靶向治疗。2023-04-26至2023-09-21规律行9周期姑息治疗,具体方案为:特瑞普利单抗240mg d1,维迪西妥单抗120mg d1,Q3W。
治疗期间于2023-06-13、2023-09-12复查腮腺+颈部+胸部增强CT提示病灶较前缩小,疗效评价病变稳定(SD)。
2023-06-13 CT增强扫描:1.右侧腮腺癌术后改变;2.左侧颌下稍大淋巴结,考虑淋巴结炎性增生可能,建议随诊除外转移;3.双侧上颌窦及右侧蝶窦炎症;右侧中耳乳突炎症;4.左肺上叶前段及右肺上叶后段实性结节较前缩小,右肺下叶外基底段新增小结节,可疑转移瘤,建议随诊;余前片所示肺结节现未见显示;5.原左肺下叶前内基底段、右肺下叶外侧基底段小钙化灶现显示不清;6.右肺中叶及双肺下叶新发病灶,考虑炎症,部分支气管内黏液栓形成,建议治疗后复查;7.双侧胸膜增厚,左侧胸膜结节状增厚,较前减轻;左侧胸腔积液已吸收。
2023-06-13 CT
2023-09-12 CT增强扫描:1.右侧腮腺癌术后改变;2.左侧颌下稍大淋巴结,同前,考虑淋巴结炎性增生可能,建议随诊除外转移;3.双侧上颌窦及右侧蝶窦炎症,大致同前;左侧蝶窦新见少许炎症;右侧中耳乳突炎症,同前;4.左肺上叶前段及右肺上叶后段实性结节较前增大,考虑转移瘤可能,建议密切复查或进一步检查;原右肺下叶外基底段小结节现未见显示;双侧斜裂新发小结节,建议随诊;5.右肺中叶、左肺上叶舌段及双肺下叶炎症可能,部分较前略吸收,部分较前稍进展,部分支气管内黏液栓形成,建议治疗后复查;双侧胸膜增厚,大致同前。
2023-09-12 CT
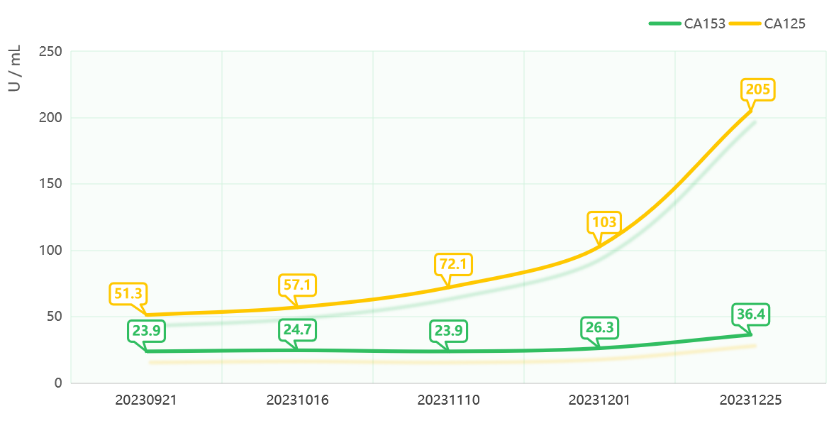
治疗期间规律随访肿瘤标志物水平,CA153及CA125均有明显降低。
2023-04-26至2023-09-21治疗期间肿瘤标志物变化
2023-10检测发现患者心肌酶谱及肌钙蛋白异常升高,完善心脏彩超、冠脉CTA等未见器质性病变,考虑免疫相关心肌炎G1,予暂停免疫治疗。
2023-10-19至2023-12-22予4周期维迪西妥单抗120mg Q2W单药维持治疗。
治疗期间于2023-11-23、2024-01-6复查腮腺+颈部+胸部增强CT提示病灶较前稍增大,疗效评价SD。后患者因个人原因未返院继续治疗。
2023-11-23 CT增强扫描:1.右侧腮腺癌术后改变,未见明显复发征象;2.左侧颌下稍大淋巴结,较前变化不大,考虑淋巴结炎性增生可能,建议随诊除外转移;3.双侧上颌窦及双侧蝶窦炎症,大致同前;右侧中耳乳突炎症,同前;4.左肺上叶前段及下叶后基底段、右肺上叶后段实性结节较前增大,考虑转移瘤可能;双肺多发小结节,较前增多,建议密切随访除外部分转移;5.右肺中叶、左肺上叶舌段及双肺下叶炎症,部分支气管内黏液栓形成,较前稍进展,建议治疗后复查;双侧胸膜增厚,大致同前。
2023-11-23 CT
2024-01-06 CT增强扫描:1.右侧腮腺癌术后改变,术区未见明确复发征象,建议随访;2.左侧颌下淋巴结,较前略缩小,考虑淋巴结炎性增生可能,建议随诊除外淋巴结转移;3.双侧上颌窦及蝶窦炎症;右侧中耳乳突炎症;均同前;4.左肺上叶前段及右肺上叶后段实性结节,左肺病灶较前稍增大,右肺病灶基本同前,考虑转移瘤可能;双肺多发小结节,较前增多,部分较前稍增大,不除外部分为转移瘤,建议密切随访;5.右肺中叶、左肺上叶舌段及双肺下叶炎症,部分实变,较前进展,部分支气管内黏液栓形成,较前进展,建议继续治疗后复查;左侧胸腔新发少量积液;双侧胸膜增厚,较前明显。
2024-01-06 CT
治疗期间规律随访肿瘤标志物水平,CA153相对稳定,CA125呈升高趋势。
病例点评

席菁乐 教授
南方医科大学南方医院肿瘤科副主任医师
医学博士,硕士生导师
美国纽约州立大学癌症研究院访问学者
中国肿瘤防治联盟乳腺癌专业委员会委员
中国抗癌协会肿瘤心理学专业委员会委员
广东省医师协会肿瘤内科医师分会委员会委员
广东省临床医学学会头颈肿瘤综合治疗专委会委员
广东省抗癌协会化疗专业委员会青年委员会委员
广东省老年保健协会基层肿瘤防治与康复专业委员会常务会员
广东省抗癌协会皮肤肿瘤专业委员会委员
广东省药学会妇科肿瘤专家委员会委员
广东省临床医学学会真实世界研究专业委员会委员
广东省中西医结合学会肿瘤心理学专业委员会常务委员
广东省中西医结合学会肿瘤生物治疗专业委员会委员
腮腺肿瘤约占头颈部所有肿瘤的2%-3%[1],占唾液腺区肿瘤的80%,其中,腮腺恶性肿瘤比例约为20%-25%[2]。腮腺恶性肿瘤常表现为生长迅速且形态不规则,质地通常较硬,位置固定不易滑动,与周围边界不清,可出现肿块处疼痛,部分还可见皮肤破溃。肿瘤易侵犯周围肌肉血管以及面神经,可有面部麻木、疼痛以及张口受限等症状,部分患者还会出现听力减退、吞咽困难等症状[3]。晚期可发生颈部淋巴结转移或远处转移,严重威胁患者生存质量和预后[4]。腮腺恶性肿瘤的治疗通常以手术治疗为主,手术后最常见的并发症为面瘫,其预后与病理类型以及肿瘤分期相关[5]。此外,腮腺恶性肿瘤术后复发和远处转移风险较高,对于此类患者,传统治疗方式如放化疗等通常效果相对有限。
近年来,随着学界对肿瘤分子生物学的深入研究,靶向治疗和免疫治疗逐渐成为多种恶性肿瘤的关键治疗手段,也为腮腺恶性肿瘤的治疗提供了新方向。其中,人表皮生长因子受体2(HER2)作为癌症重要驱动基因,在包括乳腺癌、胃癌、肺癌等多种恶性肿瘤中存在过表达,成为肿瘤靶向治疗的重要靶点。据报道,唾液腺癌患者中HER2过表达的比例为7%-56%,因组织学亚型而异,在唾液腺导管癌患者中的比例较高[6]。有研究证明,HER2靶向药物对唾液腺癌具有一定疗效,能够有效缓解病情并可能持久作用于肿瘤组织[7, 8]。
本例患者初始诊断腮腺癌伴有淋巴转移,之后接受了扩大切除术、面神经解剖术、根治性颈淋巴结清扫术等多项手术治疗,并在术后进行了辅助放疗和化疗。术后4年患者出现腹部胀痛及胸背部疼痛症状,经检查发现肺部、胸膜以及淋巴结等多处转移病灶,肺部穿刺病理检查提示腮腺癌肺转移,且免疫组化结果显示HER2(2+)。检测HER2状态对于指导后续治疗方案的选择至关重要,《腮腺恶性肿瘤专家共识》[9]同样提到某些分子改变可作为腮腺恶性肿瘤治疗靶点或临床预后影响因素。考虑患者病情复杂、肿瘤负荷高、化疗耐受性差,同时患者及家属拒绝行化疗,初始治疗方案选择了维迪西妥单抗联合特瑞普利单抗免疫治疗。
维迪西妥单抗是荣昌生物自主研发的一款抗HER2抗体偶联药物(ADC),同时也是我国首个原创ADC,以HER2抗体作为靶向载体,通过可裂解的连接子与小分子毒素(MMAE)共价偶联而成[10]。它可通过特异性结合HER2蛋白,将细胞毒性药物MMAE直接递送到肿瘤细胞内部抑制其生存和增殖,从而提高治疗效果并减少对正常细胞的损害。维迪西妥单抗于2021年6月9日在中国获批,用于接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)的患者和既往接受过含铂化疗且HER2过表达局部晚期或转移性尿路上皮癌的患者。近年来,其在其他HER2阳性肿瘤中的应用也逐渐受到关注。例如,在一项针对HER2基因异常非小细胞肺癌(NSCLC)的真实世界研究中,维迪西妥单抗单药或联合治疗的客观缓解率(ORR)为45.5%,中位无进展生存期(mPFS)为7.5个月,显示出显著的疗效和良好的安全性[11]。在肠癌、泌尿系统恶性肿瘤、乳腺癌、阴茎癌以及乳房外paget等疾病中,相关成果接连在美国临床肿瘤学会(ASCO)、欧洲肿瘤内科学会(ESMO)、欧洲肿瘤内科学会亚洲会议(ESMO-ASIA)重磅会议及European Urology Oncology、European Journal of Cancer、Cancer Medicine等重磅期刊上亮相。
本例患者在治疗过程中因免疫相关心肌炎选择暂停免疫治疗,后期使用维迪西妥单抗单药治疗。在前后共13周期、长达8月余的治疗过程中,患者病情稳定,多发转移病灶的进展得到了有效控制。联合治疗期间影像学检查提示病灶缩小,疗效评估为SD且肿瘤标志物CA153及CA125均明显降低,治疗方案在控制肿瘤进展方面取得了一定成效。单药治疗期间影像学检查提示病灶稍增大,但整体疗效仍维持SD,肿瘤标志物CA153相对稳定,CA125呈升高趋势,病情处于相对稳定状态。从该例患者的治疗过程来看,维迪西妥单抗可能为HER2阳性腮腺癌患者带来长期的临床获益,此外,即使在PD-L1表达水平不高的情况下(本例患者CPS<1),维迪西妥单抗联合免疫治疗仍能进一步提升疗效。在联合用药过程中,需要密切监测免疫相关心肌炎、肝炎、肺炎、皮炎、甲状腺功能异常等免疫相关不良事件(irAEs)的发生,并依据严重程度给予及时处理。
总的来说,维迪西妥单抗作为一种抗HER2 ADC,在腮腺恶性肿瘤的治疗中具有广阔的应用前景,随着更多相关病例的出现和临床研究的开展,其在提高患者生存率和生活质量方面的潜力也将得到进一步验证,为患者带来切实的临床获益。
参考文献:
1.Dos Santos ES, Rodrigues-Fernandes CI, Speight PM, et al. Impact of tumor site on the prognosis of salivary gland neoplasms: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2021;162:103352.
2.Ng-Cheng-Hin B, Glaholm J, Awad Z, Gujral DM. Elective Management of the Neck in Parotid Tumours. Clin Oncol (R Coll Radiol). 2018;30(12):764-772.
3.李祖飞.综述:腮腺区常见恶性肿瘤及其特点汇总[J].中国临床肿瘤学会 (CSCO).
4.周旋,张睿哲,董琳,等.151例腮腺恶性肿瘤临床病理特征分析[J].中国肿瘤临床,2022,49(18):926-930.
5.Maahs GS, Oppermann Pde O, Maahs LG, Machado Filho G, Ronchi AD. Parotid gland tumors: a retrospective study of 154 patients. Braz J Otorhinolaryngol. 2015;81(3):301-306.
6.Haddad R, Colevas AD, Krane JF, et al. Herceptin in patients with advanced or metastatic salivary gland carcinomas. A phase II study. Oral Oncol 2003;39:724–727.
7.Li BT, Shen R, Offin M, et al. Ado-trastuzumab emtansine in patients with HER2 amplified salivary gland cancers (SGCs): results from a phase II basket trial [abstract]. J Clin Oncol 2019;37(Suppl):Abstract 6001.
8.Jhaveri KL, Wang XV, Makker V, et al. Ado-trastuzumab emtansine (T-DM1) in patients with HER2-amplified tumors excluding breast and gastric/gastroesophageal junction (GEJ) adenocarcinomas: results from the NCI-MATCH trial (EAY131) subprotocol Q. Ann Oncol 2019;30:1821–1830.
9.中华口腔医学会.T/CHSA 004-2023,腮腺恶性肿瘤诊疗专家共识[S].
10.Li H, Yu C, Jiang J, et al. An anti-HER2 antibody conjugated with monomethyl auristatin E is highly effective in HER2-positive human gastric cancer. Cancer Biol Ther. 2016;17(4):346-354.
11.Zhang M, Wang L, Wang Q, et al. Efficacy of disitamab vedotin in non-small cell lung cancer with HER2 alterations: a multicenter, retrospective real-world study. Front Oncol. 2024;14:1441025. Published 2024 Nov 6.
查看更多