查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:上海交通大学附属第六人民医院 陈明云 李连喜
系列文章推荐
蛋白激酶C(PKC)广泛分布在哺乳动物组织中,PKC家族包含多种亚型,是由一个多基因家族编码的丝氨酸/苏氨酸激酶,可分为三种类型:第一类为经典PKC(classical PKC, cPKC),主要包括α、β1、β2及γ亚型,其活性依赖于Ca2+、磷脂酰丝氨酸(PS)和二酯酰甘油(DAG);第二类为新型PKC(new PKC, nPKC),主要包括δ、ε、η和θ亚型,其活性是非钙离子依赖性的,可以被PS和DAG所激活;第三种为非典型PKC(atypical PKC, aPKC),主要包括ζ、λ、μ及τ亚型,其活性仅依赖于PS,不需要DAG和钙离子激活。
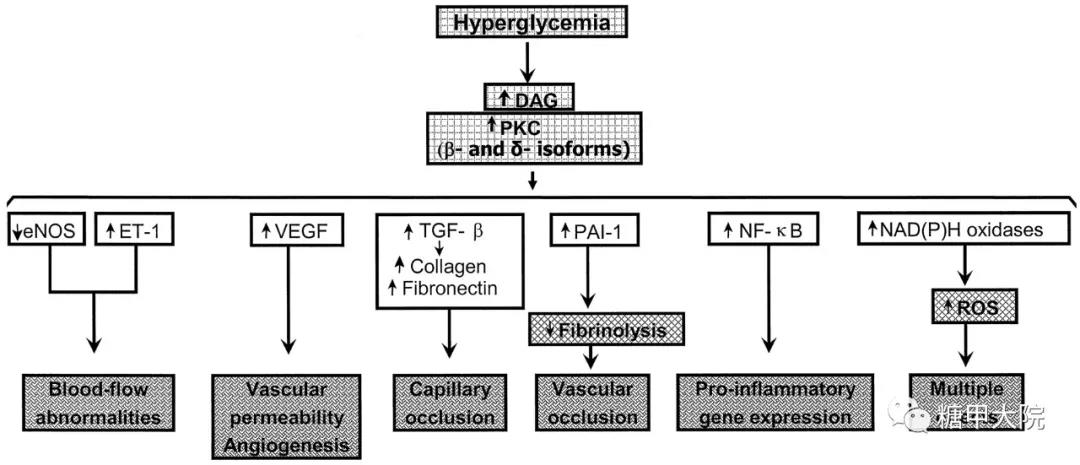
DAG是机体内主要的PKC激动剂。生理情况下,DAG主要来源于磷酸肌醇的代谢和磷脂酰胆碱的裂解,但也可由脂质前体在磷脂酶A2的作用下释放出游离脂肪酸而生成。高血糖激活PKC信号通路主要通过DAG途径。高血糖引起血管组织中DAG的升高可能主要通过两个途径,一是血管细胞中葡萄糖浓度的增高可以使磷脂酶D活性升高,导致磷脂酰胆碱水解增加而使DAG生成增多;二是血管细胞中葡萄糖浓度的增高导致葡萄糖中间代谢产物增加而使DAG的生成增加。
蛋白激酶C(PKC)途径
PKC信号途径在血管功能的调节以及糖尿病AS发病中扮演着十分关键的角色。高血糖所诱导的PKC信号途径的激活可能通过下述几个机制导致糖尿病大血管病变的产生:
第一,促进血管平滑肌细胞增殖(VSMC)
众所周知,血管平滑肌细胞增殖在糖尿病AS发病中起着举足轻重的作用,高血糖可诱导VSMC异常增生、迁移和肥大,而PKC的激活在细胞增殖的信号传导中具有十分重要的意义。Yang等研究发现,PKC信号通路的抑制剂可以明显减少氧化型低密度脂蛋白(ox-LDL)的促血管平滑肌细胞增殖作用。Greene等研究发现血管紧张素Ⅱ的促进血管平滑肌细胞增殖作用也是依赖于PKC途径的激活。以上研究结果均提示PKC通路的激活参与了AS发病过程中血管平滑肌细胞的增殖。并且,PKC可激活血管平滑肌细胞中NF-KB表达水平,进而增加血管细胞中促炎基因的表达从而恶化血管壁的炎症。
第二,导致血管内皮细胞功能失调
血管内皮功能失调是糖尿病AS病变的早期表现, AS病变首先是从内皮细胞损伤开始的。正常时,内皮细胞通过产生一氧化氮(nitric oxide, NO)调节血管张力,产生纤溶蛋白、组织型纤维蛋白溶酶原激活剂(tPA)防止血栓形成,同时内皮紧密连接的完整可以防止血小板、单核细胞以及脂质浸润内皮下间隙。但糖尿病时的各种损伤因素可以造成血管内皮细胞的损伤,受损的内皮细胞丧失产生NO的能力从而导致一系列不良后果:血管舒张能力减退;血小板激活;白细胞黏附至内皮增多并进一步迁移入血管壁而引发血管炎症;平滑肌细胞增殖及迁移增加。同时,内皮细胞紧密连接的破坏导致脂质扩散至内皮下间隙,潴留的脂质被氧化。上述这些变化导致糖尿病AS病变的发生。
已经有研究证实,PKC信号通路的激活导致多种与血管内皮功能相关的因子包括内皮素-1(ET-1)、NO、血管紧张素、PGE2、PGI2、PGF2a、VEGF、VPF、活性氧(reactive oxygen species, ROS)等含量或其功能发挥产生异常,从而导致血管内皮细胞功能失调如血管内皮细胞通透性增高等,从而导致糖尿病AS病变的产生。PKC可抑制eNOS活性,降低NO水平,导致血管舒缩功能障碍;同时可促进血管内皮细胞分泌内皮素1(endothelin l,ET-1)、血管紧张素Ⅱ(angiotensin II,Ang II)、TXA2等促血管收缩的活性物质的表达;PKC促使VEGF表达,从而促进新生血管形成,增加血管通透性;PKC上调TGF-B表达,增加纤维连接蛋白和Ⅳ型胶原的表达,导致细胞外基质扩张;PKC使PAl-1生成增加,促进了糖尿病大血管病变的高凝、低纤溶和高血黏度状态的形成。
第三,促进血管壁中泡沫细胞的形成
凝集素样氧化型LDL受体-1(Lectin-like oxidized LDL receptor-1, LOX-1)是一个可以表达于血管细胞上的ox-LDL受体,Li等研究发现,高糖可以上调血管细胞中LOX-1基因的表达,LOX-1途径的活化能诱导人巨噬细胞源性泡沫细胞的形成,而PKC通路抑制剂可以减少高糖所诱发的血管细胞LOX-1基因的上调。提示PKC通路参与了糖尿病AS病变中泡沫细胞的形成。
此外,PKC激活还能增加中性粒细胞、单核细胞与内皮间的相互作用,并增加单核细胞的黏附作用并促进其向巨噬细胞转化。
由此可见,PKC通路的激活是糖尿病大血管病变的一个普遍下游机制。与此同时,多项研究发现,PKC的抑制剂ruboxistaurin(RBX,LY333531)可以通过抑制过度活跃的PKC进而预防或逆转高血糖引起的血管功能异常,如基底膜增厚和系膜扩张。RBX抑制转化生长因子B及细胞外基质蛋白的表达,降低血管内皮生长因子导致的血管渗透性增加和血管形成,恢复视网膜的正常血流,降低氧化应激,改善心脏和血管内皮细胞功能紊乱。
来源:糖甲大院
查看更多