查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





编辑 | 丁雨竹(中国医学论坛报)
快讯:黑色素瘤靶向新药及伴随诊断试剂昨日于美国获批

6月27日,美国食品与药物管理局(FDA)批准了Array BioPharma公司的靶向组合疗法Encorafenib(商品名Braftovi)+ binimetinib(商品名Mektovi)用于治疗由BRAF突变(V600E或V600K)引起的、不可切除或转移性黑色素瘤。

该批准基于一项名为COLUMBUS的Ⅲ期临床研究的第一部分(注册号:NCT01909453),该研究今年3月22日在《柳叶刀·肿瘤学》(Lancet Oncol)杂志发表了无进展生存(PFS)结果;该公司曾与今年2月公布了试验的总生存(OS)结果。
这项国际、开放标签、多中心试验共纳入577例晚期黑色素瘤患者,1:1:1随机分组,分别接受 encorafenib + binimetinib (E+B)、encorafenib(E)或维莫非尼(vemurafenib)治疗,每日服药直至疾病进展。结果显示,E+B组合疗法显著延长主要终点中位PFS期,达到14.9个月,而在维莫非尼组为7.3个月(HR=0.54;95%CI:0.41~0.71;P<0.0001)。同时,E+B组合显著降低死亡风险(E+B对维莫非尼:HR=0.61,95%CI 0.47~0.79,P<0.001),并可将OS延长17个月(中位OS期,E+B组对维莫非尼单药组:33.9个月对16.9个月)。
PFS和OS数据显示,在黑色素瘤靶向治疗领域里,新药组合相比传统单药具有“空前优势”。
同一天获批的还有bioMérieux公司的THxID BRAF检测试剂盒,作为encorafenib + binimetinib 的伴随诊断试剂,检测BRAF突变。FDA规定,使用E+B组合疗法前,必须使用经FDA批准的诊断试剂确诊。
▲ 《柳叶刀肿瘤学》Volume 19, No. 5, p603–615, May 2018;3月22日在线发表。
DOI: (18)30142-6
研发背景:黑色素瘤流行病学与治疗现状
据世界卫生组织的GLOBOCAN2012数据库统计,2015年全球皮肤黑色素瘤新增发病人数超过25万例,死亡超过6万例。近年来,黑色素瘤已成为所有恶性肿瘤中发病率增长最快的肿瘤,年增长率为3%~5%。
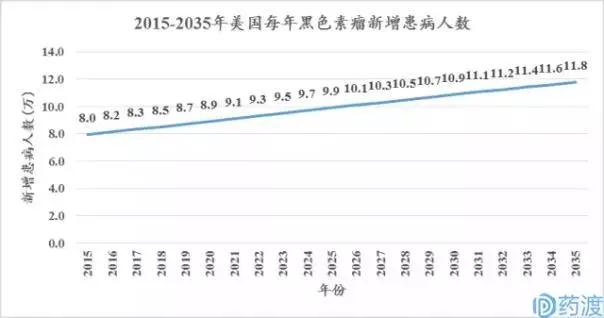 ▲ 2015~2035年美国每年黑色素瘤新增患病人数。数据来源:Datamonitor Health数据库。图片来源:药渡。
▲ 2015~2035年美国每年黑色素瘤新增患病人数。数据来源:Datamonitor Health数据库。图片来源:药渡。
转移性黑色素瘤是一种严重危及生命的皮肤癌。据美国国立卫生研究院(NIH)统计,转移性黑色素瘤5年PFS率仅19.9%。由于新增病例中约一半携带BRAF基因突变,因此BRAFV600也是治疗转移性黑色素瘤的关键靶点。
截至目前,不能手术切除的Ⅲ期或转移性黑色素瘤的全身治疗选择包括:免疫治疗(CTLA-4抑制剂和PD-1抑制剂)、BRAFV600抑制剂、MEK抑制剂、早期免疫治疗和化疗等。
本次批准的新药组合中,Encorafenib和binimetinib都是用于晚期肿瘤的靶向药:前者是BRAF小分子抑制剂,后者是MEK小分子抑制剂。推荐剂量为:binimetinib口服每日2次、每次45 mg;encorafenib口服每日1次、每次450 mg。
扩展阅读:COLUMBUS试验其他关键数据
COLUMBUS研究第一部分中位随访16.6个月。E+B和维莫非尼单药相比,总缓解率为63%对40%,中位缓解时间为16.6个月对12.3个月。
最常见(发生率超过5%)的3~4级不良事件及发生率在E+B组有γ-谷氨酰胺转移酶上升(9%)、肌酸磷酸激酶水平上升(7%)和高血压(6%);在encorafenib单药组有掌跖感觉丧失性红斑综合征(palmoplantar erythrodysesthesia syndrome,14%)、肌肉痛(10%)和关节痛(9%);在维莫非尼组为关节痛(6%)。
接受E+B组合治疗的患者中,有5%因不良事件而中止治疗,其中最常见原因是出血和头痛。
参考文献
Prof Reinhard Dummer, etc. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. The Lancet Oncology: Volume 19, No. 5, p603–615, May 2018
速递 | 3期试验成功,黑色素瘤新药组合今日申请上市(药明康德)
恶性黑色素瘤流行病学及市场分析(节选自药渡咨询部门的《IDO抑制剂调研报告》)

查看更多