查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2023年欧洲风湿病协会联盟(EULAR)大会已于5月31日~6月3日在欧洲最美丽、最具活力的城市之一米兰举行,报道了世界风湿病学领域的最新发展、科学会议、摘要等。本文将与您分享此次大会中风湿病相关间质性肺疾病(ILD)的疾病进展负担、预后,以及治疗相关的最新学术进展。
SSc-ILD队列中未经治疗患者的疾病特征和病程
ILD是系统性硬化症(SSc)患者主要的死因,但目前的指南认为有些患者可能无需药物治疗。一项双中心队列研究,纳入苏黎世和奥斯陆的386例系统性硬化症相关间质性肺疾病(SSc-ILD)患者,旨在描述未使用ILD潜在治疗药物(免疫抑制治疗或尼达尼布)患者的疾病特征和病程。研究发现,有290例患者(75%)在基线时未接受治疗,这些患者大多为女性,病程更长,局限性皮肤亚型更常见,抗着丝点抗体和C-反应蛋白(CRP)水平较低。在多变量逻辑回归中,HRCT上不太广泛的纤维化(OR:3.71[1.66-8.53],p=0.002)和抗着丝点抗体(OR:5.18[1.81-18.88],p=0.005)与基线时未治疗的ILD独立相关。然而,在近5年的随访期间,与通常的观点相反,135/233(58%)例未治疗的SSc-ILD患者显示疾病进展,男性、弥漫性皮肤亚型和广泛肺纤维化与肺部进展独立相关(图1)[1]。
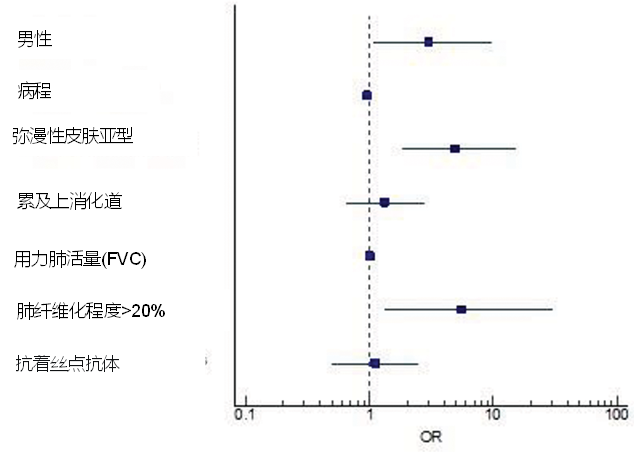
图1. 随访期间与肺部疾病进展相关因素
RA-ILD患者出现进展性纤维化表型的患病率
有关类风湿关节炎相关的间质性肺疾病(RA-ILD)的患病率和自然病程的数据主要基于回顾性研究,仅部分已知。来自意大利的一项多中心研究,旨在调查134例RA-ILD患者的横断面队列中进展性纤维化表型的患病率。根据影像学特征,50.7%的患者的ILD为可能或确定的普通型间质性肺炎(UIP)型,19.4%的患者为非特异性间质性肺炎(NSIP)型,29.8%的患者为其他表型。在整体研究人群中,35.8%的患者出现进展性纤维化表型(48/134)。进展性和非进展性ILD在FVC相对下降方面存在显著差异(分别为15.7%±16.4和-1.3%±8.3)。(图2)[2]。
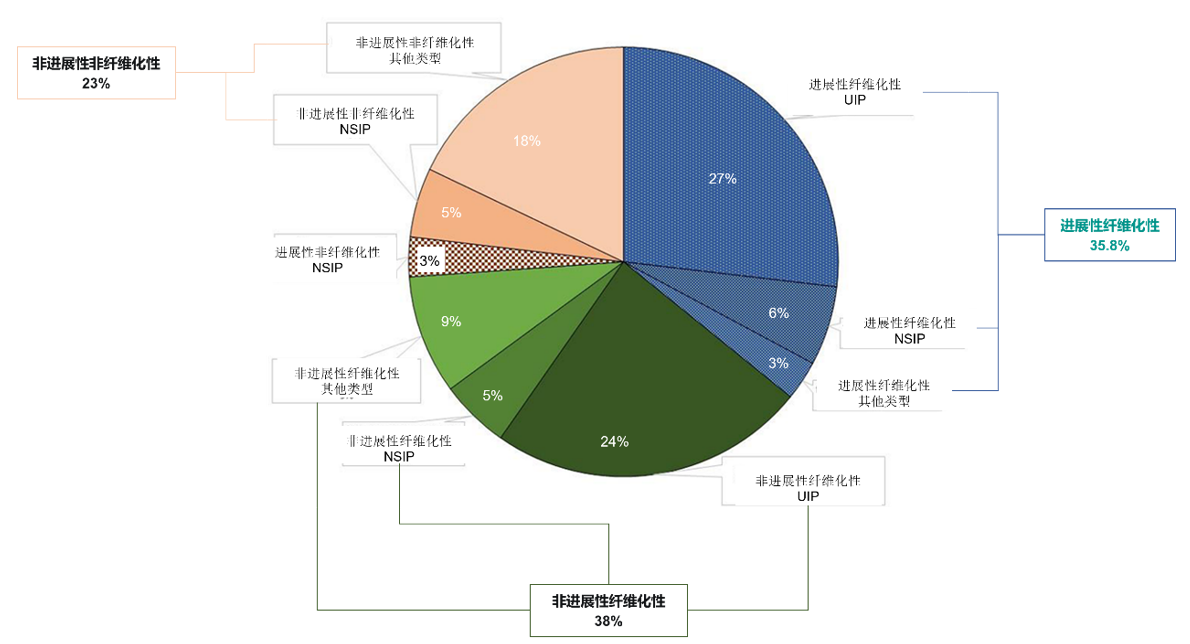
图2. RA-ILD患者的疾病类型分类
不同PPF标准与CTD-ILD患者死亡率的预后相关性
进展性肺纤维化(PPF)与患者预后不良相关。结缔组织病相关间质性肺疾病(CTD-ILD)患者也可能发生PPF,然而在临床试验(即INBUILD和RELIEF)和ATS/ERS/JRS/ALAT 2022指南中使用了不同的PPF标准,使研究比较和临床意义复杂化。为了探讨不同PPF标准与CTD-ILD患者死亡率的预后相关性,进行了一项单中心回顾性队列研究,纳入在2005年至2021年间的CTD-ILD或具有自身免疫特征的间质性肺炎患者230例。结果显示,61例(27%)符合 INBUILD 标准,53例(23%)符合ATS/ERS/JRS/ALAT 2022指南标准,136例(59%)符合简化PPF标准(两年内FVC相对下降≥10%,DLco相对下降≥15%,或HRCT上的纤维化进展),125例(54%)符合简化PPF标准且HRCT纤维化程度增加阈值≥5%。本研究表明:不同PPF标准之间的预后相关性无差异。当简化PPF标准将HRCT进展定义为纤维化程度增加≥5%时,预后相关性提高(图3)[3]。
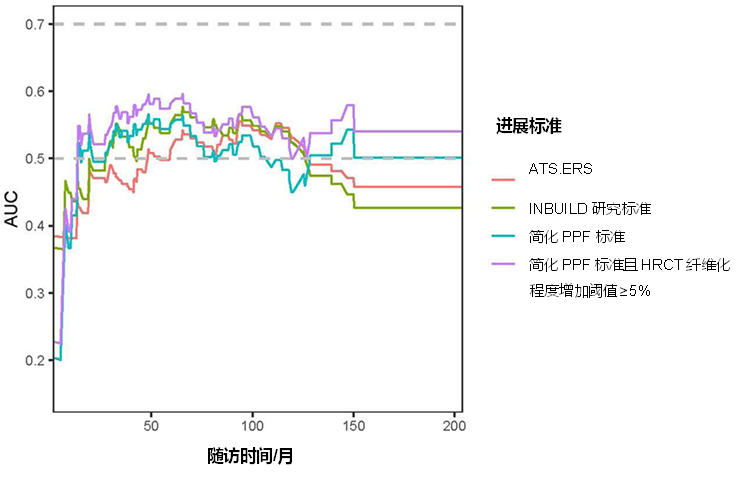
图3. 不同进展标准与预后的相关性
早期免疫抑制治疗能否预防SSc患者ILD的发生
虽然最近有研究报道,在轻度和中度ILD患者中初始免疫抑制(IMS)治疗对病程具有有利影响,但没有明确的证据证明IMS治疗是否可以预防ILD的发生。因此,为了探索初始IMS治疗时机与ILD发生率之间的相关性,从EUSTAR数据库和奈梅亨SSc队列创建了一个联合队列,确定了1037例SSc患者,按照疾病持续时间(首次出现雷诺现象以外的症状如手指肿胀及末梢血管病变等,直至开始IMS治疗的时间,截止点为3年)分为早期治疗组(n=539)和晚期治疗组(n=370)。研究发现,治疗3.6±1.4年后,ILD的发生率为46.1%,两组之间无显著差异(早期:47% vs. 晚期:45%,p=0.64)。在909例记录完整数据的SSc患者中,未经校正的Kaplan-Meier生存曲线(图4)提示:早期治疗组和晚期治疗组之间的ILD-free(无HRCT证实的ILD诊断)生存率无差异。本研究并未证实IMS早期治疗对ILD发生的预防作用[4]。
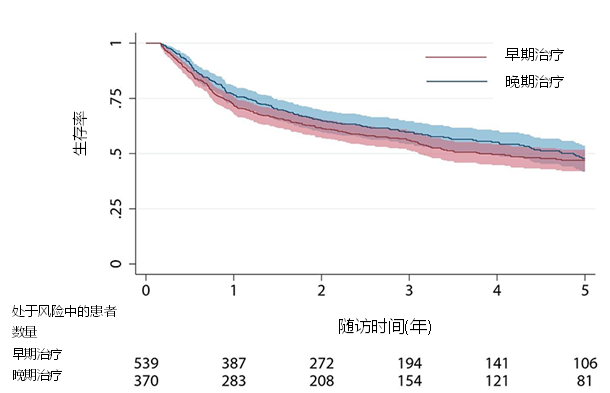
图4. Kaplan-Meier曲线评估的ILD- free生存
尼达尼布治疗风湿性疾病相关ILD
ILD是炎症性风湿性疾病(IRD)的严重表现。尼达尼布已获批用于治疗SSc-ILD和具有进展性表型的慢性纤维化性ILD(PF-ILD),但在其他IRD相关ILD中的治疗经验很少。一项多中心、回顾性队列研究,纳入64例患者,旨在探索接受尼达尼布治疗的IRD-ILD患者的临床特征和结局。
结果显示,最常见的潜在IRD是SSc(55%)和RA(28%)。治疗6个月后,与基线相比,校正后单次呼吸肺一氧化碳弥散量(DLCOc SB)(p=0.041)和校正后肺一氧化碳弥散量/肺泡通气量(DLCOc/VA)(p=0.029)显著改善。仅1/3的患者在诊断为ILD的3年内开始接受尼达尼布治疗,第24个月时观察到DLCOc SB和DLCOc/VA显著改善(p=0.003和p= 0.017),表明早期开始尼达尼布治疗可能阻止ILD的疾病进展(图5)[5]。
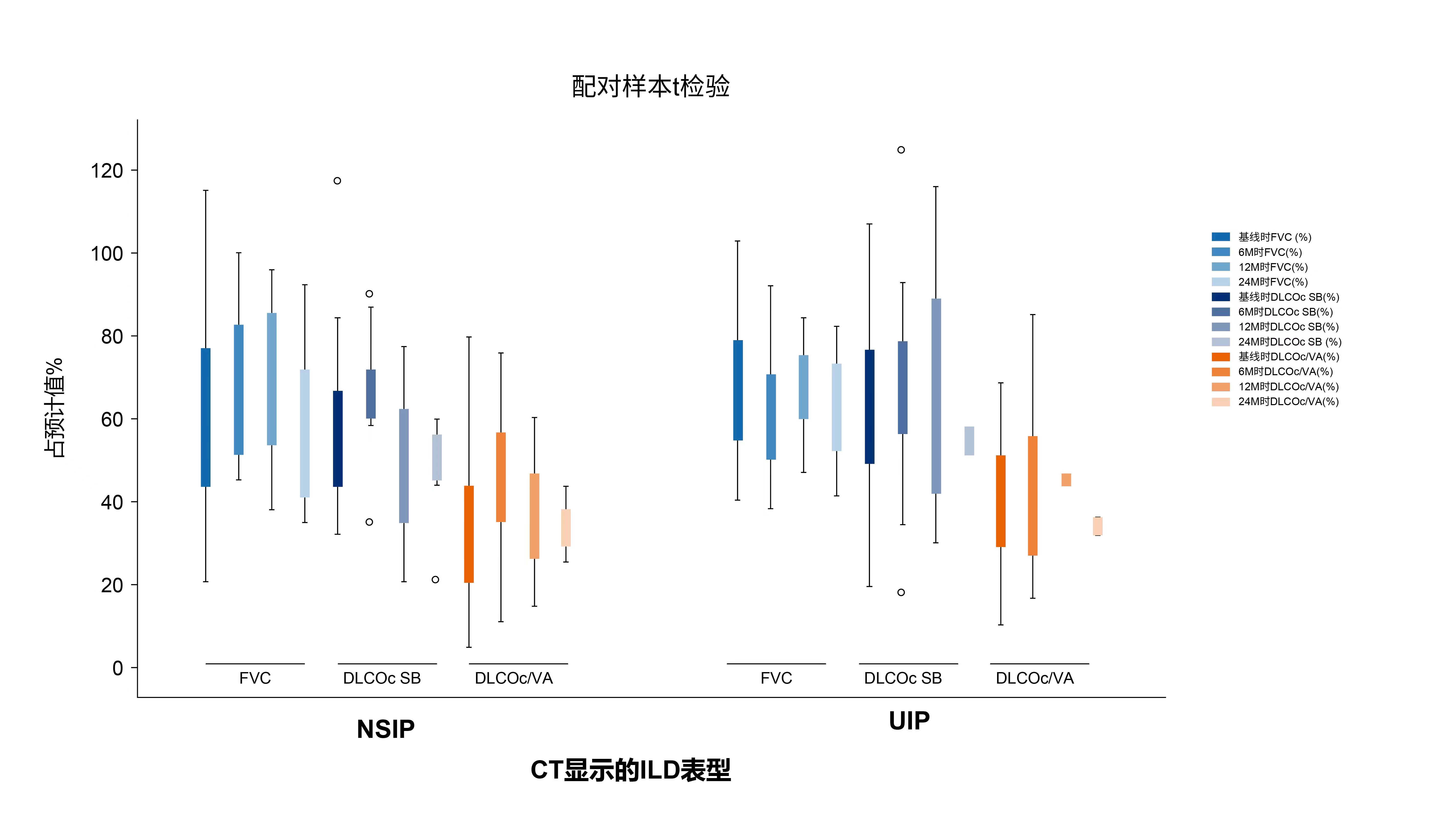
图5. 24个月内的呼吸功能检测结果
抗纤维化药物治疗进展性表型RA-ILD患者的有效性
ILD是RA的严重并发症。尽管使用了治疗RA-ILD的抗风湿药(DMARDs),但ILD的进展并不少见。INBUILD试验的亚组分析显示,进展性纤维化性自身免疫性疾病相关ILD患者使用抗纤维化药物尼达尼布治疗后,可使FVC下降减缓。为了评估尼达尼布和吡非尼酮在治疗进展性表型的RA-ILD患者中的疗效,来自西班牙的一项全国多中心研究,纳入临床实践中50例患者(尼达尼布组45例,吡非尼酮组5例)。研究发现,中位随访时间16个月后,未观察到平均FVC和DLCO值的下降(图6),83%的患者呼吸困难稳定或改善。抗纤维化药物,尤其是尼达尼布,似乎可延缓RA-ILD患者的ILD进展。抗纤维化药物和DMARDs联合治疗RA-ILD是可能的,也是安全的[6]。

图6. 抗纤维化药物治疗前后的FVC和DLCO在临床实践中的演变
SSc-ILD患者接受尼达尼布长期治疗的安全性和有效性
在SENSCIS试验中,尼达尼布可使SSc-ILD患者的52周内FVC(mL/年)下降率降低44%,且大多数患者的不良事件安全可控。SENSCIS-ON是一项开放标签扩展研究,旨在评估接受尼达尼布治疗的患者在148周内发生的不良事件和FVC下降情况。持续尼达尼布治疗组197例患者(在SENSCIS中接受尼达尼布治疗并在SENSCIS-ON中继续使用尼达尼布的患者),初始尼达尼布治疗组247例患者(在SENSCIS中接受安慰剂或在DDI研究中接受尼达尼布治疗≤28天的患者)。研究发现,在持续使用尼达尼布和初始使用尼达尼布的患者中,分别有64.0%和50.6%患者仍在接受尼达尼布治疗,26.9%和59.9%的患者剂量减少≥1次,36.5%和53.0%的患者治疗中断≥1次,14.7%和29.1%的患者因不良事件停药(图7)。持续尼达尼布治疗组从基线至第148周FVC的平均变化为-189.1±29.5mL,初始尼达尼布治疗组为-126.4±26.4mL(图8),支持尼达尼布在SSc-ILD患者的长期治疗中的潜在作用[7]。
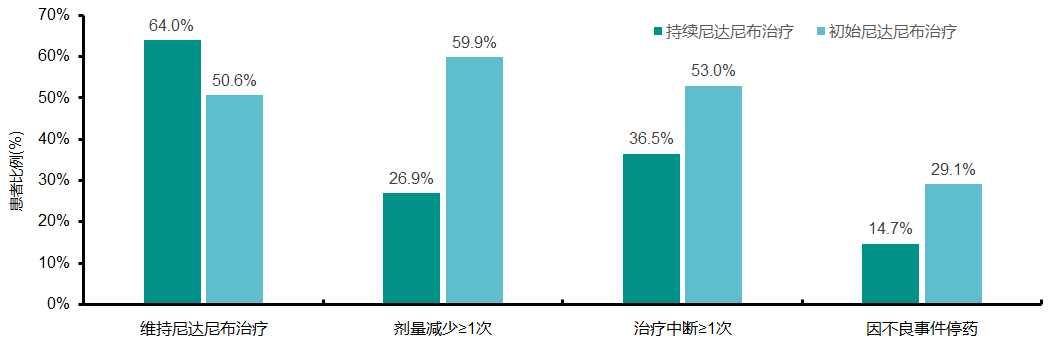
图7. 持续/初始使用尼达尼布患者的剂量调整情况
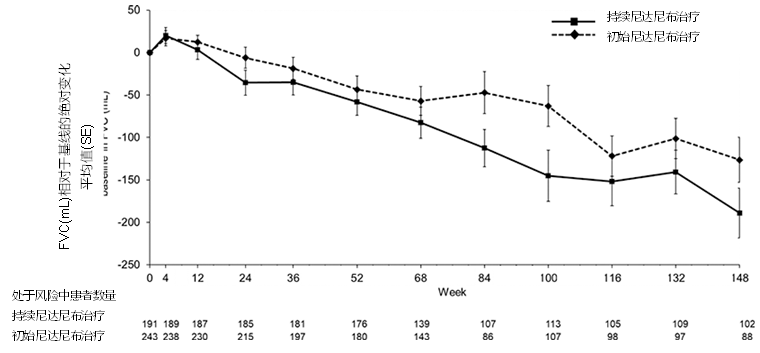
图8. 尼达尼布治疗148周内FVC (mL)的变化
FIBRONEER-ILD™研究:探究BI 1015550在PPF患者中的疗效和安全性
PPF患者的疾病进展、肺功能下降和死亡率与IPF患者相似。BI 1015550是一种磷酸二酯酶4B选择性抑制剂,在一项针对IPF的II期研究中,已被证明可预防肺功能下降,可能为PPF患者提供一种额外的治疗选择(单用或与尼达尼布联用)。
FIBRONEER-ILD™研究是一项双盲、随机、安慰剂对照试验(NCT05321082),正在45个国家约400家研究中心进行,旨在探索使用BI 1015550(有或无尼达尼布背景治疗)在PPF患者中的有效性和安全性。计划将1041例患者以1:1:1的比例随机分配至18 mg BI 1015550每天两次(BID)组、9 mg BI 1015550 BID组或安慰剂组,联合标准治疗,至少治疗52周(图9)。试验于2022年10月启动并开始入组,预计在2023年底完成入组。主要终点是第52周时FVC(mL)较基线的绝对变化。关键次要终点是研究期间至首次急性加重、首次因呼吸系统原因住院或死亡的时间(以先发生者为准)[8]。
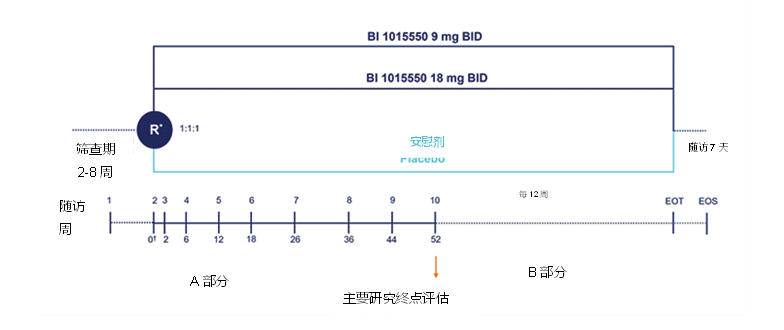
图9. FIBRONEER-ILD™研究设计
按照尼达尼布的基线使用情况(是/否)和高分辨率CT表型(UIP型 vs其他纤维化表型)对患者进行分层。B部分,患者继续接受盲法试验药物治疗,每12周随访一次,直到最后一位患者完成52周治疗。EOS预计将持续130周,预估招募期为18个月。☨第1天;BID,一天两次;EOS:研究结束期;EOT:治疗结束期(最后一位随机患者完成了52周治疗);R:随机化。
IPF的诊断需综合临床、影像学和组织病理学等结果进行多学科讨论。临床上年龄>60 岁,双肺底出现吸气相爆裂音,胸部 X 线或胸部 CT 上出现无法解释的双侧肺纤维化的患者怀疑为IPF[3]。
临床检查:IPF的临床诊断过程采用排除法,需要排除已知引起ILD的全身性疾病或暴露因素,如结缔组织病、药物毒性、工作和家庭中的环境因素[3],进行全面的病史采集、体格检查、肺功能和实验室检查[10]。血清学检测可以帮助排除结缔组织病, 基础检查包括一般的自身免疫和炎症标志物筛查(通过免疫荧光检测的抗核抗体[ANA]、C反应蛋白[CRP]、血沉[ESR])、类风湿关节炎相关自身抗体(环瓜氨酸肽[CCP]、类风湿因子[RF])和筛查肌炎的肌酶(肌酸激酶[CK]、醛缩酶、肌红蛋白)[3]。
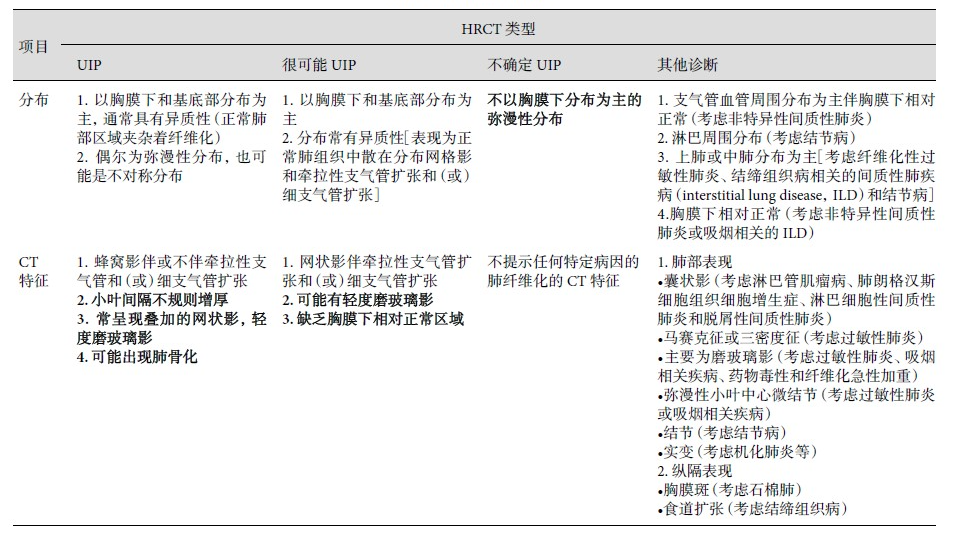
影像学检查:胸部HRCT是诊断IPF的必要手段[8],所有怀疑IPF的患者均应接受HRCT检查[3]。HRCT确定的影像学类型分为“UIP”、“很可能UIP”、“不确定UIP”和“其他诊断”四种类型(表2)[1]。UIP 和很可能 UIP 诊断路径相似,对于 HRCT 上显示“很可能 UIP” 类型并具有高危因素(例如:年龄≥60 岁,男性,吸烟)的患者, 在经过多学科讨论后无需再进行肺活检即可做出IPF 的诊断(图2)[1]。当HRCT显示“不确定UIP”或提示其他诊断时,进一步的诊断检查包括支气管肺泡灌洗液(BAL)的细胞分类、外科肺活检或经支气管镜冷冻肺活检,但这些操作应在并发症风险可接受的患者中进行,并且检测结果有望影响治疗[3]。
表2.IPF的HRCT类型[1]
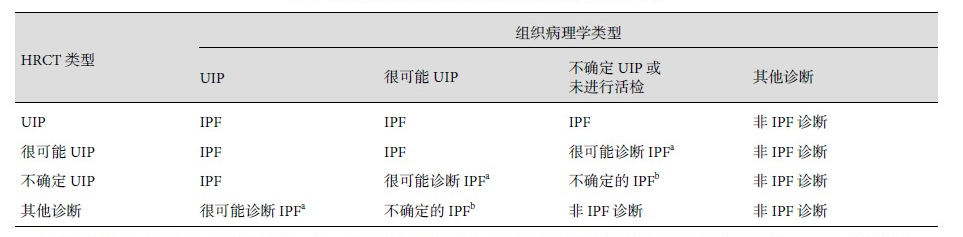
组织病理学检查:2022年最新的成人 IPF 和进展性肺纤维化(PPF)临床实践指南[11](以下简称指南)分为“UIP”“很可能 UIP”“不确定 UIP 或未进行活检”和“其他诊断”四种类型。结合组织病理学分型和 HRCT 分型设定了新的诊断组合(表3),指南[11]强调:由有经验的专家操作TBLC获取肺组织、并请有经验的病理专家解读时,经支气管冷冻肺活检(TBLC)可能是一个可替代外科肺活检(SLB)的合理选择。
表3. 基于HRCT和组织病理的IPF诊断[1]
IPF的治疗包括药物(尼达尼布和吡非尼酮)和非药物(氧疗和/或肺康复)治疗(图3),患者应评估和治疗现有的合并症,包括肺动脉高压、胃食管反流、阻塞性睡眠呼吸暂停和肺癌等。患者可能受益于姑息治疗,以帮助控制症状(咳嗽、呼吸困难和/或焦虑等)。死亡风险增加的患者应在诊断时进行肺移植评估[11]。
另外,指南[11]建议无需常规应用抗酸剂治疗IPF患者,证据表明,抗酸药物的应用与否对疾病的进展、肺功能、不良反应及死亡均无显著影响。对于具有胃食管反流症状的IPF患者,不建议进行抗反流手术。
无论治疗情况如何,监测疾病进展都很重要。定期监测以评估症状恶化、生理参数(即FVC和/或DLCO下降)和/或放射学特征为临床管理提供指导,包括及时发现需要考虑额外治疗的并发症和合并症、制定晚期护理计划,以及及时转入临床试验和为合适的患者进行肺移植[3]。
指南[11]建议应每4-6个月或更频繁地对患者进行疾病进展评估。急性加重可用糖皮质激素治疗。IPF患者出现呼吸衰竭时,一般不推荐机械通气,除非即将接受肺移植。
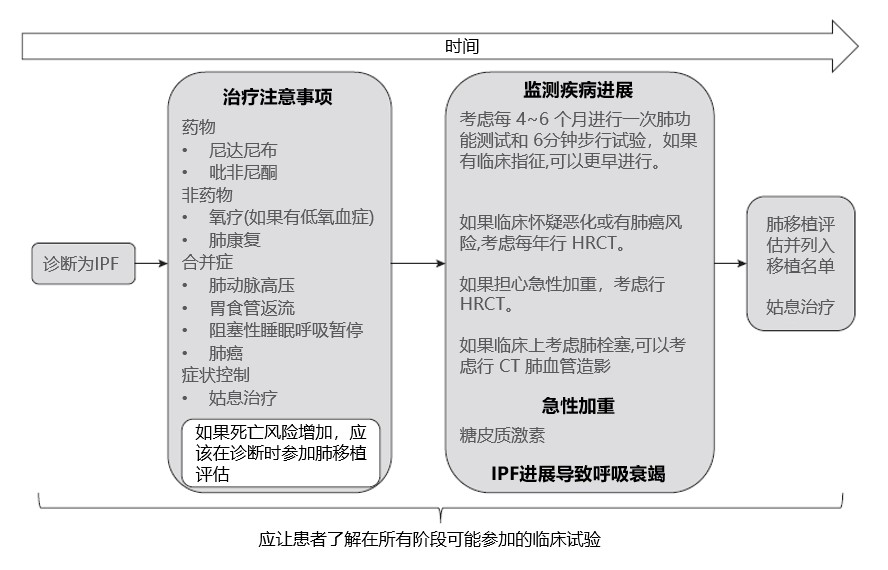
图3. IPF患者的临床管理路径[1]
高分辨率计算机断层扫描(HRCT)在评估和诊断ILD中起着关键作用,然而,过去有研究表明,在评估HRCT上的影像学特征时,观察者间可能存在分歧。一项系统综述与荟萃分析,通过使用2011年和2018年的ATS/ERS/JRS/ALAT指南中的HRCT诊断标准,计算胸部放射科专家之间的观察者间一致性的研究。共纳入9项(共1,560次扫描)研究,总体 kappa 值为0.6[95%CI 0.52-0.68]。研究表明,胸部放射科专家在使用ATS/ERS/JRS/ALAT标准解读IPF患者的HRCT扫描结果时,具有中度一致性11。了解了当前诊断能力的现状,这为人工智能研究提供了一个“基础真相”。
一项对来自37个国家的116名放射科和肺科医生进行的国际研究,以重磅摘要的形式发布。评估了一种基于深度学习开发的人工智能软件SOFIA(系统性客观纤维化成像分析算法),在纤维化性ILD的诊断和预后评估中,对观察者间一致性和预后准确性的影响。根据 ATS/ERS/JRS/ALAT发布的 IPF 指南标准对 HRCT 进行分类,观察者评价了203例疑似IPF患者的HRCT,为每个基于指南的 HRCT 类别分配可能性评分(每个0-100%,总和100%),然后进行SOFIA 评分。
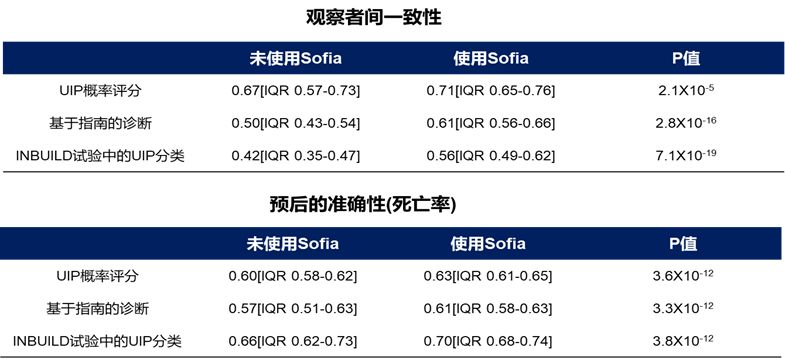
结果显示,SOFIA 改善了所有观察者(不包括ILD放射科医生)的诊断一致性(加权kappa):UIP 概率评分 (0.67 vs 0.71,p=2.1x10-5) 、基于指南的诊断 (0.50 vs 0.61,p=2.8x10-16) 、INBUILD试验中的UIP分类(UIP/很可能UIP vs 不确定/替代诊断) (0.42 vs 0.56,p=7.1x10-19)。放射科医生的 UIP 概率评分的预后(死亡率)准确性良好(n=116,C指数=0.60),并且随着SOFIA的加入而提高(C指数=0.63,p= 3.6x10-12)(表1)。由此可见,在肺纤维化中,AI深度学习辅助的加入可提高 HRCT 的诊断一致性和预后准确性12。
表1:SOFIA可提高 HRCT 的诊断一致性和预后准确性
历年来,有关循环生物标志物预测ILD预后的研究都是ERS大会热点。来自INBUILD试验的事后分析,确定了可能与PPF患者预后较差相关的基线循环生物标志物,共纳入331例接受安慰剂治疗的PPF患者。结果发现,较高的基线s-ICAM(炎症标志物),KL-6、SP-D、CA-125和CA19-9(上皮损伤标志物)以及C5M、C6M和MMP-7(ECM转换标志物)水平与52周内FVC下降率较高相关(图4)。较高的基线s-ICAM、SP-D、CA-125、CA19-9和 CRPM 水平与52周内 ILD 进展(FVC占预计值%的绝对下降≥10%)或死亡风险增加相关(图5)。在整个试验中,较高的 s-ICAM 基线水平与死亡风险增加相关13。
IPF是一种会导致呼吸衰竭和死亡的慢性进展性疾病,预后差。在临床试验中,抗纤维化治疗(AFT)可减缓疾病进展,但其对生存期的影响尚不明确。来自英国的一项回顾性、单中心研究,评估了真实世界中AFT的生存获益,共纳入2007年至2020年间的412例 IPF 患者(155例未接受AFT治疗,257例接受AFT治疗)。结果显示,IPF治疗组的中位生存期显著高于未治疗组(1138(IQR 1018-1257) vs 985(IQR 780-1189) 天,p=0.04214。
参考文献:
1. M. Scheidegger, et al. Characteristics and Disease Course of Untreated Patients with Interstitial Lung Disease Associated with Systemic Sclerosis in a Real-life Two-center Cohort. 2023. EULAR. POS1273.
2. A. Manfredi, et al. Prevalence of Fibrosing Progressive Interstitial Lung Disease in Rheumatoid Arthritis Patients. 2023. EULAR. POS1053.
3. Y. H. Chiu, et al. Progressive Pulmonary Fibrosis in Connective Tissue Disease Associated Interstitial Lung Diseases. 2023. EULAR. POS0953.
4. A. Velauthapillai, et al. Does Early Immunosuppressive Therapy Prevent Systemic Sclerosis Associated Interstitial Lung Disease? 2023. EULAR. OP0239.
5. A. J. Serra Gaspar Silva, et al. Nintedanib in Rheumatic Disease-associated Interstitial Lung Disease – A Multicentre Nationwide Cohort Study. 2023. EULAR. POS1307.
6. B. Atienza-Mateo, et al. Effectiveness of Antifibrotics in Rheumatoid Arthritis-interstitial Lung Disease. National Multicenter Study of 50 Patients in Clinical Practice. 2023. EULAR. POS0864.
7. Y. Allanore, et al. Continued Treatment with Nintedanib in Patients with Systemic Sclerosis-Associated Interstitial Lung Disease (SSc-ILD): Three-Year Data from SENSCIS-ON. 2023. EULAR. POS0126.
8. T. Maher, et al. Design of a Phase III, Randomised, Placebo-Controlled Trial of BI 1015550 in Patients with Progressive Fibrosing Interstitial Lung Disease. 2023. EULAR. POS1329.
本文由吴晓虹教授、盛美玲教授、张齐教授审阅
查看更多