查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





为进一步提高罕见病诊疗规范化水平,保障医疗质量安全,国家卫生健康委组织专家对《第二批罕见病目录》中86个病种分别制定了诊疗指南。小编将重点梳理消化系统相关罕见病的临床诊疗指南,以期为临床医师的诊疗实践提供参考与指导。本期为大家带来胃肠间质瘤的临床诊治指南。


胃肠间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤,多数存在KIT或血小板衍生生长因子受体A(platelet-derived growth fa ctor receptor,PDGFRA)突变。GIST可以发生于胃肠道的任何部位,胃和小肠最常见,偶发于胃肠外。KIT及PDGFRA突变引起的KIT蛋白/PDGFR蛋白功能的改变在多数GIST发病中起重要作用,免疫组化有助于疾病诊断,基因检测可明确详细的突变情况,对指导用药和判断预后具重要价值。近年来,随着基础研究进展,分子病理学、影像学、微创技术等诊疗技术进步,以及药物研发,对GIST生物学行为认识不断深入,疗效有了长足进步,靶向药物与外科手术的整合成为GIST治疗的基石。但除部分局限性患者外,距离治愈还有很长距离。
GIST是胃肠道最常见的间叶组织源性肿瘤,占胃肠道恶性肿瘤的0.1%~3%。现有资料显示全球平均年发病率约(10~15)/100万。中国基于地区报告的年发病率在(4.3~22)/100万。GIST平均发病年龄约60~65岁,小于40岁占比不足10%,男性发病率略高于女性或两者基本接近。原发于胃的GIST最为常见,占50%~60%,小肠GIST占30%~40%,其他原发部位包括食管、结肠及腹膜相对少见。GIST尚无明确的发病原因与流行病学相关因素,KIT/PDGFRA突变是GIST发病的内在因素。
大多数GIST患者起病初期无特异性症状和体征。常见症状表现为腹部不适、腹痛,其次为肿瘤出血以及相关性贫血,同时还可以表现为消化不良、进食困难、腹胀、大便习惯改变等;查体多无明显异常或触及腹部包块等。至少10%~30%患者是在开腹手术、内镜检查或者进行其他影像学检查时无意发现的。约15%~50%的患者在诊断时即有明显转移,偶尔是在因腹膜炎、肠梗阻或者出血行开腹手术时确诊的。
(1)CT增强扫描在GIST病变定性定位、诊断、范围测量、成分评估、周围脏器侵犯、播散转移等方面的评价具有重要价值,作为GIST疗前评估和疗效评价的常规方法。
(2)MRI与PET-CT不做常规推荐,可结合临床具体情况应用。
(1)内镜与超声内镜的诊断意义
消化内镜是目前发现小GIST最常用和最敏感的手段。胃镜、结肠镜、小肠镜及胶囊内镜检查可直观发现5mm以上消化道黏膜下肿瘤,但对胃肠黏膜下病灶的性质无法鉴别。
超声内镜是诊断和鉴别诊断GIST最有价值的手段。对于普通内镜或CT偶然发现的黏膜下肿瘤,尤其是较小病灶,确诊对于后续管理意义重大。对疑诊的黏膜下肿瘤应纳入超声内镜(EUS)的适应证。
(2)内镜与超声内镜下的表现
胃镜下GIST的特征有:突入胃腔呈丘状、半球形或球状隆起,有时仅有细蒂与胃壁相连,常单发,大小不一,无症状者GIST多在0.5~2cm。
超声内镜下GIST一般内部呈不均匀低回声,所在的包膜壁呈“断壁征”,较大病灶可出现肿瘤中心液化或坏死。部分GIST有边缘空晕(牛眼征),是由于肿瘤对周围正常平滑肌的压迫形成的假包膜。
GIST诊断的金标准是病理学诊断,组织病理学是GIST确诊和治疗的依据。病理学检查包括组织形态学、免疫组化与分子检测三部分。
(1)胃肠间质瘤的组织细胞学形态:大多数肿瘤呈梭形细胞形态,约20%~25%的病例为上皮样型,约10%为梭形细胞-上皮样细胞混合型。
(2)胃肠间质瘤免疫组化与鉴别诊断:需与梭形细胞型GIST相鉴别的肿瘤包括平滑肌瘤、平滑肌肉瘤、神经鞘瘤等。需与上皮样GIST的鉴别诊断包括:低分化癌、神经内分泌瘤、血管球瘤等。多通过形态学、与免疫组化进行鉴别。
(3)CD117阴性胃肠间质瘤的诊断:CD117呈阴性而形态学呈上皮样表型,如果DOG1(+),则需要加做分子检测,以确定是否存在PDGFR-α基因突变;如果CD117和DOG1均为阴性,此类病例大多为非GIST。
原发可切除GIST术后复发风险评估系统推荐使用中国GIST专家共识2017版在NIH(2008版)基础上进行优化的改良版(表32-1),其他评估系统尚包括WHO、AFIP、NCCN指南,以及热像图和列线图可作为参考。
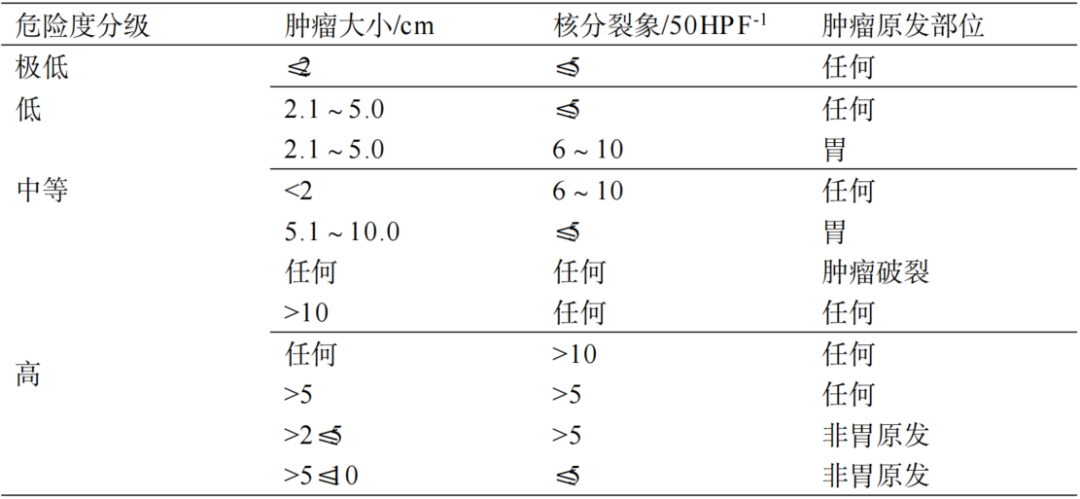
表32-1 原发GIST切除术后危险度分级(NIH 2008改良版)
测序法可包括Sanger测序法和高通量测序,当今较为成熟的高通量测序技术平台包括可逆末端终止测序法、半导体测序法和联合探针锚定聚合测序法,均可用于对KIT和PDGFRA突变的检测。
推荐存在以下情况时,应该进行分子检测:术前拟用靶向治疗者;原发可切除肿瘤手术后,经评估具中-高度复发风险,拟行靶向治疗;所有初次诊断的复发和转移性肿瘤,拟行靶向治疗;继发性耐药需要重新检测;鉴别同时性和异时性多原发肿瘤;鉴别野生型;疑难病例明确是否为胃肠道间质瘤;其他特定情形。
KIT/PDGFRA基因检测突变的位点至少应包括KIT的第9、11、13和17号外显子以及PDGFRA基因的第12和18号外显子。对于继发耐药的患者,应增加检测KIT基因的14和18外显子。
野生型GIST的分子检测,有条件的单位可开展SDHx、BRAF、NF1、KRAS和PIK3CA等基因突变检测,以及ETV-NTRK3、FGFR1-HOOK3和FGFR1-TACC1等融合基因的检测。
小GIST目前特指直径≤2cm的GIST,具有特殊生物学行为。直径<1cm的GIST被称为微小GIST。
通过尸体及标本解剖等研究发现,1/3的老年人可能携带小GIST。远远高于临床发现的GIST发病率。
绝大多数小GIST无明显临床症状。主要通过超声内镜(EUS)、内镜检查、CT、MRI等检查或者术中探查发现。
EUS是目前诊断小GIST最常用及最有效的手段。最大优势是,发现黏膜下低回声肿物来源层次,并通过超声形态进一步确诊。EUS下小GIST常起源于固有肌层,少数起源于黏膜肌层,通常呈现均一的低回声结果,边界清晰。
按照肝外胆管闭锁的解剖部位不同,可分为3型:Ⅰ型,胆总管闭锁;Ⅱ型,肝总管闭锁;Ⅲ型,肝门部肝管闭锁,占90%以上。
(1)手术适应证:局限性GIST原则上可直接进行手术切除;不能切除的局限性GIST,或可以完整切除但风险较大或可能严重影响脏器功能者,宜先行术前靶向药物治疗,待肿瘤缩小后再行手术。位于胃的最大径≤2cm的无症状拟诊GIST,参见本指南小GIST章节。胃的2cm以上局限性GIST,或其他部位的任意大小GIST,一经发现均应考虑手术切除。
靶向治疗后广泛性进展患者,手术治疗不能获益,原则上不考虑手术治疗。靶向药物治疗有效的复发或转移性GIST,在评估所有复发转移病灶均可切除的情况下,可考虑手术切除全部病灶。局部进展的复发转移性GIST,如系统治疗总体有效,仅有单个或少数病灶进展并且可以切除的情况下,可谨慎选择全身情况良好、具备积极治疗意愿的患者行手术切除。术中将进展病灶切除,并尽可能切除更多的转移灶,完成较满意的减瘤手术。
急诊手术适应证:在GIST引起完全性肠梗阻、消化道穿孔、保守治疗无效的消化道大出血及肿瘤自发破裂引起腹腔大出血时,须行急诊手术。
(2)手术原则:对局限性GIST和潜在可切除GIST,手术能够完整切除且不会明显影响相关脏器功能,可以直接手术切除。手术目标是R0切除。如初次手术为R1切除,术后切缘阳性,目前国内外学者均主张术后进行分子靶向药物治疗,而不主张再次补充手术。如再次切除手术简易并且不影响器官主要功能,也可考虑再次切除。GIST很少发生淋巴结转移,一般情况下不必行常规清扫。SDH缺陷型GIST可发生淋巴结转移,如术中发现淋巴结病理性肿大的情况,须考虑有SDH缺陷型GIST的可能,应切除病变淋巴结。
术中探查需注意细心轻柔,尤其对体积较大的GIST,注意识别肿瘤附近的小种植病灶,避免遗漏导致分期移动。同时注意保护肿瘤假包膜的完整,避免肿瘤破溃,否则可显著影响患者预后。
术前评估预期肿瘤难以达到R0切除、需联合脏器切除、可完整切除但手术风险较大者,可考虑药物新辅助治疗。
对复发转移性GIST,首选靶向药物治疗。手术治疗属于辅助的局部治疗手段,应行多学科整合诊治(MDT to HIM)讨论谨慎评估并筛选合适的患者人群。
(3)手术方式:针对不同部位、大小、生长方式的GIST,可通过包括开腹手术切除、腹腔镜手术切除、机器人手术切除、内镜下切除及其他特殊径路(包括经直肠、经阴道、经会阴或经骶等)在内的多种径路开展手术治疗。腹腔镜下间质瘤切除应综合考虑肿瘤大小、部位、保留器官功能等因素,在保证手术原则的情况下进行。目前最新的指南推荐具有丰富腹腔镜经验的外科医生自行评估肿瘤部位是否适合行腹腔镜手术。
(4)酪氨酸激酶抑制剂新辅助治疗:酪氨酸激酶抑制剂(TKI)的术前治疗主要聚焦于伊马替尼治疗进展期GIST,其主要目的在于:有效减小肿瘤体积,降低临床分期,缩小手术范围,最大程度地避免不必要的联合器官切除、保留重要器官的结构和功能,降低手术风险,提高术后生存质量。对瘤体巨大、术中破裂出血风险较大的病人,可以减少医源性播散的可能性。作为体内药物敏感性的依据,指导术后治疗,减少或推迟术后复发转移的可能。
原则上,低危或极低危患者不推荐辅助治疗,中危与高危患者推荐辅助治疗。
辅助治疗唯一推荐药物为伊马替尼。
伊马替尼辅助治疗的最终时限尚无统一结论,依据现有的数据与共识,推荐胃来源的中危GIST,建议伊马替尼400mg/d,辅助治疗1年;非胃来源的中危GIST,建议伊马替尼400mg/d,辅助治疗3年。高危患者,建议伊马替尼400mg/d,辅助治疗3年。肿瘤破裂患者,建议伊马替尼400mg/d,辅助治疗不少于3年。
(1)一线治疗:伊马替尼是转移复发/不可切除GIST的一线治疗药物,一般主张初始推荐剂量为400mg/d;而c-kit外显子9突变患者,初始治疗可以给予600 mg/d。PDGFRA外显子18D842V突变患者,阿伐替尼被推荐为目前唯一的药物治疗选择。
(2)伊马替尼标准剂量失败后的治疗选择:对标准剂量的伊马替尼治疗后出现广泛进展者,建议换用舒尼替尼、瑞派替尼或选择伊马替尼增加剂量治疗。
(3)三线治疗:瑞戈非尼被推荐用于治疗伊马替尼与舒尼替尼失败的转移/不可切除GIST的三线治疗。
(4)四线治疗:瑞派替尼是作为转移性GIST的四线治疗首选推荐。此外,阿伐替尼在Ⅰ期研究显示其用于GIST患者四线治疗亦可进一步获益。
(5)影像学疗效评估:RECIST 1.1是GIST靶向治疗疗效评价的基本标准,能满足大多数GIST靶向治疗评效的要求。GIST伊马替尼治疗后,坏死囊变明显但体积变化不明显甚至增大者,可结合Choi标准客观评估。
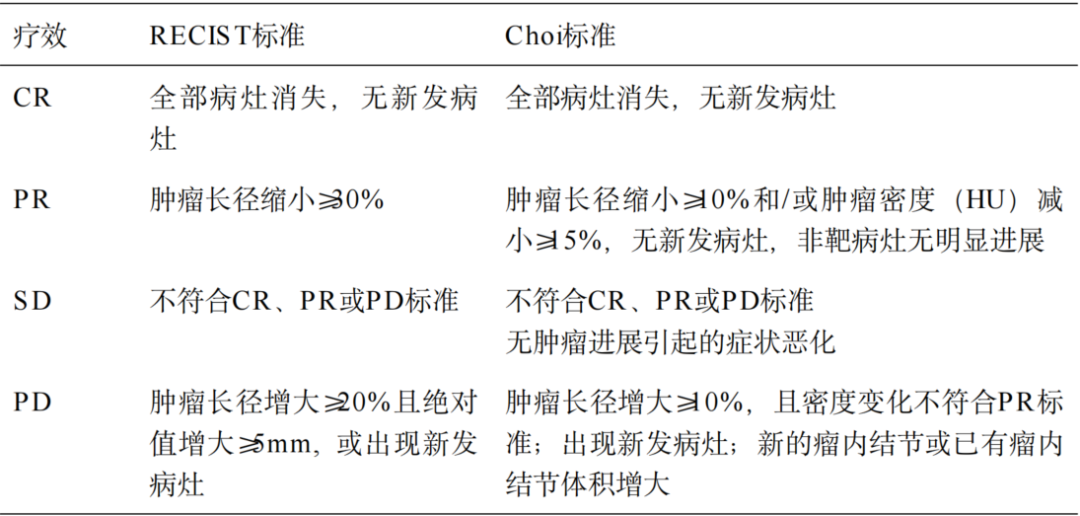
表32-2 RECIST及Choi标准
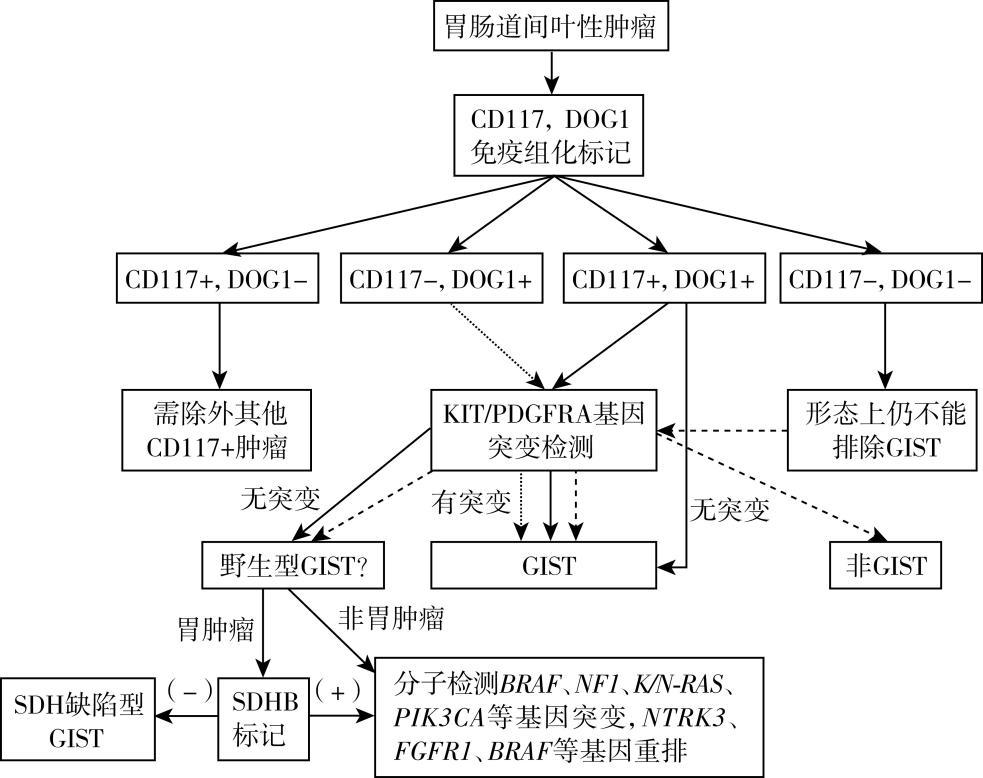
图 32-1 胃肠间质瘤病理诊断流程
[1]Hirota S, Isozaki K, Moriyama Y, e t a l. Ga in-of-function muta tions of c-kit in human ga strointe stina l stroma l tumors. Science ,1998,279(5350):577-580.
[2]He inrich MC, Corle ss CL, Deme tri GD, e t a l. Kina s e muta tions and ima tinib re spons e in pa tients with me ta sta tic ga strointe stina l stroma l tumor. J Clin Oncol, 2003,21(23):4342-4349.
[3]中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)胃肠间质瘤诊疗指南2024,北京:人民卫生出版社,2024.
[4]曹晖,高志冬,何裕隆,等.胃肠间质瘤规范化外科治疗中国专家共识(2018版).中国实用外科杂志,2018,38(9):965-973.
[5]中华医学会消化内镜学分会消化内镜隧道技术协作组,中国医师协会内镜医师分会,北京医学会消化内镜学分会.中国胃肠间质瘤内镜下诊治专家共识.中华胃肠内镜电子杂志,2020,7(4):176-185.
[6]中国胃肠道间质瘤病理共识意见专家组.中国胃肠道间质瘤诊断治疗专家共识(2017年版)病理解读.中华病理学杂志,2018,47(1):2-6.
[7]张信华,何裕隆.复发转移性胃肠间质瘤的外科治疗再评价.中华胃肠外科杂志,2020,23(9):840-844.
[8]徐泽宽,徐皓,李沣员.腹腔镜技术在胃肠间质瘤手术中的应用价值与争议.中国实用外科,2018,38(5):501-504.科杂志,2020,23(9):852-857.
[9]曹晖,汪明.多学科合作模式在胃肠间质瘤诊治中的价值与实施.中华胃肠外科杂志,2012,15(3):231-233.
来源:国家卫生健康委官网
查看更多