查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:广东省医学科学院 广东省人民医院肾内科 李卓 梁馨苓
继发性甲状旁腺功能亢进症(SHPT)是慢性肾脏病(CKD)患者常见的并发症之一,是指由CKD导致的甲状旁腺组织继发性增生、腺瘤形成及血清甲状旁腺激素(PTH)水平升高。钙磷代谢异常、活性维生素D缺乏、甲状旁腺细胞钙敏感受体表达减少、骨对PTH的抵抗等均是其促发因素。
SHPT通常发生在CKD 3期,我国的资料显示从CKD3期开始患者出现钙、磷和PTH异常,且其异常比例随着肾功能下降而增高。在晚期CKD患者中, SHPT的发展导致了慢性肾脏病矿物质和骨异常(CKD-MBD),这些矿物质代谢紊乱可导致骨骼的严重损害、贫血、皮肤瘙痒、神经系统损害、血管和瓣膜钙化,并直接与心血管发病率和死亡率增加以及全因死亡率过高有关。对DOPPS 研究1~3期25588例血透患者的观察性研究发现,当iPTH>600pg/ml时死亡风险明显增加,而当iPTH水平控制在101~300pg/ml时死亡风险降到最低。
尽管良好控制SHPT很重要,但近年来,美国和欧洲的DOPPS数据都描述了透析人群中平均PTH水平的逐步增加。我国透析患者的血清磷达标率与同期DOPPS数据相比还有较大差距。2012年我国大样本横断面调查九省市2074例维持性血液透析患者iPTH达标率仅为26.5%。
目前,我国基层医院对SHPT的重视程度不一,导致不同医院的SHPT识别率和防治效果差别较大。本文重点介绍SHPT的临床表现、诊断依据以及防治策略,希望能对广大肾科医生重视、识别和治疗CKD的这一并发症有所帮助。
SHPT的诊断与监测
SHPT的诊断依据主要为实验室生化指标,如血清钙、磷、PTH、碱性磷酸酶(ALP)活性、25(OH)D等的异常。全面的评估还需要包括骨骼异常、血管或其他软组织钙化及其程度等。2017年KDIGO关于CKD-MBD临床实践指南及2018年中国CKD-MBD诊治指南建议评估与监测方法如下。
实验室生化指标
成人CKD患者,推荐从CKD G3a 期开始监测血清钙、磷、PTH和ALP活性。建议合理的监测频率如表1。
表1 CKD患者不同分期生化指标检测频率

注:对于接受针对SHPT治疗或已经出现血清生化检查异常的CKD患者,建议合理增加检测频率,从而监测病情变化趋势、疗效以及药物不良反应。
骨病变的评价
对于有CKD-MBD证据的CKD G3a~G5期患者,在可能需要根据骨密度结果选择治疗措施时,建议行骨密度检测。如果对肾性骨营养不良类型的诊断会影响治疗决策,则可考虑行骨活检。
血管钙化的诊断和评估
对于CKD G3a~G5D患者,建议使用腹部侧位片来检测是否存在血管钙化,超声心动图可以用来检测是否存在瓣膜钙化,有条件的情况下可采用电子束CT及多层螺旋CT评估血管钙化情况。
建议6~12个月进行一次心血管钙化评估。
CKD G3~G5D患者合并存在血管和(或)心脏瓣膜钙化时,建议将其心血管疾病风险列为最高级别,并可据此指导CKD-MBD患者的管理。
SHPT的临床表现
轻中度SHPT可无症状。
重度SHPT可表现为:
① 退缩人综合征或/和面部畸形(“狮面”面容,见图1);
② 肌肉骨骼症状,骨痛、肌无力、骨骼畸形;
③ 皮肤痛痒;
④ 转移性钙化和小动脉壁钙化,通过CT检测冠脉钙化,使用腹部侧位X线片检测腹主动脉钙化评估发现中国维持性血液透析患者钙化患病率高达58%~94%。

图1 重度SHPT表现:A面部畸形(“狮面”面容);B钙化尿毒症动脉病变(钙化防御);C异位软组织钙化;D血管钙化
表2 重度SHPT钙化病变

SHPT的预防和治疗
CKD G3a~G5D期患者,CKD-MBD治疗应基于对钙、磷及PTH的综合评估。
血清磷、钙及iPTH的目标值
CKD G3a~G5D期,建议尽可能将升高的血清磷降到接近正常范围。
成年CKD G3a~G5D期患者,建议避免高钙血症。CKD G3a~G5D患儿,建议维持血清钙浓度。
非透析CKD G3a~G5D期患者最佳PTH水平目前尚不清楚。iPTH水平进行性升高或持续高于正常上限的患者,建议评估是否存在以下可干预因素:高磷血症、低钙血症、高磷摄入、维生素D缺乏。
建议CKD 5D期患者的iPTH水平维持在正常值上限的2~9倍。
血清钙、磷的管理
2018版中国CKD-MBD指南与2017年KDIGO指南一致,推荐降磷治疗 3D原则:建议控制CKD患者的高磷血症以降低血管钙化风险,防治措施包括限制饮食磷的摄入,选择合适的磷结合剂,充分透析或增加透析对磷的清除及有效控制SHPT。
CKD G3a~G5D期患者,血磷超过目标值,建议应限制饮食磷摄入(800~1000 mg/天),或联合其他降磷措施。限制磷摄入往往会限制蛋白质的摄入,尽量选择相对含磷少或磷吸收率低的食物并选择正确的烹饪方法。
CKD G5D期血透患者,应充分透析,并考虑延长透析时间或增加透析频率,以更有效地清除血磷。
CKD G3a~G5D期患者,应当在血磷进行性、持续性升高时,开始降磷治疗。
CKD G3a~G5D期患者,应限制含钙磷结合剂的使用。
CKD G3a~G5D期患者,应强调磷结合剂使用的个体化。
建议避免CKD患者发生高钙血症以降低血管钙化风险,建议使用钙浓度为1.25~1.5 mmol/L的透析液。
建议准确掌握含钙药物与活性维生素D及其类似物的适应证。
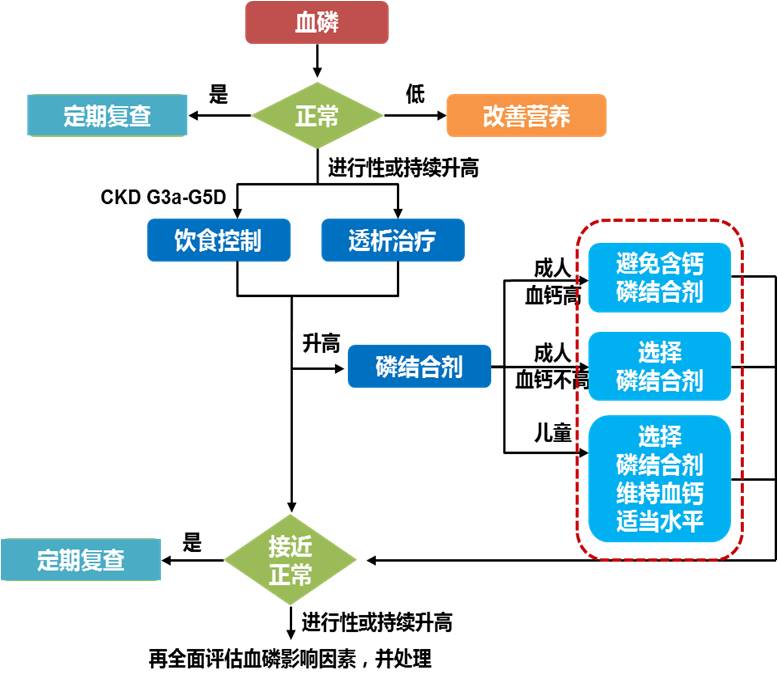
图2 2018年中国CKD-MBD指南血磷控制流程
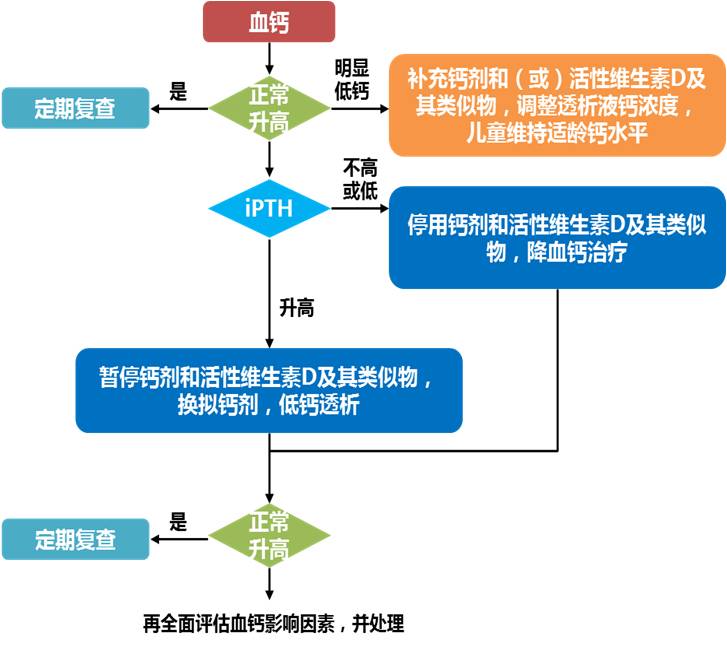
图3 2018年中国CKD-MBD指南血钙控制流程
血清iPTH的管理
建议治疗SHPT并防止甲状旁腺功能低下,合理使用活性维生素D及其类似物、拟钙剂,或实施甲状旁腺切除手术。治疗过程中应监控血钙和血磷水平,避免高钙血症和高磷血症。
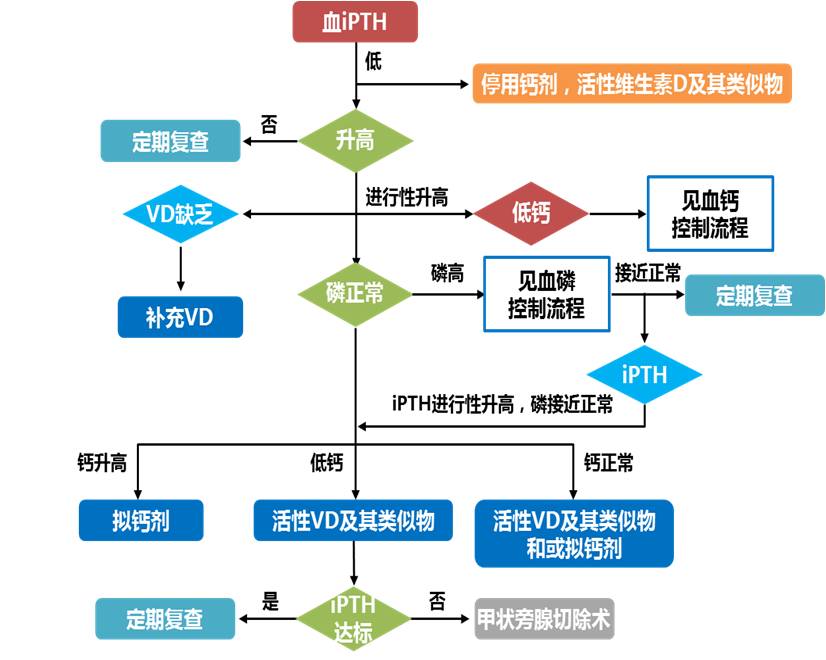
图4 2018年中国CKD-MBD指南SHPT控制流程
病例分享
患者男性,69岁
主诉:发现尿蛋白阳性、血肌酐升高6年。
现病史:6年多前,患者体检发现尿蛋白阳性,血肌酐升高(具体不详),当地医院诊断为“2型糖尿病性肾病”,予药物治疗(具体药物不详),6年来监测血肌酐进行性升高,药物控制效果欠佳,于2012年1月30日确诊为“CKD 5期”,行血液透析治疗至今。
既往史:糖尿病、高血压病史11年;冠心病(PCI术后)11 年。
入院诊断:2型糖尿病肾病,CKD 5期;SHPT;冠心病,心绞痛型(PCI术后,心功能Ⅱ级);高血压Ⅱ级(极高危);肾性贫血。
病情变化:2016年服用碳酸钙600 mg(qd,餐中咀嚼)联合骨化三醇静脉制剂 1μg透析后静脉推注治疗下,查血清钙2.72 mmol/L,血磷 1.14 mmol/L,PTH 314 pg/ml,遂停用钙剂及活性维生素D制剂。1个月后复查血钙2.39 mmol/L,血磷2.37 mmol/L,PTH 885.4 pg/ml。完善相关检查见下图。
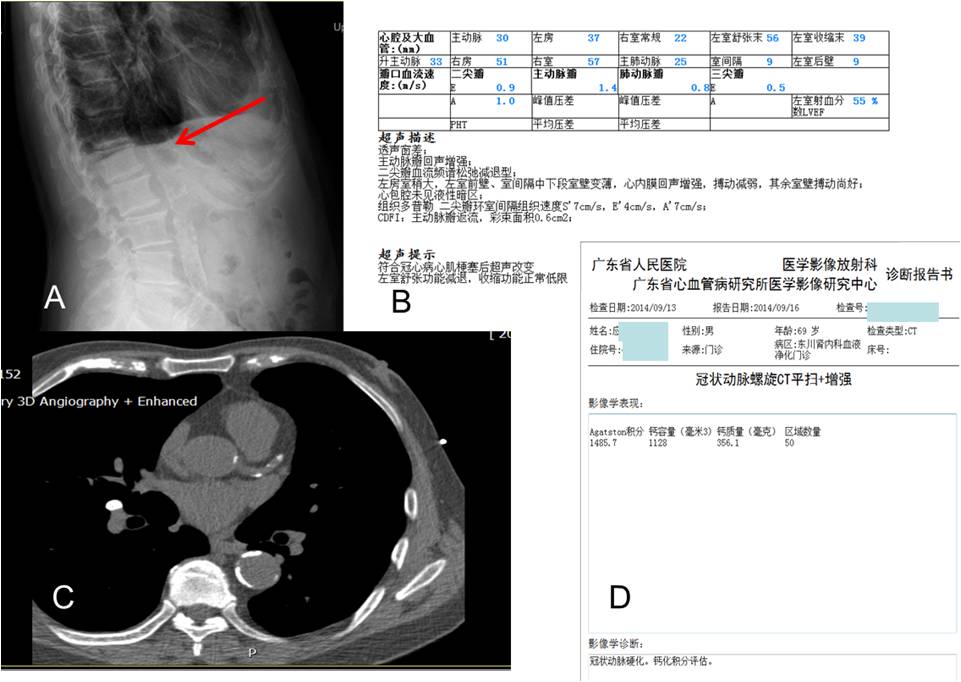
*注:A,腹部侧位片腹主动脉弥漫钙化;B,心脏B超评估结果;C及D,冠脉钙化积分评估图像及结果。
进一步处理:老年男性,糖尿病、冠心病、高血压病史,早期口服及静脉维生素D受体(VDR)治疗有效,但存在高钙血症及异位钙化的副作用,不适合继续使用VDR控制SHPT。改用口服西那卡塞25 mg,qd,联合碳酸镧1片,bid(中、晚餐中咀嚼),每月1~2次监测钙、磷及iPTH,根据结果调整药物剂量。1个月后血清钙2.3 mmol/L,血磷 1.47 mmol/L,4个月后患者iPTH降至310.8 pg/ml。此后患者规律服药并监测相关指标,2018年2月复查冠脉钙化积分为1895.9,钙化进展速度有所延缓,继续规范化管理至今。
相关链接:
陈晓农教授介绍CKD患者继发性甲旁亢的药物治疗(附治疗案例)
本文来自中国医学论坛报“壹生”APP专题报道,如需转载,请联系授权。
查看更多